Blood:发表骨髓微环境组分维持造血干细胞干性新成果
来源:上海交大 2021-12-26 11:12
近日,上海交大基础医学院郑俊克研究员课题组在血液领域国际著名期刊Blood在线发表了题为“Endothelial cell-derived angiopoietin-like protein 2 supports hematopoietic stem cell activities in bone marrow niches”的研究论文。造血干细胞(hema
近日,上海交大基础医学院郑俊克研究员课题组在血液领域国际著名期刊Blood在线发表了题为“Endothelial cell-derived angiopoietin-like protein 2 supports hematopoietic stem cell activities in bone marrow niches”的研究论文。
造血干细胞(hematopoietic stem cells, HSCs)具有自我更新和分化成所有造血细胞的能力,是维持人类正常生命功能的重要成体干细胞之一。随着骨髓移植技术的发展,HSCs已被广泛应用于临床治疗各种血液系统疾病,如白血病、淋巴瘤、贫血以及免疫性疾病等。成体HSCs位于骨髓一个非常特殊的微环境(Niche),骨髓Niche中存在的各种类型细胞及其分泌的有关成分精细调控着HSCs的多种命运,包括自我更新、迁徙、分化和凋亡等。解析骨髓Niche相关成分及其调控HSCs命运的作用机制,有助于理解HSCs干性(即自我更新和分化能力)维持、衰老、恶性转化的分子基础,同时为HSCs的体外扩增和临床应用寻找新的突破口。
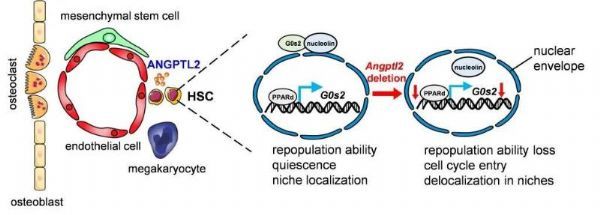
该研究通过特异敲除小鼠Niche内皮细胞、间充质干细胞和巨核细胞中血管生成素样蛋白2(angiopoietin-like protein 2,Angptl2)的表达,证实只有血管内皮细胞来源的ANGPTL2能够维持HSCs的自我更新能力。敲除内皮细胞来源Angptl2可导致HSCs在血管周微环境定位能力下降和静息状态的丧失。在机制方面,内皮细胞来源Angptl2的缺失可导致细胞周期调控蛋白G0s2显着下调,并进一步影响核素定位而导致G0期逃逸;ANGPTL2主要通过维持PPARD水平而直接转录调控G0s2的表达以实现对HSCs干性精细调控。这些研究成果不仅有助于理解骨髓微环境中HSCs干性维持的微环境成分的特定组成和作用基础,也为HSCs的体外扩增与应用以及白血病的靶向治疗策略的开发提供新的思路。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->