KRASG12C突变肺癌靶向药!KRASG12C抑制剂adagrasib在美国进入审查,再鼎医药引进中国!
来源:本站原创 2022-02-17 00:00
数据表明,adagrasib治疗的客观缓解率(ORR)达43%、疾病控制率80%。

2022年02月16日讯 /生物谷BIOON/ --Mirati Therapeutics公司近日宣布,美国食品和药物管理局(FDA)已受理精准肿瘤学药物adagrasib(MRTX849)的新药申请(NDA):用于治疗既往接受过一次系统治疗的非小细胞肺癌(NSCLC)患者。FDA已指定该NDA的《处方药用户收费法(PDUFA)》目标日期为2022年12月14日。
FDA将通过加速审批(Accelerated approval)途径对adagrasib NDA进行审查,该途径允许基于替代终点批准治疗严重疾病且填补未满足医疗需求的新药。此外,该申请也将通过FDA实时肿瘤学审查(RTOR)试点项目进行审查,该项目旨在探索一种更有效的审查流程,以确保尽早向患者提供安全有效的药物。
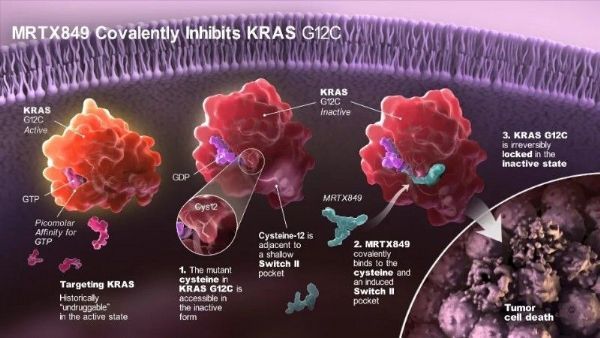
adagrasib是一款在研的高度选择性、强效、口服小分子KRASG12C抑制剂,经优化可持续靶向抑制,这一特性对于治疗KRASG12C突变癌症非常重要,因为KRASG12C蛋白每24-48小时再生一次。目前,adagrasib正被评估作为单药疗法、与其他抗癌疗法联合治疗晚期KRASG12C突变实体瘤患者,包括非小细胞肺癌(NSCLC)、结直肠癌和胰腺癌。
2021年6月,再鼎医药与Mirati达成一项价值3.38亿美元的许可协议,获得了在大中华区开发和独家商业化adagrasib的权利。
adagrasib(MRTX849)作用机制(图片来源:globecancer.com)
adagrasib NDA基于KRYSTAL-1研究2期支持注册队列的数据。该队列在先前接受过免疫疗法和化疗(联合或贯续)治疗、携带KRASG12C突变的晚期NSCLC患者中开展,评估了adagrasib 600mg每日2次(BID)方案。
该队列的阳性数据已于2021年9月公布,截至2021年6月15日中心独立审查的结果:在意向性治疗(ITT)人群中,中位随访9个月,adagrasib 600 BID治疗的客观缓解率(ORR)为43%,疾病控制率(DCR)为80%。重要的是,有98.3%的患者先前接受过免疫疗法和化疗。安全性和耐受性与之前报道的一致。
该队列的详细数据,将在2022年上半年举行的医学会议上公布。目前,Mirati公司正在开展一项3期验证性试验KRYSTAL-12,比较adagrasib与多西他赛(docetaxel)二线治疗KRASG12C突变NSCLC患者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->