BMC Medicine | PCDHGB7 基因甲基化检测作为HPV阳性患者分流的方法具有极大优势和突出的临床性能
来源:生物探索 2024-03-02 11:01
这项基于高危型HPV阳性妇女的前瞻性研究揭示了,CerMe检测是一种高效且独立于病理学家主观经验的分子检测,可以反映宫颈癌患病的真实风险。
中国福利会国际和平妇幼保健院(上海交通大学医学院附属国际和平妇幼保健院)王玉东教授团队联合复旦大学生物医学研究院于文强教授团队合作在国际期刊BMC Medicine(IF 11.8)发表了题为“PCDHGB7 hypermethylation based Cervical cancer Methylation (CerMe) detection for the triage of high-risk human papillomavirus positive women: A prospective cohort study”的论文(图1a)。该研究在超过3000例的临床大样本中验证并发现PCDHGB7 基因甲基化检测作为HPV阳性患者分流的方法具有极大优势和突出的临床性能。相较于TCT,PCDHGB7基因甲基化检测(CerMe)表现出更优异的敏感性、特异性、阳性预测值、阴性预测值;该技术作为一种准确、高效、方便、快捷以及去经验化的检测手段,有效减少由于发达地区与贫困地区病理诊断水平差异带来的宫颈癌漏诊误诊。

图1a
前瞻性筛查大队列研究,提出hrHPV阳性患者的无创检测分流新策略
高危型人乳头瘤病毒(hrHPV)检测是目前国内外指南首位推荐的宫颈癌筛查手段,大大降低了宫颈癌的发病率和死亡率。然而大部分hrHPV感染为一过性,以致于大量hrHPV阳性患者需接受不必要的阴道镜转诊。而作为目前最常用的分流策略,细胞学检查敏感性较低,且受到主观因素的影响。因此,开发一种高效、无创且客观的分流方法,以减少hrHPV阳性患者过度转诊是宫颈癌精准防治的迫切需求。
该研究建立了一个纳入3251名hrHPV阳性女性的前瞻性队列,留取宫颈脱落细胞检测剩余样本进行了PCDHGB7 甲基化检测,以此开发了能有效区分宫颈上皮内瘤变1级及以下(CIN1-)和CIN2及以上(CIN2+)的CerMe检测,其灵敏度为82.4%,特异度高达91.1%。与细胞学检测相比,CerMe检测减少了62.2%(383/616)非16/18型hrHPV阳性女性的转诊,显示出更为优越的特异度(92.0%对74.9%);在hrHPV16/18型阳性女性中,CerMe检测减少了26.0%(77/296)的转诊,显示出明显增高的灵敏度(80.7%对61.5%)和特异度(88.5%对75.3%);在细胞学为ASC-US或LSIL的hrHPV阳性患者中,CerMe作为分流策略也表现良好。此外,CerMe半定量分层分析可以作为阴道镜检查和病理活检的参考指标,其与细胞学分层的联合检测(MeCy)可以在一定程度上防止CIN2+的漏诊,特别是病灶隐匿的宫颈腺癌的漏诊。后续的研究将通过对高危患者的随访,探索CerMe检测对疾病进展的预测价值。
全癌标志物靶点历久弥新,PCDHGB7 甲基化检测探无止境
作为本研究的前期工作基础,早在2021年6月,团队在Clinical and Translational Medicine国际期刊(2020 IF=11.492)发表了题为“Hypermethylated PCDHGB7 as a universal cancer only marker and its application in early cervical cancer screening”的论文(图1b),首次展现了“全癌标志物” PCDHGB7 的发现历程及其对于癌症研究和宫颈癌早期筛查的重要意义。全癌标志物是一系列肿瘤的共有标志物,目前已发表的全癌标志物有HIST1H4F、PCDHGB7 和SIX6[2-4],在前期研究中,研究人员已经在宫颈组织和脱落细胞学、阴道分泌物等样本中验证了PCDHGB7 基因甲基化检测作为宫颈癌筛查手段的可能性,并确定PCDHGB7 可以作为宫颈癌早期诊断的标志物,但尚缺乏大样本的临床验证。

图1b
PCDHGB7 基因甲基化检测,精准分流高危hrHPV人群
在最新发表的研究中[5],研究人员在大样本临床队列中对PCDHGB7 基因甲基化检测宫颈癌的效能进行验证。研究者收集了3251名30-82岁的hrHPV阳性妇女的宫颈脱落细胞样本(图2),建立宫颈癌PCDHGB7 基因甲基化检测模型(CerMe),评估CerMe作为hrHPV阳性人群分诊的性能表现。CerMe表现出对宫颈癌CIN1和CIN2+有效地区分能力(图3),且在与细胞学分诊效能的对比中(图4),展现出优秀的特异性(91.1% vs. 77.9%)和敏感性(82.4% vs. 65.9%)。考虑到我国地区间医疗资源分布失衡,基层医院在病理诊断方面严重人员不足,CerMe作为一种去经验化、方便、快捷的检测手段,为宫颈癌筛查和诊疗带来全新的解决方案。
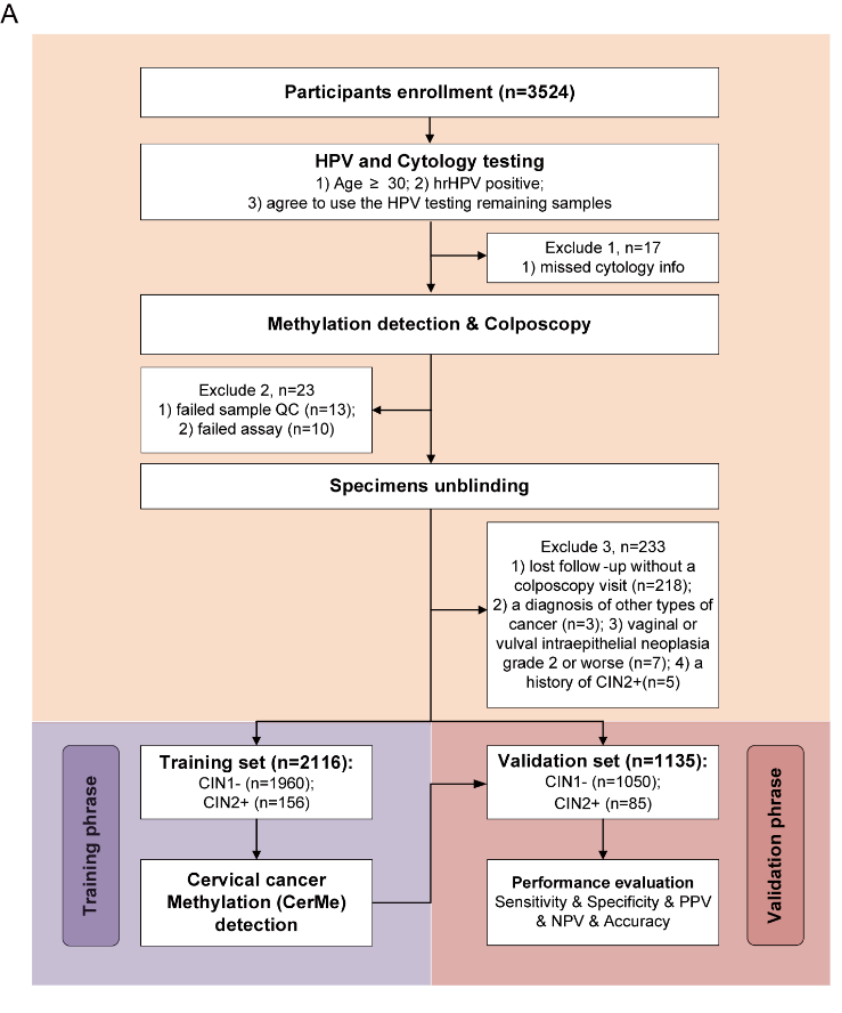
图2.CerMe检测的临床研究流程图 (Credit: BMC Medicine)
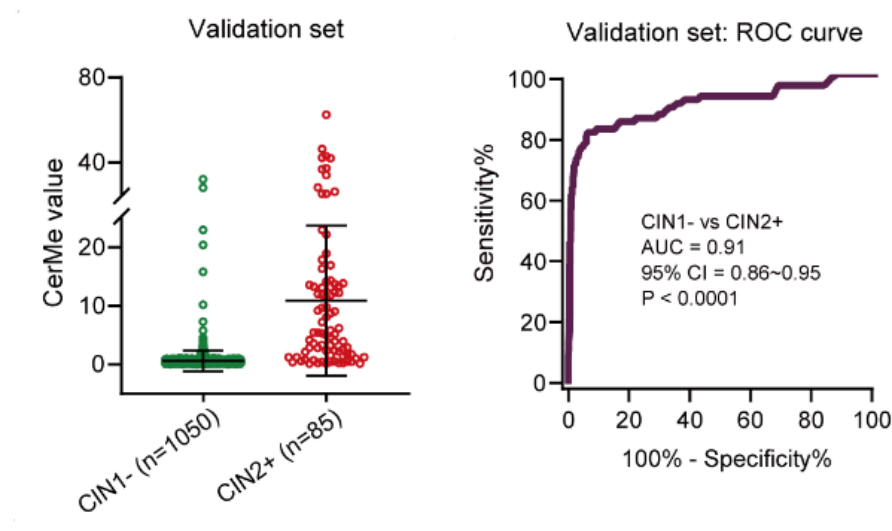
图3. CerMe检测可以有效区分宫颈癌前病变 (Credit: BMC Medicine)
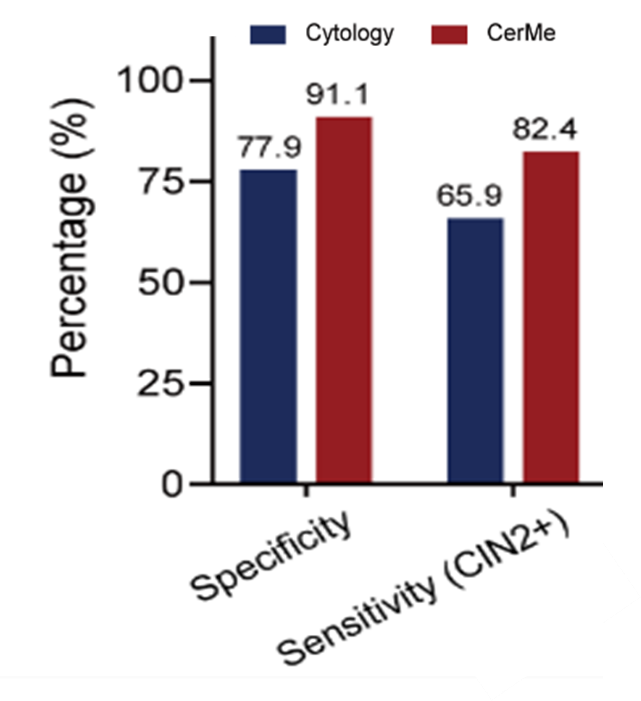
图4. CerMe检测相较于细胞学具有更优的hrHPV阳性人群分诊能力Credit: BMC Medicine)
规范诊疗露锋芒!CerMe检测有效减少阴道镜转诊
在宫颈癌常规筛查中hrHPV16/18型阳性的女性常被建议直接转诊阴道镜;而其他12型hrHPV阳性的女性则建议先进行宫颈脱落细胞学检查,当检查结果 ≥ASCUS时再转诊阴道镜。我国20岁及以上普通女性人群的HPV总感染率为15.0%[6],过度的阴道镜转诊加重了社会经济负担。研究者进一步分析了CerMe在不同亚型hrHPV感染妇女中的分诊效能,在其他12型hrHPV阳性女性中,CerMe检测使转诊率减少了 62.2%,展现了优越的特异性(92.0% vs. 74.9%);在HPV16/18型阳性女性中,CerMe检测的特异性为88.5%。总体来说,CerMe检测为hrHPV阳性妇女提供了一种最佳的分诊策略,以减少阴道镜检查的过度转诊,特别是在医疗资源紧张的地区。
拨开迷雾见真章!CerMe检测真实评估宫颈癌的患癌风险
HPV分型和细胞学检测均很难评估女性患癌的真实风险,CerMe 检测是否能回答这个问题?该研究计算了阴道镜检(正常,CIN1,CIN2/3,宫颈癌)在CerMe分层结果中的占比,在阴道镜检正常的人群中CerMe的NPV高达98.1%,CerMe强阳性的PPV高达90.6%(NPV=真阴性人群/检测阴性人群,PPV=真阳性人群/检测阳性人群)(图5),这提示强阳性CerMe患者的患癌风险更高。同时,我们进一步比较了CerMe阳性在阴道镜检结果中的占比,我们也观察到阳性CerMe的占比随疾病进展逐步升高(正常:7.5%;CIN1:16.7%;CIN2/3: 74.4%;宫颈癌:97.6%)。我们从正反两个方面证明了CerMe能够评估真实的疾病风险,CerMe强阳性患者患病的真实风险极高,值得临床的进一步关注,有助于消除HPV阳性患者的焦虑和烦恼,通过CerMe检测做到心中有数,心中不慌。
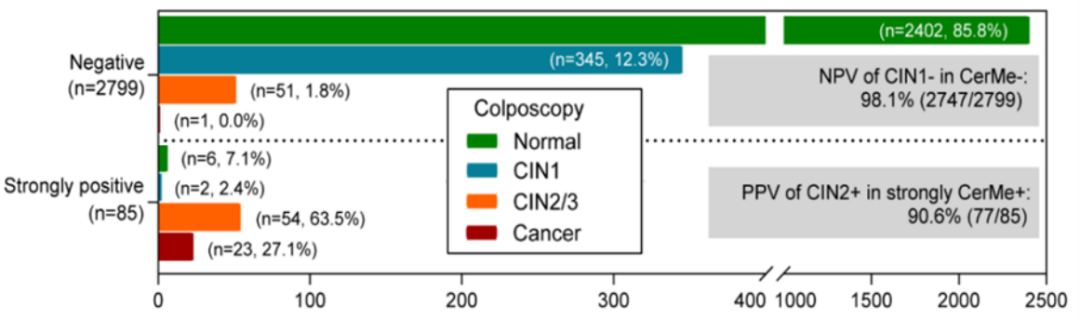
图5. CerMe值越高疾病发生风险越高(Credit: BMC Medicine)
无所遁形卸伪装!CerMe检测有效减少宫颈腺癌漏诊
宫颈腺癌病变来源于宫颈管内柱状上皮细胞(单层),发病位置相对隐秘,妇检阳性体征不明显。大约有15%的宫颈腺癌的发病与HPV感染无关,所以这部分病例对现有筛查方法不敏感。研究者比较了CerMe与细胞学检查在hrHPV阳性女性的宫颈鳞癌(SCC)和宫颈腺癌(AC)检测中的表现。结果显示,CerMe对宫颈腺癌(90% vs. 60%)和宫颈鳞癌(100% vs. 78.1%)检测性能均高于细胞学检测(图6)。CerMe检测有效弥补了常规宫颈癌筛查手段对于宫颈腺癌漏诊的缺陷。
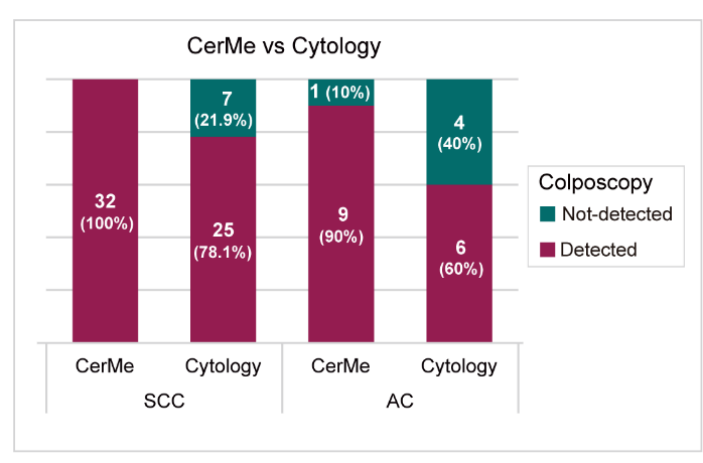
图6. CerMe检测可以有效防止宫颈腺癌漏诊(Credit: BMC Medicine)
全癌标志物牵手真实世界大队列,既减少过度诊疗又有效避免漏诊和误诊
这项基于高危型HPV阳性妇女的前瞻性研究揭示了,CerMe检测是一种高效且独立于病理学家主观经验的分子检测,可以反映宫颈癌患病的真实风险。该检测可直接使用HPV DNA检测样本,无需重新采样,最大限度地减少了患者和医生的负担;能够有效降低筛查项目中最常见的ASC-US和LSIL细胞学人群以及一些非持续性感染的hrHPV阳性患者中的不必要阴道镜检查,避免过度诊断和治疗。
共谱诊疗新篇章!全癌标志物助力临床叩开精准防治宫颈癌的新大门
该研究由上海交通大学医学院附属国际和平妇幼保健院王玉东教授、复旦大学上海医学院生物医学研究院于文强教授共同指导完成。上海交通大学医学院附属国际和平妇幼保健院宫颈科曹丹博士与复旦大学生物医学研究院杨智聪博士为本文共同第一作者。本研究获得上海科学技术委员会和上海市卫生健康委员会等项目的资助。
国妇婴宫颈科自2019年获批为上海交通大学医学院宫颈疾病诊治中心,建立了全方位、标准化的宫颈癌及癌前病变筛查、诊治和随访体系,在长三角乃至全国范围内均处于领先地位。宫颈科吴丹主任及其团队在宫颈癌和癌前病变的诊断和治疗方面积累了丰富的临床经验,并取得了多项科研突破。从医20余年来,王玉东教授带领团队始终致力于妇科肿瘤的治疗,年手术量逾1000例。他创新性地提出了宫颈癌微创手术——“打坎儿井”术式并在临床治疗中广泛运用,显著提高了宫颈癌的手术治疗效果。此外,王玉东及其团队立足妊娠合并妇科恶性肿瘤的临床治疗和基础研究,倡导妇科肿瘤的多学科联合治疗,在妊娠合并恶性肿瘤、恶性肿瘤患者的生育力保存等方面积累了丰富的经验并取得多项突破。王玉东团队从2015年开始,对社区适龄妇女进行宫颈病变筛查,并针对1000名宫颈病变患者进行追踪观察,对病变患者的临床信息、病理信息和生物信息进行整合分析,评估各种风险因素与疾病进展的相关性。此外,王玉东团队还开展了基于人工智能的宫颈癌早期sh研究。他们将人工智能技术应用于宫颈细胞学筛查中,开发了一种基于深度学习的宫颈癌筛查模型。近年来王玉东团队对宫颈癌早期发现的研究重点集中在DNA甲基化与宫颈癌的发生及发展关系,并验证了PCDHGB7 基因甲基化检测可以作为宫颈癌筛查和早期发现的手段并能有效弥补现有细胞学和高危型HPV检测技术的不足。
于文强教授团队在DNA 甲基化领域深耕二十余年,在此期间开发了全新的拥有自主知识产权的全基因组 DNA 甲基化检测方法GPS (Guide Positioning Sequencing),即“导向定位测序”。该测序技术突破WGBS技术比对率低的瓶颈,GPS技术将CpG岛的检测覆盖率提高到96%,并绘制全球首个单碱基精度的全基因组DNA甲基化图谱,GPS 技术大大提高DNA 甲基化测序的准确性。基于GPS 技术对全基因组DNA高精度和高覆盖度的甲基化检测,于文强教授团队找到了在肿瘤中共有的一类甲基化位点,并在全球首次提出“全癌标志物” (Universal Cancer Only Marker, UCOM) 概念,进而发现了一系列TAGMe®全癌肿瘤标志物。截至2024年1月,这些全癌肿瘤标志物已完成9万多例临床样本双盲验证,组织样本总体符合率达90%。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


