DNA损伤后SIRT5介导的赖氨酸120脱琥珀酸化抑制p53功能
来源:本站原创 2021-11-03 18:06
P53是一种经典的肿瘤抑制因子,通过诱导细胞停止以修复损伤或细胞凋亡来消除受损细胞以应对不同类型的应激,从而维持基因组的稳定。p53的翻译后修饰(PTMs)被认为是调节p53活化最有效的途径。
P53是一种经典的肿瘤抑制因子,通过诱导细胞停止以修复损伤或细胞凋亡来消除受损细胞以应对不同类型的应激,从而维持基因组的稳定。p53的翻译后修饰(PTMs)被认为是调节p53活化最有效的途径。在这里,作者证明了SIRT5与p53相互作用并抑制其转录活性。
利用质谱分析,作者鉴定了p53一个之前未知的PTM,即p53在赖氨酸120 (K120)处的琥珀酰化。SIRT5介导p53在K120处的去琥珀酰化,从而抑制p53的激活。此外,利用双敲除小鼠(p53 / Sirt5 /),作者验证了DNA损伤时p53靶基因表达的抑制和细胞凋亡依赖于细胞p53。该研究确定了p53的一种新的PTM,它调节p53的激活,并揭示了SIRT5作为去琥珀酰化酶的新靶点。
图片来源:https://doi.org/10.1038/s41418-021-00886-w
肿瘤抑制因子p53位于一个中心信号节点,通过诱导细胞周期阻滞、衰老和凋亡介导细胞对各种压力的反应。作为基因组的守护者,p53在50%以上的人类癌症中发生突变,因此在所有肿瘤抑制基因中排名第一。正常情况下,p53受到严格调控,其蛋白产物水平低,周转率高。然而,在各种胁迫下,p53迅速稳定,在细胞中的转录活性显著增加。
许多调控p53功能的机制已经被提出; 然而,p53激活的确切机制仍然没有被完全理解。在这些机制中,p53的翻译后修饰(PTMs)通常被认为是最有效的,包括磷酸化、泛素化、乙酰化、甲基化、sumo化、泛素化、O-GlcNAcylation、adp -核糖基化、羟基化和β-羟丁基化。
琥珀酰化是最近发现的一种新型PTM,其代谢衍生的琥珀酰辅酶a修饰蛋白质赖氨酸基团,导致蛋白质从正向负翻转,与其他PTM相比,质量增加相对较大。在过去的几年里,已经发现了被琥珀酰化修饰的蛋白质。
虽然蛋白质琥珀酰化已经引起了更多的关注,但线粒体内负责琥珀酰化的酶还没有被确定。这促使科学家们提出假设,蛋白质的琥珀酰化是通过琥珀酰辅酶a和修饰蛋白之间的直接反应,而线粒体的条件(琥珀酰辅酶a的丰度,PH值)可能是关键的控制因素。然而,SIRT5,一种sirtuin家族成员,主要位于线粒体中,几乎没有可检测到的去乙酰化酶活性,已被证明在赖氨酸残基上具有强大的去琥珀酰化活性。
SIRT5已被证明通过多种机制促进肿瘤发生。作为一种重要的肿瘤抑制因子,p53在大多数癌症中失去其功能。这提出了一个有趣的问题,即SIRT5是否也通过调节p53活性在肿瘤发生中发挥作用。此外,鉴于琥珀酰CoA是代谢中间体之一,琥珀酰化将代谢中间体与蛋白质功能的修饰联系起来。然而,这种反应似乎并不需要假定的琥珀酰转移酶。
有趣的是,sirt5介导的赖氨酸去琥珀酰化明显影响各种代谢途径。p53作为调节许多生理和病理过程的重要因素,在多个方面影响代谢。然而,代谢中间体如琥珀酰辅酶a或sirt5介导的赖氨酸去琥珀酰化是否能够调节p53的功能仍不清楚。进一步解决这些问题不仅会让人们清楚地了解SIRT5在肿瘤发生中的作用,还会为人们提供有关代谢物和p53功能之间关系的信息。
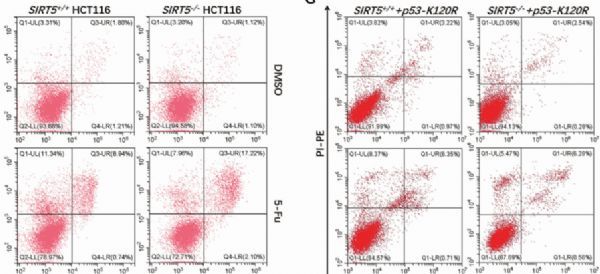
干扰SIRT5不会增强P53在赖氨酸120位的乙酰化;过表达SIRT5不会影响P53-K120R突变体的转录活性
图片来源:https://doi.org/10.1038/s41418-021-00886-w
在本研究中,为了深入了解SIRT5对p53功能的影响以及SIRT5影响p53功能的机制,作者检测了SIRT5对p53活性的作用,并检查了SIRT5对p53功能的影响是否由其去琥珀酸酶活性介导。作者发现SIRT5抑制p53的转录活性。进一步的研究表明,SIRT5介导p53赖氨酸120 (K120)的去琥珀酰化,导致p53激活受损。这些发现表明,SIRT5通过去琥珀酰化K120 p53抑制p53活性的关键作用。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。