9月Nature杂志重磅级亮点研究成果解读!
来源:生物谷原创 2025-09-29 10:15
时光总是在不经意间匆匆流过,转眼间9月份即将结束,在即将过去的9月里,Nature杂志又有哪些亮点研究值得一读呢?小编对相关亮点文章进行了筛选整理,分享给大家!
【1】Nature:人类大脑衰老的基因密码——科学家成功绘制出从婴儿到百岁老人的单细胞图谱
doi:10.1038/s41586-025-09435-8
在当今社会,随着医疗技术的不断进步和生活水平的显著提高,人类的平均寿命正在逐步延长。然而,随着年龄的增长,大脑的衰老问题也日益受到关注。流行病学数据显示,全球约有5000万阿尔茨海默病患者,这一数字预计到2050年将增长至1.52亿;此外帕金森病等神经退行性疾病也严重影响着老年人的生活质量,这些疾病的发生与大脑衰老过程中基因表达和基因组变化密切相关。那么,大脑在衰老过程中究竟发生了哪些变化?这些变化又是如何影响我们的认知功能和健康呢?
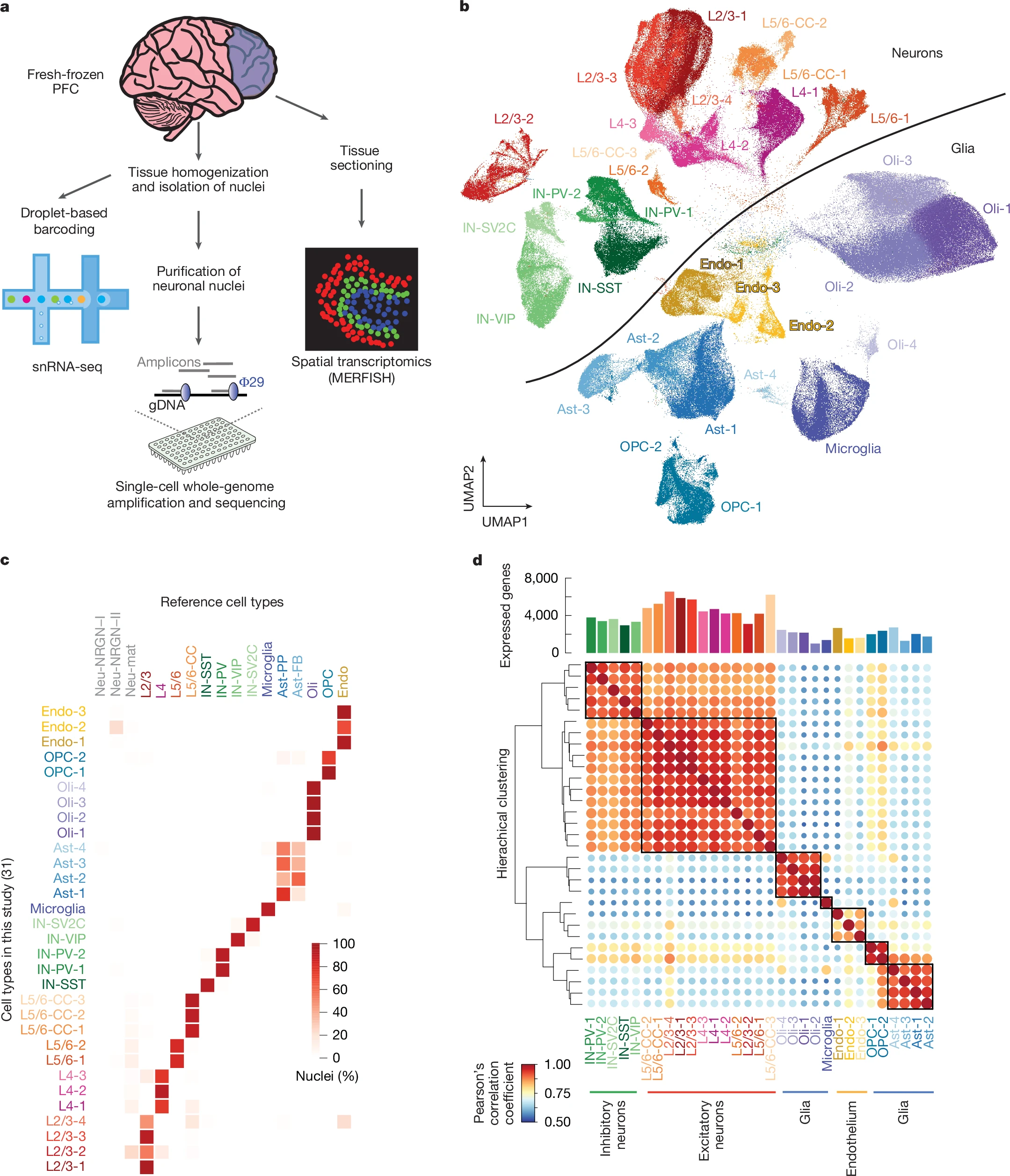
人类前额叶皮质中基于微滴的snRNA-seq的研究设计和表征
日前,一篇发表在国际杂志Nature上题为“Single-cell transcriptomic and genomic changes in the ageing human brain”的研究报告中,来自马萨诸塞大学陈医学院等机构的科学家们为了深入探究人类大脑衰老的分子机制,利用单细胞核RNA测序(snRNA-seq)、单细胞全基因组测序(scWGS)和空间转录组学技术分析了从婴儿到百岁老人的人类前额叶皮层(PFC)的基因表达和基因组变化;研究人员旨在揭示大脑在衰老过程中的基因表达模式和基因组变化,从而为理解大脑衰老的分子基础提供新的视角,并为相关神经退行性疾病的预防和治疗提供理论依据。
文章中的实验对象为19名神经典型供体,其年龄从婴儿到百岁老人不等;研究人员从这些供体的新鲜冷冻前额叶皮层中提取了367,317个细胞核并进行了高质量的单细胞核RNA测序。通过降维和层次聚类分析,他们将这些细胞核分为31个不同的细胞簇,主要涵盖兴奋性神经元、抑制性神经元、小胶质细胞、少突胶质细胞、少突胶质细胞前体细胞、星形胶质细胞和内皮细胞等多种细胞类型。此外,他们还利用空间转录组学技术对部分供体的前额叶皮层进行了分析来验证单细胞核RNA测序的结果。
【2】重大突破!Nature:CRISPR - Cas9 除基因编辑外,竟还能这样调控细菌免疫
doi:10.1038/s41586-025-09577-9
在生物技术领域,CRISPR-Cas9 早已是家喻户晓的 “基因剪刀”——从遗传病治疗到作物育种,它的应用几乎贯穿整个生命科学研究。但很少有人知道,这个强大工具在细菌自己的 “免疫战场” 上,还藏着一套鲜为人知的 “调节技能”。近日,密歇根大学团队在Nature杂志发表重磅研究,首次揭示:CRISPR-Cas9 中的Cas9 蛋白,除了作为 RNA 引导的核酸酶切割 DNA,还能在没有crRNA(CRISPR RNA) 和tracrRNA(反式激活 CRISPR RNA) 陪伴时,像 “免疫哨兵” 一样感知细胞内 crRNA 的水平,动态调节细菌的 “免疫记忆” 深度——当记忆库空虚时加速补充,当记忆充足时及时 “刹车”,既帮细菌对抗病毒,又避免误伤自身。
细菌和病毒的 “军备竞赛” 从未停歇,而 CRISPR-Cas 系统是细菌最核心的 “免疫武器”:它会将入侵病毒的 DNA 片段(称为 “间隔序列”)整合到自身基因组的 CRISPR 数组中,形成 “免疫记忆”;后续再遇到同种病毒时,数组转录出的 crRNA 会引导 Cas9 精准切割病毒 DNA。据估计,全球约 50% 的细菌都携带 CRISPR-Cas 系统,在某些环境中这一比例甚至更高——足以见得它对细菌生存的重要性。但长期以来,科学家们只知道 Cas9 需要 crRNA/tracrRNA 才能发挥切割作用,却不清楚当这两种 RNA 缺失时,Cas9 是否还有其他功能,更不知道它如何调控 “免疫记忆” 的更新节奏。为解开这个谜题,研究团队以脑膜炎奈瑟菌(Neisseria meningitidis) 为研究模型——这种细菌携带 II-C 型 CRISPR-Cas 系统,且容易被MDAΦ 噬菌体感染(该噬菌体不会裂解细菌,但会整合到宿主基因组影响致病性)。
他们通过基因编辑构建了多种突变菌株:比如R26 菌株(仅保留 CRISPR 数组的一个重复序列,无法产生成熟 crRNA,相当于 “crRNA 缺失型”)、Δtracr 菌株(缺失 tracrRNA),以及 Cas9 结构突变体(如Cas9H1024A,破坏其 PAM 结合位点,无法识别病毒 DNA 的 PAM 序列)。同时,他们用转录组测序、Northern blot(检测 crRNA/tracrRNA 水平)、Western blot(验证 Cas9 蛋白表达)和高通量测序(分析新获取的间隔序列)等技术,全面追踪 Cas9 的功能。
【3】Nature:科学家成功利用新算法揭开癌症“黑匣子”并预测肿瘤的演变和临床进程
doi:10.1038/s41586-025-09374-4
据统计,全球每年有超过900万人死于癌症,其中白血病和淋巴瘤等血液系统恶性肿瘤占据了相当的比例,癌症的治疗一直面临着巨大的挑战,因为癌细胞在不断进化,其演变过程就像是一个神秘的“黑匣子”,难以捉摸。然而,一篇发表在国际杂志Nature上题为“Fluctuating DNA methylation tracks cancer evolution at clinical scale”的研究报告中,来自伦敦癌症研究所等机构的科学家们通过研究开发出了一种新方法有望打开这个“黑匣子”,有望成功预测癌症未来的临床进程。
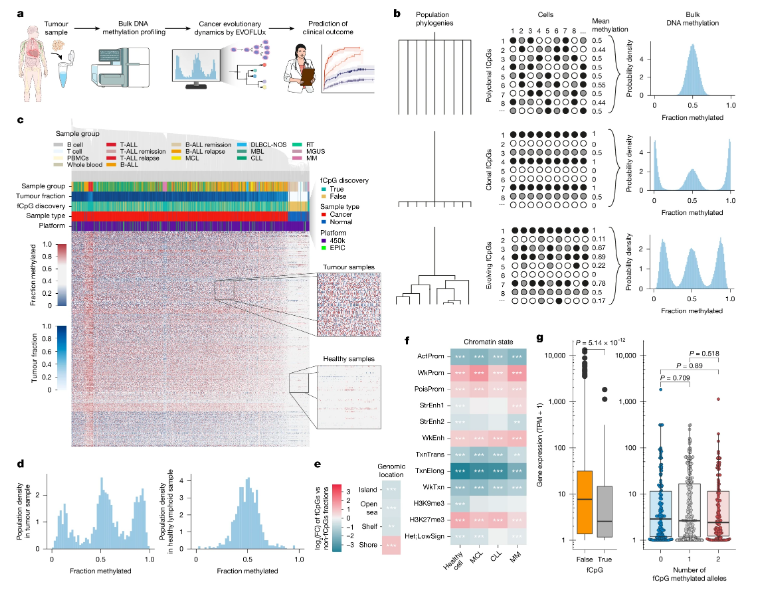
波动的CpG位点的选择与特征分析
文章中,研究人员开发了一种名为EVOFLUx的新方法,即基于DNA甲基化来解码癌症的起源和演变过程并预测其未来的临床进程;研究涵盖了2000名患有白血病和淋巴瘤的患者的肿瘤样本,这些样本覆盖了广泛的疾病类型。DNA甲基化是一种表观遗传修饰,从传统上来讲,其被认为可以像开关一样控制基因的表达,然而,这项研究揭示了DNA甲基化的另一种功能,即肿瘤起源细胞会在肿瘤细胞中留下独特的甲基化标记,这种标记不仅揭示了肿瘤细胞的身份,还会随着肿瘤的生长和多样化而发生变化。通过先进的数学建模,研究人员就能解码这些甲基化模式,并以前所未有的准确性重建肿瘤的起源和演变过程,同时预测疾病的未来进展。
EVOFLUx算法的应用让研究人员能从大量肿瘤样本的DNA甲基化数据中精确地测量癌症的进化动态。研究发现,不同疾病类型的初始肿瘤生长速度、恶性程度和表观突变率差异巨大;在临床上,研究人员观察到更具侵袭性的疾病亚型具有更快的初始肿瘤生长速度,并且在慢性淋巴细胞白血病的两个系列中,进化史是强大的独立预后因素。此外,EVOFLUx还能检测到偶尔出现的多个独立原发性肿瘤的案例,并且通过长期纳米孔测序等额外的遗传数据和临床变量,对EVOFLUx的推断进行正交验证,这些发现不仅为癌症生物学提供了新的见解,还为临床治疗提供了新的思路。
【4】Nature:罕见基因变异如何引发阿尔茨海默病?科学家发现关键机制及潜在疗法
doi:10.1038/s41586-025-09520-y
阿尔茨海默病(AD,Alzheimer's disease)是全球最常见的神经退行性疾病之一,给无数患者及其家庭带来了沉重的负担,WHO数据显示,全球约有5000万人患有阿尔茨海默病,预计到2050年,这一数字将翻倍。尽管科学家们对阿尔茨海默病的研究已经持续了数十年,但其确切病因仍然不完全清楚。
最近,一篇发表在国际杂志Nature上题为“ABCA7 variants impact phosphatidylcholine and mitochondria in neurons”的研究报告中,来自麻省理工学院等机构的科学家们通过研究揭示了罕见基因变异如何导致阿尔茨海默病,为治疗这一疾病带来了新的希望。
文章中,研究人员聚焦于一种名为ABCA7的基因,该基因的功能性变异在人群中极为罕见,但携带这些变异的人患阿尔茨海默病的风险却显著增加,ABCA7基因能编码一种脂质转运蛋白,负责将脂质运输穿过细胞膜。脂质代谢在细胞功能中起着关键作用,尤其是在细胞膜的形成和维持中,此前研究已经发现,另一种更常见的阿尔茨海默病风险因素—APOE4基因也主要会影响脂质的代谢。
通过单细胞RNA测序分析人类大脑样本,研究人员发现,与罕见ABCA7功能丧失变异相关的多种神经细胞类型中存在广泛的基因表达变化,表达ABCA7水平最高的兴奋性神经元显示出脂质代谢、线粒体功能、DNA修复和突触信号传导途径的破坏,这些基因表达的变化与神经元的过度兴奋和细胞应激状态有关,或许会导致DNA和其它细胞成分的损伤。
【5】Nature:揭示小细胞肺癌劫持神经元突触从而加速生长背后的分子机制
doi:10.1038/s41586-025-09434-9
肺癌是全球癌症相关死亡的头号杀手,其中小细胞肺癌(SCLC)是最具侵袭性的类型之一,SCLC以其快速增殖、早期转移、频繁早期复发和高死亡率而闻名;尽管近年来癌症治疗取得了显著进展,但SCLC的预后仍然极差,大多数患者在确诊后不到一年内死亡。
日前,一篇发表在国际杂志Nature上题为“Functional synapses between neurons and small cell lung cancer”的研究报告中,来自德国科隆大学等机构的科学家们通过研究发现,SCLC细胞能与神经元形成功能性突触,从而劫持身体的神经回路以加速生长,这一发现不仅为癌症生物学开辟了新的维度,还为开发新的治疗方法提供了希望。
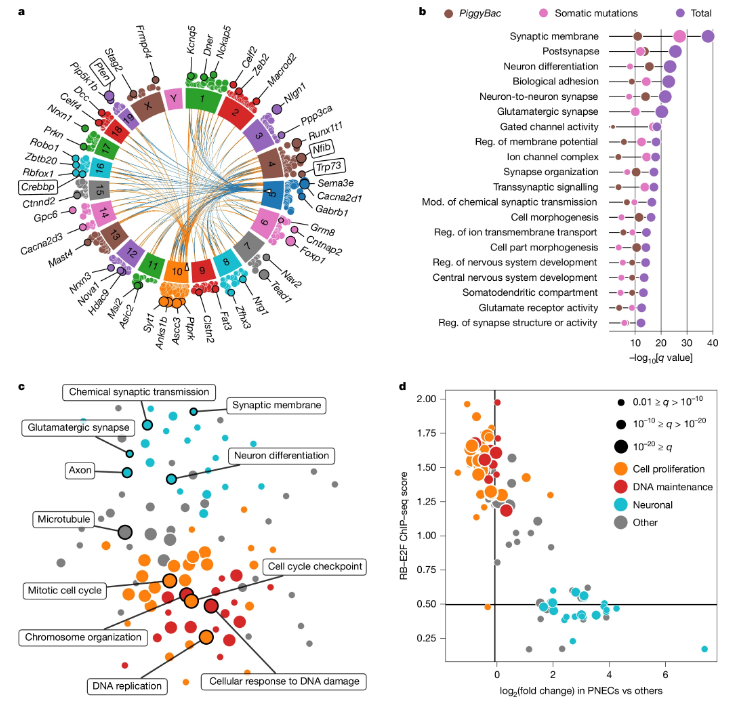
跨物种小细胞肺癌的全基因组分析
长期以来,科学家们一直认为突触(神经元之间的连接)主要存在于神经系统中,然而,近期的研究表明,诸如胶质瘤等某些癌症也能与神经元形成功能性突触,但这些研究主要集中在起源于神经系统的原发性脑肿瘤,对于SCLC这种非中枢神经系统的外周肿瘤是否也能形成类似结构,一直是一个未解之谜。
这项研究中,研究人员利用体内插入突变筛选技术结合跨物种的基因组和转录组验证,发现SCLC细胞能形成功能性突触并接收突触传递;他们在小鼠和人类SCLC中发现了与神经元、突触和谷氨酸能信号传导相关的基因集,进一步研究表明,SCLC细胞能在体外和体内与神经元形成功能性突触结构;而且电生理学和光遗传学实验确认,癌细胞能接收NMDA受体和GABAA受体介导的突触输入。
【6】突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望
doi:10.1038/s41586-025-09492-z
小细胞肺癌(SCLC)是肺癌中极具侵袭性的 “杀手”,它约占所有肺癌的 15%,每年在全球导致超过 20 万例死亡。作为一种高度恶性的神经内分泌肿瘤,SCLC 最可怕的特点就是极强的脑转移倾向——一旦癌细胞扩散到大脑,患者的生存期通常不足一年,治疗难度也随之陡增。近日,国际顶级期刊Nature发表了一篇题为 “Neuronal activity-dependent mechanisms of small cell lung cancer pathogenesis” 的重磅研究,来自斯坦福大学医学院、哈佛医学院等机构的科学家团队,揭露了一个颠覆认知的现象:转移到大脑的 SCLC 细胞,竟然能和大脑中的神经元形成 “电信号连接”(也就是真正的突触结构),而这种连接不仅真实存在,还会像 “给癌细胞充电” 一样,显著加速肿瘤生长。
其实近年来,“神经系统影响癌症” 的研究已经逐渐成为热点。在大脑内部,比如胶质瘤这类原发脑癌,神经元活动会通过两种方式促进肿瘤生长:一种是释放信号分子(旁分泌机制),另一种是通过神经与胶质瘤细胞之间的突触,实现电信号和化学信号的整合,让癌细胞 “融入” 神经回路。
而在大脑之外,像前列腺癌、头颈癌、乳腺癌、胰腺癌这些常见癌症,肿瘤周围的外周神经也会通过神经支配调节癌症进展。但一直以来,科学家们都不清楚——神经系统对 SCLC 的影响到底有多大?不管是癌细胞还在肺部时,还是转移到大脑后,神经活动是否在 “推波助澜”?
【7】脂肪里的“产热工厂”被发现!Nature:过氧化物酶体藏着减肥新密码,不用 UCP1 也能燃脂
doi:10.1038/s41586-025-09517-7
在奶茶、炸鸡当道的今天,“减肥” 早已成了全民热议的话题,但比 “瘦不下来” 更可怕的是肥胖背后的健康风险——WHO 数据显示,全球 20 亿超重成年人中,超 6 亿是肥胖症患者,他们患上糖尿病、心血管疾病甚至癌症的概率远高于普通人。一直以来,科学家们都在寻找脂肪细胞里的 “燃脂开关”,之前公认的关键是棕色脂肪中的 UCP1 蛋白,它能像 “小炉子” 一样燃烧能量产热。但奇怪的是,没有 UCP1 的小鼠也未必会胖,这说明还有别的 “燃脂通道” 没被发现。
近日,Nature杂志发表的一项重磅研究终于揭开了这个秘密!来自华盛顿大学医学院等机构的团队发现,脂肪细胞里的过氧化物酶体,就是个隐藏的 “产热工厂”。它能通过代谢一种叫 “单甲基支链脂肪酸(mmBCFA)” 的物质,开启不依赖 UCP1 的产热模式,悄悄燃烧脂肪。这篇题为 “Peroxisomal metabolism of branched fatty acids regulates energy homeostasis” 的研究,不仅刷新了我们对脂肪产热的认知,更给肥胖和糖尿病治疗指了条新路子。
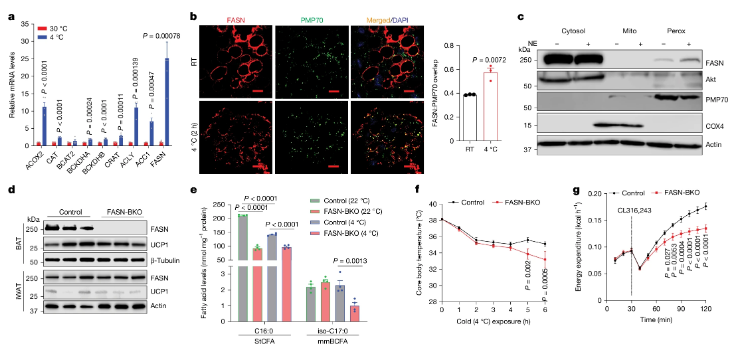
FASN能易位到过氧化物酶体上并驱动mmBCFA合成,同时还能调节棕色脂肪组织中的产热作用
过氧化物酶体这颗 “小颗粒”,之前就因参与脂肪酸代谢被熟知,但没人想到它能直接管 “燃脂产热”。研究团队把目光聚焦在过氧化物酶体里的 ACOX2 蛋白上——这是一种负责脂肪酸 β- 氧化的酶。他们先用基因工程技术搞出了多种小鼠模型:有的敲除了 ACOX2 基因(ACOX2-AKO),有的在脂肪里特意过量表达 ACOX2(ACOX2Adipo-OE),还有的干脆把 UCP1 基因也删了,想看看 ACOX2 和传统产热路径的关系。
【8】比心脏起搏器更智能!Nature & Nat Med:新植入设备破解脊髓损伤血压难题,手机 APP 即可掌控
doi:10.1038/s41586-025-09487-w doi:10.1038/s41591-025-03614-w
脊髓损伤(SCI)一直是医学研究领域中一个极具挑战性的研究课题,全球每年约有25万人遭受脊髓损伤,其中约30%的患者会出现严重的自主性反射性高血压,这是一种危及生命的状态,主要表现为血压突然升高,或会引发心脏病发作和中风;此外约80%的脊髓损伤患者会出现慢性低血压,这会严重影响其生活质量,并导致机体疲劳、认知功能下降、易晕厥,甚至长期增加心血管疾病的风险。然而,目前的治疗方法效果有限,许多患者仍需依赖保守治疗,比如药物和生活方式调整,但这些方法往往只能缓解部分症状,无法从根本上解决问题。
日前,发表在Nature和Nature Medicine杂志上的两篇研究报告中,来自加拿大卡尔加里大学等机构的科学家们联合开展的一项国际临床试验取得了重大突破,他们不仅揭示了脊髓损伤后血压失衡的神经机制,还开发了一种创新的植入式神经刺激系统,从而为患者带来了新的希望。这些研究的核心在于研究人员开发一种能精准调节血压的植入式神经刺激系统,该系统能通过在脊髓上植入新型电极阵列,从而连接到一个类似心脏起搏器的脉冲发生器,为患者提供定制化的电刺激,这种刺激能通过神经调节恢复血压稳定,且可通过手机应用程序控制,这就极大地提高了患者的自主性和生活质量。
文章中,研究人员揭示了脊髓损伤后导致自主性反射性高血压的神经结构,并发现通过脊髓电刺激就能与这一神经结构竞争从而安全精确地调节血压,随后研究人员进一步展示了这种神经调节疗法在治疗脊髓损伤后的低血压并发症方面的有效性,证明了该疗法在不同国家的多个医疗中心都能有效实施。
【9】Nature:癌症研究新突破!科学家揭秘小细胞肺癌的起源与演变
doi:10.1038/s41586-025-09503-z
在癌症研究领域,小细胞肺癌(SCLC,small cell lung cancer)一直是科学家们关注的焦点之一,作为一种极具侵袭性的神经内分泌肿瘤,这类癌症患者的5年生存率低于7%,这让无数患者和家属深感绝望。近年来,随着基因测序技术的飞速发展,科学家们逐渐揭开了小细胞肺癌的神秘面纱。有研究数据表明,小细胞肺癌患者中约63%存在PTEN基因的缺失,而转录因子POU2F3高表达的小细胞肺癌患者机体中PTEN缺失率更是高达63%,远高于POU2F3低表达患者,这些数据提示我们,小细胞肺癌的发病机制可能远比我们想象的更为复杂。
近日,一篇发表在国际杂志Nature上题为“Basal cell of origin resolves neuroendocrine–tuft lineage plasticity in cancer”的研究报告中,来自杜克大学等机构的科学家们通过研究不仅揭示了小细胞肺癌的起源,还为理解癌细胞的可塑性提供了新的研究视角。
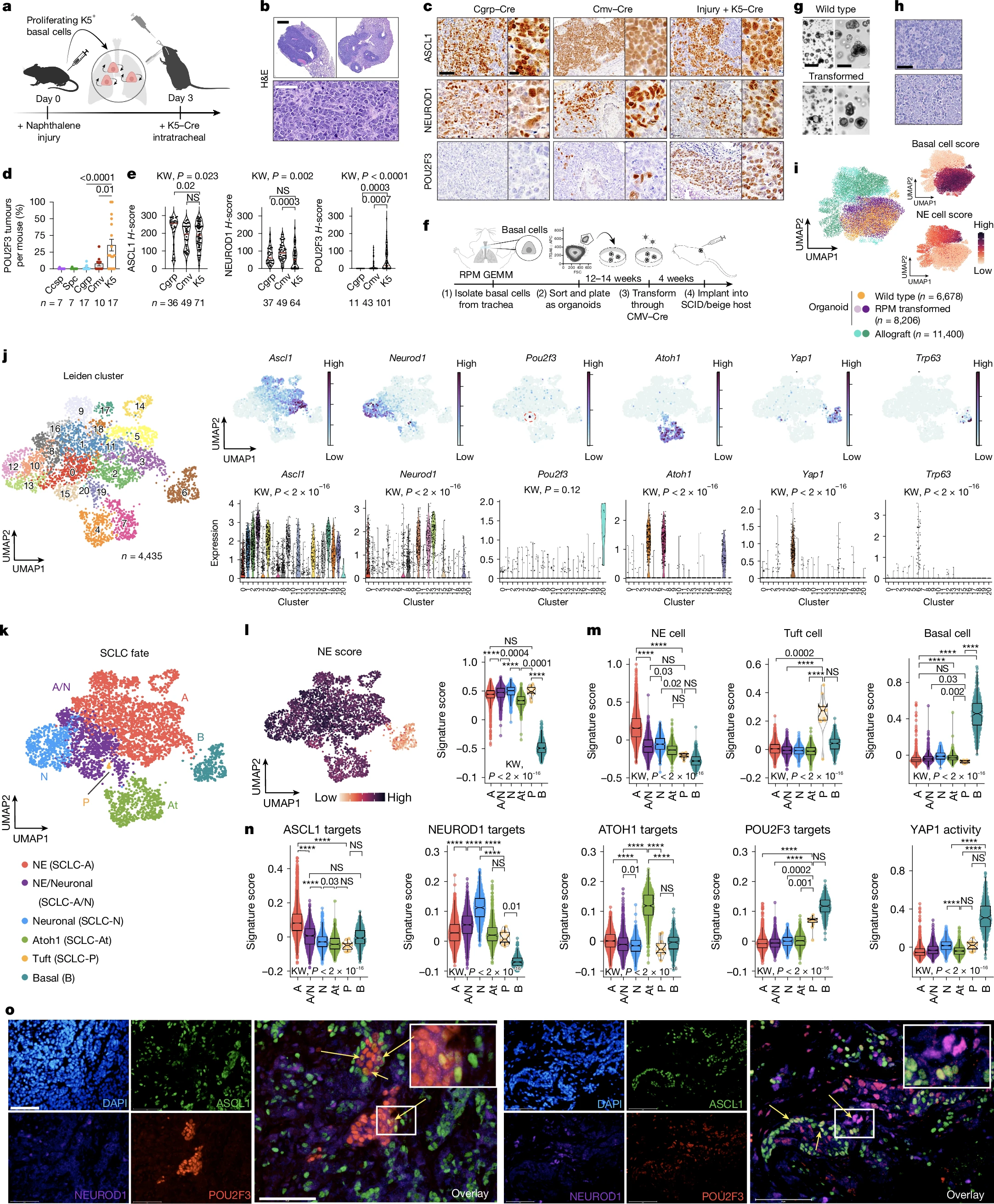
基底细胞允许小细胞肺癌亚型的多样性特性
研究者表示,小细胞肺癌的分子亚型包括SCLC-A(ASCL1+)、SCLC-N(NEUROD1+)和SCLC-P(POU2F3+),SCLC-P的预后最差,而且关于其起源和驱动基因,目前研究人员尚不清楚,这项研究中,研究人员旨在探索小细胞肺癌的细胞起源,特别是基底细胞在SCLC发生和发展中的作用,以及肿瘤细胞的可塑性如何影响SCLC的亚型转换和治疗反应。
【10】Nature:肺癌如何“遥控”骨髓免疫细胞并削弱机体防线?科学家发现关键“开关”
doi:10.1038/s41586-025-09493-y
肺癌每年在全球范围内夺走无数生命,同时其还是全球癌症相关死亡的主要原因,发病率和死亡率均居高不下;在肺癌的众多类型中,非小细胞肺癌(NSCLC)是最常见的,约占肺癌病例的85%。尽管近年来免疫疗法为癌症治疗带来了新的曙光,但在非小细胞肺癌等实体瘤中,免疫疗法的效果往往不尽如人意,这是因为肿瘤内部会聚集大量促肿瘤的巨噬细胞,这些细胞会抑制人体的抗癌反应从而让免疫疗法的威力大打折扣。
以往,科学家们一直以为这些巨噬细胞是在到达肿瘤后才开始“变坏”的。然而,发表在国际杂志Nature上题为“Myeloid Progenitor dysregulation fuels immunosuppressive macrophages in tumorsIcahn”上的一项最新研究彻底颠覆了这一认知,来自美国西奈山伊坎医学院等机构的科学家们通过研究发现,肺癌肿瘤会在免疫细胞到达之前就对骨髓中的免疫细胞进行“重新编程”从而削弱人体的免疫防线,这一发现为增强当前免疫疗法的持久性提供了新的靶点。
文章中,研究人员利用先进的单细胞基因组学工具对骨髓髓系祖细胞(巨噬细胞的前体)进行了详细的细胞图谱绘制;他们发现,肿瘤会向这些骨髓祖细胞发出信号并给它们一个“初次打击”从而使骨髓祖细胞偏向促癌功能;随后,当这些细胞进入肿瘤内部时,一个“二次打击”会进一步巩固其促癌功能。
研究者Samarth Hegde博士说道,这项工作改变了我们对癌症中免疫抑制时机的看法。我们发现,一些免疫细胞在到达肿瘤之前就已经在骨髓中被重新编程了,如果我们等到这些细胞进入肿瘤后再去靶向和重新编程,可能已经太晚了且也无法逆转这一过程,因此,我们需要在这些细胞还在发育时就进行干预并阻止其成为癌症的帮凶。(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


