多篇文章解读科学家们在人类黑色素瘤研究领域取得的新进展!
来源:生物谷原创 2023-07-27 14:55
黑色素瘤人类一种常见的皮肤恶性肿瘤,其发病率在不同国家和地区存在一定的差异,但总体呈现逐年增加的趋势。
黑色素瘤人类一种常见的皮肤恶性肿瘤,其发病率在不同国家和地区存在一定的差异,但总体呈现逐年增加的趋势;根据世界卫生组织的数据显示,全球黑色素瘤的年发病率约为每10万人中3-5例,且黑色素瘤是最常见的年轻人所患的癌症之一,在20岁至30岁年龄段的人群中发病率有逐年上升的趋势。目前我国人群黑色素瘤的发病率为0.9/10万,与西方国家(22/10万)相比相对较低,但死亡率却更高,危害性较大。
本文中,小编对近期科学家们在人类黑色素瘤研究领域取得的重要研究成果进行整理,分享给大家!
【1】Science:揭示突变蛋白诱发机体黑色素瘤的分子机制
doi:10.1126/science.abn7625
RNA监督途径能检测并讲解缺陷的转录本来确保RNA的保真度。近日,一篇发表在国际杂志Science上题为“Oncogenic CDK13 mutations impede nuclear RNA surveillance”的研究报告中,来自霍华德休斯医学研究所等机构的科学家们通过研究发现了一种影响黑色素瘤发生的新型机制,这一研究发现对于多种癌症患者的治疗具有非常广泛和重要的意义。
文章中,研究人员重点对名为CDK13的蛋白进行了研究,此前研究人员并不清楚其在癌症发生过程中的重要作用。研究者Insco表示,我们发现,在黑色素瘤中CDK13蛋白能扮演肿瘤抑制子的角色,且其突变或缺失会导致肿瘤的发生,通过分析黑色素瘤患者的数据以及Zon斑马鱼模型,研究人员阐明了诱发CDK13蛋白缺失或突变的原因,并揭示了其导致癌症发生的分子机制,其中包括背后的基因表达等。
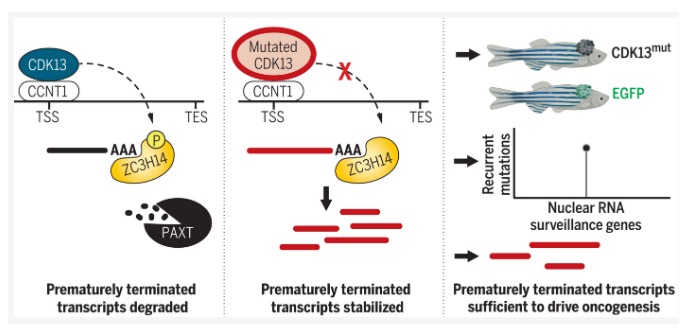
揭示突变蛋白诱发机体黑色素瘤的分子机制。
图片来源:Science (2023). DOI:10.1126/science.abn7625
细胞经常会犯基因表达的错误,研究者发现,细胞会产生缩短的RNAs,随后就会制造诱发癌症的异常蛋白,幸运的是,细胞拥有一种主动的清理机制来处理这些转录错误,但如果细胞无法清除这些垃圾的话,这些RNAs就会积累从而成为致癌物;文章中,研究人员指出,突变的CDK13或许就是那些异常RNAs不能被清理掉的原因。
在正常情况下,CDK13能在细胞中游走并实施对RNA的监督,如果其遇到了异常的RNA,其就会招募一系列蛋白质一起工作(蛋白质复合体)来降解细胞核中的短链RNA,从本质上来讲,其就会利用“吸尘器”清除错误并清除细胞中的癌变前物质。但如果发生突变的话,CDK13就不能发挥其RNA监督的职责了,并且会基本清除垃圾,我们都知道,这些垃圾RNA是癌症发生的原因,因为当将其置于斑马鱼体内时,其又会重新反映整个过程。
【2】Cell:揭示饮食和益生菌增强黑色素瘤免疫疗法反应的分子机制
doi:10.1016/j.cell.2023.03.011
如今,癌症患者对益生菌的使用正在不断增加,包括那些接受免疫检查点抑制剂(ICI)疗法的患者等。近日,一篇发表在国际杂志Cell上题为“Dietary tryptophan metabolite released by intratumoral Lactobacillus reuteri facilitates immune checkpoint inhibitor treatment”的研究报告中,来自匹兹堡大学等机构的科学家们通过对患有黑色素瘤的小鼠进行研究后发现,益生菌能从肠道中游走并在肿瘤中建立起来从而直接刺激免疫细胞,让癌症免疫疗法变得更加有效起来。
研究者表示,罗伊氏乳杆菌(Lactobacillus reuteri)能通过分泌名为吲哚-3-醛(I3A,indole-3-aldehyde)的化合物来刺激杀伤性T细胞发挥功能;当研究人员给予小鼠富含氨基酸色氨酸(细菌能将色氨酸转化为I3A)的饮食时,免疫疗法药物在抑制肿瘤尺寸和延长小鼠生存率上表现出更强的效果,相关研究结果或为研究人员进行临床试验来检测是否I3A疗法或将益生菌和饮食结合来改善接受免疫疗法的黑色素瘤患者的治疗结局奠定了一定的基础。
研究者Marlies Meisel说道,我们都知道,肠道微生物会影响免疫疗法的反应,但对于其是如何做到这一点的,以及是否其能从肠道中发挥作用或者其是否必须在肿瘤部位发挥作用,还有很多问题需要去解答。本文研究首次揭示了,口服细菌或许就能促使细菌移动到肠道外部的肿瘤中,并直接影响肿瘤中的免疫细胞从而增加癌症免疫疗法的疗效。肠道微生物组是免疫疗法(能帮助宿主机体免疫系统识别并杀灭癌细胞)为何对一些患者有效而对其它患者无效的一个重要因素,最近多项研究发现了黑色素瘤患者机体中益生菌补充剂和免疫疗法反应之间的关联。
【3】JID:科学家揭示黑色素瘤改变其环境从而促进转移背后的分子机制
doi:10.1016/j.jid.2023.02.030
黑色素瘤是一种最致命的皮肤肿瘤,其通常起源于上皮组织,在进展过程中,细胞能入侵到真皮层并通过淋巴系统和血液系统来发生转移,在黑色素瘤细胞侵入真皮层之前常常能观察到真皮淋巴管密度会增加,但其产生背后的分子机制,目前研究人员并不清楚。近日,一篇发表在国际杂志Journal of Investigative Dermatology上题为“Primary melanoma miRNAs trafficking induce lymphangiogenesis”的研究报告中,来自特拉维夫大学等机构的科学家们通过研究揭示了黑色素瘤是如何通过在在真皮层中形成新的淋巴管来深入皮肤组织从而在全身扩散,从而影响其周围的环境来支持其需求的,研究者认为,这一研究发现或能帮助科学家们开发抵御这种致死性癌症的新型疫苗策略。
黑色素瘤通常发生于表皮(皮层最顶层的组织)中黑色素细胞的失控分裂,在第二阶段,癌细胞能穿透真皮并通过淋巴系统和血液系统进行转移;此前研究中,研究人员在黑色素瘤周围的皮肤中观察到了淋巴管密度的急剧上升,这一机制直到现在才被科学家们所阐明。Greenberger教授解释道,我们主要的研究问题在于,黑色素瘤到底是如何影响淋巴管的形成的,然后再通过淋巴管进行转移;本文中,我们首次发现,在第一阶段,黑色素细胞能分泌名为黑色素小体(melanosomes)的胞外囊泡,那么这些囊泡是什么?以及其如何影响周围的环境呢?通过对人类黑色素瘤进行研究,研究人员发现,黑色素小体能穿透淋巴管。
【4】Nat Med:首个临床试验表明 粪便菌群移植有望改善晚期黑色素瘤患者对免疫疗法的反应
doi:10.1038/s41591-023-02453-x
近日,一篇发表在国际杂志Nature Medicine上题为“Fecal microbiota transplantation plus anti-PD-1 immunotherapy in advanced melanoma: a phase I trial”的研究报告中,来自加拿大劳森健康研究所(LHSC)等机构的科学家们通过进行一项世界上首项临床试验,结果发现,源自健康供者的粪便菌群移植(fecal microbiota transplant, FMT)是安全的,并有望改善晚期黑色素瘤患者对免疫疗法的反应。

图片来源:Nature Medicine, 2023, doi:10.1038/s41591-023-02453-x。
免疫治疗药物刺激个人的免疫系统来攻击和摧毁癌症。虽然它们可以显著改善黑色素瘤患者的生存结果,但它们只对40%至50%的患者有效。初步研究已表明人类肠道微生物组---我们肠道多样化的微生物集合---可能在患者是否有反应方面起作用。研究者John Lenehan博士表示,在这项新的研究中,我们旨在通过粪便移植来改善黑色素瘤患者对免疫疗法的反应。
粪便移植包括从健康供者那里收集粪便,在实验室中进行筛选和制备,并将它移植到患者身上。其目的是移植健康供者的肠道微生物组,以便健康的细菌在患者的肠道中茁壮生长。研究者指出,肠道微生物组、免疫系统和癌症治疗之间的联系是一个不断增长的科学领域。这项研究的目的是利用肠道微生物来改善黑色素瘤患者的治疗效果。
【5】Sci Transl Med:基因工程化的细胞疗法或有望靶向作用人类脑转移性的黑色素瘤
doi:10.1126/scitranslmed.ade8732
扩散到大脑中的黑色素瘤患者的总体生存期仅有4-6个月,近些年来,能利用机体免疫系统的强大力量来攻击癌细胞的免疫疗法因在治疗转移性黑色素瘤上的革命性突破而引起了科学家们极大的兴趣,但早期临床研究结果表明,大多数患者的预后仍然不佳;近日,一篇发表在国际杂志Science Translational Medicine上题为“Gene edited and engineered stem cell platform drives immunotherapy for brain metastatic melanomas”的研究报告中,来自哈佛医学院等机构的科学家们通过研究整合了多种治疗性方法来更加有效地靶向作用大脑中的黑色素瘤;在临床前研究中,科学家们在模仿人类环境的复杂小鼠模型中成功激活了机体的免疫反应。
研究者Khalid Shah博士表示,我们都知道,在发生脑转移的晚期癌症患者中,通过静脉注射和口服的系统性药物并不能有效靶向作用脑转移;如今我们开发了一种新型免疫疗法,其具有可持续性且能局部输注给肿瘤,我们认为,这种局部递送的免疫疗法或许代表了未来治疗黑色素瘤脑转移的方式或方法。
研究人员所设计的疗法使用了一种工程化的“双胞胎干细胞模型”,能以最大限度来攻击扩散到大脑中称之为软脑膜(leptomeninges)的大脑部分中的癌细胞;一个干细胞会释放出一种溶瘤病毒,而这种策略此前就能表现出减少肿瘤生长的潜力,利用干细胞来传递病毒就能放大所释放的病毒量,并确保这种病毒在释放到癌细胞中之前并不会被机体的循环抗体所降解。然而,溶瘤病毒也会破坏释放它的细胞,从而使其本身成为一种不可持续的治疗治疗选择,因此,研究人员利用CRISPR/Cas9基因编辑技术创造了第二种干细胞,其并不能被溶瘤病毒所靶向作用,而是会释放免疫调节剂来强化宿主机体的免疫系统,从而帮助抵御癌症。
【6】Science:科学家发现能促使黑色素瘤“长生不老”的关键遗传因素
doi:10.1126/science.abq0607
近日,一篇发表在国际杂志Science上题为“TPP1 promoter mutations cooperate with TERT promoter mutations to lengthen telomeres in melanoma”的研究报告中,来自匹兹堡大学等机构的科学家们通过研究揭示了黑色素瘤控制其死亡率之谜中缺少的一块拼图。文章中,研究人员描述了他们发现肿瘤如何遗传改变组合来促进其爆炸式地增长并预防其自身死亡,这一研究结果或许有望改变肿瘤学家理解和治疗黑色素瘤的方式。
研究者Alder教授说道,基于此前的研究结果,我们做了一件本质上很明显的事情,并将其与发生在患者身上的事情联系了起来。端粒是位于染色体末端的保护帽,其能防止DNA不断降解。在健康细胞中,端粒会随着每个复制周期的进行而不断变短,直到其变得非常短以至于细胞不能再继续分裂了,端粒长度维持的中断会导致严重疾病的发生,短端粒综合征会导致机体过早衰老和死亡,但超长端粒则与癌症发生直接相关。
多年以来,科学家们就在黑色素瘤中观察到惊人的长端粒,尤其是与其它类型的癌症相比;研究者指出,黑色素瘤和端粒的维持之间存在着某种特殊的关联,对于一个黑色素细胞而言,其要转变为癌细胞,最大的障碍之一就是让自己变得永生化,一旦其做到了这一点,其就能顺利走向癌变之路。端粒酶主要负责端粒的延伸,其能保护端粒免于损伤并能预防细胞死亡,端粒酶在大多数细胞中是无活性的,但多种癌症类型能利用端粒酶基因TERT的突变来激活这种蛋白从而促使细胞继续生长,黑色素瘤就以这种方式而特别出名。
【7】Nat Cancer:科学家成功利用L-海藻糖来诱发机体产生抑制黑色素瘤的强大免疫反应
doi:10.1038/s43018-022-00506-7
如今,免疫疗法已经能够改善很多癌症患者的治疗结局,包括黑色素瘤等,但这些疗法仅对一部分患者有效,众多研究都正在寻找如何改善患者机体的反应,包括重点关注如何增强肿瘤浸润性淋巴细胞(TILs,tumor-infiltrating lymphocytes)的功能,TILs是肿瘤中的特殊免疫细胞,其能识别并攻击癌细胞,但通常并没有足够的TILs,或者其并不足以利用强大的反应来持久性地抑制肿瘤的生长和扩散。
近日,一篇发表在国际杂志Nature Cancer上题为“Fucosylation of HLA-DRB1 regulates CD4+ T cell-mediated anti-melanoma immunity and enhances immunotherapy efficacy”的研究报告中,来自莫菲特癌症研究中等机构的科学家们通过研究识别出了一种能增加TILs数量和抗肿瘤活性的相对天然的方法,文章中,研究者表示,一种在红色和棕色海藻中水平较高的非毒性膳食植物糖类—L-海藻糖(L-fucose)或能增加TILs的水平并促进机体的抗肿瘤免疫力,还能改善免疫疗法的治疗效率。尽管L-海藻糖存在于很多食物中,但也能在机体中通过分解和转化其它分子来被细胞所合成,其对于机体的免疫和发育过程非常重要,L-海藻糖合成和使用的异常常常与包括癌症在内的多种疾病发生有关。

科学家成功利用L-海藻糖来诱发机体抑制黑色素瘤的强大免疫反应。
图片来源:Nature Cancer (2023). DOI:10.1038/s43018-022-00506-7
研究者Lau说道,黑色素瘤中L-海藻糖的总体水平会降低,而且在疾病进展过程中细胞利用L-海藻糖的方式也会发生改变,然而我们发现,通过膳食补充的方式来增加L-海藻糖的水平就会抑制肿瘤,并明显增加TILs的水平,同时还能增强动物模型机体中某些免疫疗法的疗效,在人类机体中,黑色素瘤中高水平的L-海藻糖或与较少的侵袭性疾病和患者对疗法更好的反应有关。研究人员想通过研究确定L-海藻糖增加TILs并诱发机体抗肿瘤活性背后的分子机制,近7年来,他们进行了一系列实验并首次发现,L-海藻糖能调节CD4+ T细胞(一类TIL)和黑色素瘤细胞之间的相互作用;在小鼠实验中,研究者发现,通过口服L-海藻糖就能增加肿瘤细胞中L-海藻糖的水平,减少肿瘤的生长并增加TILs的总体水平,在组成TILs的多种免疫细胞类型中,CD4+ T细胞在介导TILs水平的增加从而在L-海藻糖疗法期间抑制黑色素瘤方面扮演着关键角色,于是研究人员识别出了一种关键的分子机制,其能促进L-海藻糖介导的CD4+ T细胞抗肿瘤活性。
【8】Sci Transl Med:科学家识别出能帮助预测黑色素瘤患者对免疫疗法耐受的特殊生物标志物
doi:10.1126/scitranslmed.abq7019
肿瘤所固有的NOD-、LRR-和包含pyrin结构域蛋白-3(NLRP-3)炎性小体热激蛋白70(HSP70)信号轴能通过CD8+ T细胞细胞毒性所诱发,并通过将粒细胞多形核髓源性抑制细胞(PMN-MDSCs)招募到肿瘤微环境中,从而促进对抗程序性细胞死亡蛋白1(PD-1)免疫疗法适应性耐受性的发展。近日,一篇发表在国际杂志Science Translational Medicine上题为“Tumor-intrinsic NLRP3-HSP70-TLR4 Axis Drives Pre-Metastatic Niche Development and Hyperprogression During Anti-PD-1 Immunotherapy”的研究报告中,来自杜克大学癌症研究所等机构的科学家们通过研究识别出了一种潜在的生物标志物,其或能帮助预测检查点一制剂药物产生事与愿违效果的可能性,并能帮助驱动黑色素瘤细胞的超级进展,而并不是释放免疫系统来抵御癌细胞。
此前研究结果表明,在摄入检查点抑制剂时出现超级进展的癌症患者的平均总生存时间(median overall survival)为4.6个月,而没有并发症的患者的平均总生存时间则为7.6个月,这种现象如今在多种类型的肿瘤中已经被证明,其并不是仅仅是黑色素瘤,而是头颈癌、肺癌和乳腺癌等。这项在小鼠和人类组织中进行的最新研究针对的是一种能抑制超级进展的策略,其或许能潜在让10%的患者从检查点抑制剂免疫疗法中获益。
医学博士Brent Hanks说道,在对免疫疗法耐受性和超级进展状态的发生之间或许存在一种连续的关系,尽管超级进展会在接受检查点抑制剂疗法的一小部分癌症患者中发生,但识别出这种现象的可能性或许能潜在改变临床疗法并避免并发症的发生。检查点抑制剂是一种癌症得以成功治疗的案例,但超级进展在某些患者机体中却会诱发很麻烦的副作用,于是研究者Hanks等人就开始调查黑色素瘤中这一过程背后的分子机制,从而就识别出了一种特殊的蛋白复合体,其是一种称之为NLRP3炎性小体的复合体,植根于癌症肿瘤中。
【9】BBRC:科学家有望利用衰老的休眠细胞来帮助抵御人类黑色素瘤
doi:10.1016/j.bbrc.2022.07.086
早在10年前,小分子靶向性疗法的出现彻底改变了转移性黑色素瘤的疗法,但前提是肿瘤要携带对这些疗法能产生反应的突变,然而,尽管研究人员能在大多数患者机体中观察到这些显著的初始反应,即使在非常显著的初始反应之后,其中很多患者的病情都会复发,这些复发是由于休眠的顽固细胞所致,其对疗法并没有反应。
近日,一篇发表在国际杂志Biochemical and Biophysical Research Communications上题为“Inhibition of the DAPKs-L13a axis prevents a GAIT-like motif-mediated HuR insufficiency in melanoma cells”的研究报告中,来自日内瓦大学等机构的科学家们通过研究发现,这些细胞或许对于名为HuR的蛋白表达量不足,通过解析这种表达不足的机制以及利用酶类抑制剂进行靶向作用,研究人员就能成功降低所有黑色素瘤细胞对疗法的耐受性,相关研究结果或能帮助开发抵御转移性黑色素瘤和其它实体瘤的新型疗法。

科学家有望利用衰老的休眠细胞来帮助抵御人类黑色素瘤。
图片来源:Biochemical and Biophysical Research Communications (2022). DOI:10.1016/j.bbrc.2022.07.086
黑色素瘤是一种最危险的皮肤癌,其具有较强的侵袭性,且是从黑色素细胞发展而来,而黑色素细胞是机体中负责皮肤色素沉着的细胞;患者机体最初的肿瘤可能是浅表性的,手术切除后的预后较好,肿瘤也可能较深且具有转移性,并能迁移到机体其它器官中。在过去10年里,由于所谓的小分子靶向性疗法(即能抑制肿瘤内部的精准机制来抵御癌症)的出现,一半的转移性黑色素瘤都会携带让其对这些药物敏感的遗传性特征,因此这些黑色素瘤往往能得到有效治疗,有时甚至还能被根除。然而,尽管患者在开始治疗时会出现明显的疗效,但80%的患者都会经历黑色素瘤复发,而且这些复发往往会发生在最初受影响的相同部位。
【10】Nat Commun:一种潜在的黑色素瘤靶点或能绕过癌细胞对免疫检查点组织疗法的治疗耐受性
doi:10.1038/s41467-022-32754-7
在过去的10年里,免疫检查点阻滞疗法(ICBs)已经彻底改变了多种晚期癌症的治疗方法,其中就包括黑色素瘤,其是一种被认为无法治愈的最恶性的皮肤癌,然而四分之三的晚期黑色素瘤患者都会对免疫检查点阻滞疗法产生耐受性。近日,一篇发表在国际杂志Nature Communications上题为“Selective suppression of melanoma lacking IFN-γ pathway by JAK inhibition depends on T cells and host TNF signaling”的研究报告中,来自阿拉巴马大学等机构的科学家们通过研究揭示了一种潜在的靶点,或能利用临床批准的药物鲁索替尼(ruxolitinib)来抑制对ICB耐受的黑色素瘤。
医学博士Lewis Zhichang Shi,说道,由于药物鲁索替尼在临床上已经获批并在晚期实体瘤、非小细胞肺癌和三阴性乳腺癌患者中进行了相关测试,本文研究中我们就证明了该药物在治疗对ICBs耐受的晚期黑色素瘤中的反应;鲁索替尼或许需要与其它治疗方式相结合来实现黑色素瘤患者的长期治愈效应。半年以来,研究人员都知道,肿瘤失去干扰素γ信号是抵御两种ICB药物(抗CTLA-4和抗PD-1)产生耐受性的主要机制,然而,克服这种耐受性的方法让研究人员仍然难以捉摸。
人类黑色素瘤中干扰素γ信号的缺失或许是由干扰素γ信号通路中基因的功能失调所引起的,然而,在小鼠模型中,敲除突变或许并不能揭示肿瘤细胞中的干扰素γ信号的缺失如何调节肿瘤浸润性T细胞(TILs)的活性,因为这些模型仍然会含有一些干扰素γ信号;肿瘤浸润的免疫细胞对于癌症的控制非常重要,因为其能帮助检测并破坏肿瘤;然而,作为一种反击,癌症就会学习如何通过提高细胞表面的免疫检查点蛋白来躲避这种破坏,而这些表面蛋白则能向肿瘤浸润的T细胞发送“关闭”信号。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


