2020年6月CRISPR/Cas研究进展
来源:本站原创 2020-06-30 23:40
2020年6月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。 图片来自Thoma
2020年6月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的6月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science子刊:世界上首次!在体内利用碱基编辑器让隐性遗传性耳聋小鼠恢复部分听力
doi:10.1126/scitranslmed.aay9101
在美国,每8个12岁或以上的人中,就有1个双耳听力丧失。虽然助听器和人工耳蜗等技术可以放大声音,但是它们无法纠正这个问题。但是,鉴于遗传异常导致了一半的听力丧失病例,基因编辑或许可以做到这一点。两年前,Yeh和美国布罗德研究所成员David R. Liu教授首次在小鼠模型中修复一种显性突变并阻止听力丧失。但是,Liu说,“大多数遗传疾病不是由显性突变引起的,而是由隐性突变引起的,包括大多数遗传性听力丧失。”
如今,在一项新的研究中,Liu、Yeh和来自哈佛大学、布罗德研究所和霍华德休斯医学研究所的研究人员取得了另一个“第一”:他们恢复了因TMC1隐性突变而全聋的小鼠的部分听力,这是利用基因组编辑修复隐性致病突变的第一个成功例子。相关研究结果发表在2020年6月3日的Science Translational Medicine期刊上,论文标题为“In vivo base editing restores sensory transduction and transiently improves auditory function in a mouse model of recessive deafness”。
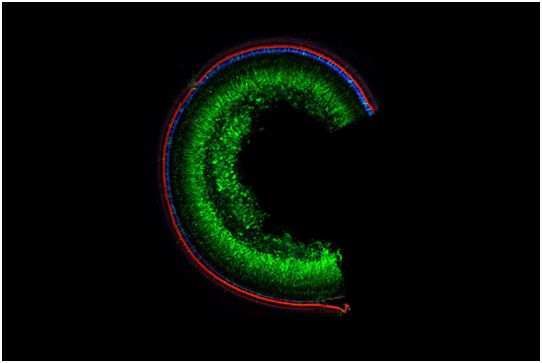
论文共同通讯作者、哈佛大学医学院耳鼻喉科和神经科教授Jeffrey Holt利用基因疗法成功治疗了TMC1相关的耳聋,具体而言就是他们将携带这个基因健康版本的细胞递送到不健康的细胞群体中,以抵消致病突变。但是Holt实验室博士后研究员Volha Shubina-Aleinik说,基因疗法的持续时间可能有限。“这就是为何我们需要诸如基因编辑之类的可能持续一生都有效的更先进技术。”
Yeh花了数年时间设计出一种碱基编辑器,它可以找到并消除致病突变,并用正确的DNA代码进行取代。但是即使她在体外展示了良好的效果,也存在一个问题:碱基编辑器太大,无法装入到传统的递送载体---腺相关病毒(AAV)中。为了解决这个问题,她所在的团队将碱基编辑器分成两半,每一半都用自己的病毒载体递送到身体中去。一旦位于体内,这两个病毒载体需要共同感染同一个细胞,在那里,这种碱基编辑器的两半会重新连接在一起,并前往寻找它们的靶标。尽管进入细胞比较复杂,但是事实证明这种碱基编辑器是有效的,仅造成最低限度的不必要的缺失或插入。
2.Cell Stem Cell:中科院揭示克服基因组印记障碍可以提高哺乳动物克隆效率
doi:10.1016/j.stem.2020.05.014
体细胞核移植(SCNT,又称克隆)技术在动物生产和再生医学方面具有很大的潜力。然而,克隆效率极低和克隆胚胎中经常观察到的异常情况限制了这种技术的发展和应用。虽然克隆胚胎容纳着完整的基因组DNA序列,但是多种表观遗传学障碍是制约克隆效率的因素。
在一项新的研究中,来自中国科学院遗传与发育生物学研究所和中国科学院动物研究所的研究人员通过实验证实修复H3K27me3介导的非经典印记(non-canonical imprinting)可以极大地提高克隆效率。相关研究结果于2020年6月18日在线发表在Cell Stem Cell期刊上,论文标题为“Overcoming Intrinsic H3K27me3 Imprinting Barriers Improves Post-implantation Development after Somatic Cell Nuclear Transfer”。
在这项新的研究中,这些研究人员揭示了H3K27me3依赖性印记基因在克隆胚胎的植入后胎盘中发生异常双等位基因表达,这与这些基因在受精卵的正常胚胎中发生单等位基因表达不同,这说明异常的H3K27me3印记可能是动物克隆的表观遗传障碍。
为了用实验证明这一点,这些研究人员利用单倍体胚胎干细胞技术产生了4个主要H3K27me3印记基因(Sfmbt2、Gab1、Smoc1和Jade1)发生单等位基因缺失的体细胞。他们先是利用CRISPR/Cas9介导的基因编辑技术在单倍体胚胎干细胞中进行单等位基因缺失实验。
然后将这些细胞作为人工精子,培育出4个主要H3K27me3印迹基因发生单等位基因缺失的小鼠。这些基因的单等位基因表达可以模拟这些基因的印记表达状态。
3.Nature:警惕!基因编辑胚胎导致大量DNA突变和重组!
doi:10.1038/d41586-020-01906-4
三项研究显示大量的DNA缺失和重组增加了对遗传基因组编辑的安全性担忧。
使用CRISPR-Cas9基因编辑工具修改人类胚胎的一系列实验,揭示了该过程如何在目标位点或附近对基因组造成不必要的巨大改变。
这些研究本月发表在预印本服务器bioRxiv上,还没有经过同行评审。但综合起来,它们让科学家们对一些人所说的CRISPR-Cas9编辑的风险有了一个很好的认识。先前的实验表明,该工具可以使"脱靶"基因突变远离靶点,但在最近的研究中确定的变化可能被标准的评估方法忽略。
伦敦弗朗西斯克里克研究所的发育生物学家Kathy Niakan和她的同事于6月5日在网上发布了第一篇预印本研究。在这项研究中,研究人员使用CRISPR-Cas9在POU5F1基因中制造突变,该基因对胚胎发育很重要。在18个基因组编辑的胚胎中,约22%的胚胎含有不需要的突变,这些突变会影响POU5F1周围DNA。它们包括DNA重排和数千个DNA字母的大量缺失--远远超出了研究人员使用这种方法的通常预期。
另一个由纽约哥伦比亚大学的干细胞生物学家Dieter Egli领导的研究小组,研究了由带有导致失明的EYS基因突变的精子形成的胚胎。研究小组使用CRISPR-Cas9试图纠正这种突变,但是大约一半的被测胚胎丢失了大量的染色体片段--有时甚至是整个染色体--EYS所在的位置。
由波特兰的俄勒冈健康与科学大学的生殖生物学家Shoukhrat Mitalipov领导的第三组研究人员研究了使用会导致心脏疾病的突变精子制成的胚胎。这个团队还发现了编辑会影响含有突变基因的染色体的大部分区域的迹象。
在所有的研究中,研究人员仅将胚胎用于科学目的,而不是用于怀孕。三份预印本的主要作者拒绝与《自然》新闻团队讨论他们工作的细节,直到这些文章在同行评审的期刊上发表。
4.Science:重大突破!科学家开发出一种超快速的CRISPR-Cas9基因编辑技术 能在几秒钟内实现精准基因编辑!
doi:10.1126/science.aay8204; doi:10.1126/science.abc3997
近日,一项刊登在国际杂志Science上的研究报告中,来自约翰霍普金斯大学等机构的科学家们通过研究利用光敏核苷酸开发了一种新方法来加速CRISPR-Cas9基因编辑的过程,文章中,研究者描述了整个实验过程及其这种新方法的精准性;在Science杂志同一期的一篇展望文章中,来自纪念斯隆凯特琳癌症中心的科学家们还概述了CRISPR-Cas9基因编辑技术的进化历程。

在CRISPR-Cas9基因编辑过程中,酶类Cas9能被用作剪刀在基因编辑的特定位点切割DNA链,同时导向RNA分子则会帮助Cas9酶类结合到预想链的DNA位点上,目前该过程的部分流程需要几个小时才能完成,这项研究中,研究人员能将整个过程缩短到几秒钟时间。
文章中,研究人员通过添加光敏核苷酸分子来改变部分导向RNA的序列,这就会阻断导向RNA在光被引入之前完成其工作,一旦研究者引入光,结合过程就会在几秒内发生,研究者将这种方法称之为“笼中法”(caged approach),因为导向RNA分子会被限制,直至其被指示去完成它的工作,研究者将这种方法称之为超快速CRISPR基因编辑手段(vfCRISPR)。
研究者指出,推迟编辑过程随后迅速对其激活,这或许就能为详细研究该过程提供一定的可能性,同时这种新方法还能提高基因编辑的精准性,并能允许一次编辑单个等位基因;同时,这种新方法还能帮助研究者开发出杂合突变,并以新的方法来研究复杂的特性,最后研究者Medhi表示,文章中我们描述了如何将CRISPR-Cas9工具从一种钝化的工具转变为一种精确的工具,vfCRISPR技术似乎是一项变革性的科学进步,因为其能帮助研究人员更好地理解基因编辑过程中参与双链断裂的细胞反应的动力学变化。
5.Cell重磅!华人科学家David R.Liu开发预测基因编辑结果的新方法!
doi:10.1016/j.cell.2020.05.037
虽然碱基编辑器被广泛用于实现定点突变,但决定碱基编辑结果的因素还没有被很好地理解,所以往往需要试验进行验证。近日来自Broad研究所、哈佛大学、麻省理工学院和布莱根妇女医院和哈佛医学院的研究人员在华人科学家David R.Liu的带领下,开发了一种机器学习模型以预测剪辑编辑的结果,无需实验就可以预测基因编辑的结果,相关研究成果发表在Cell上,该研究题为"Determinants of Base Editing Outcomes from Target Library Analysis and Machine Learning"。
在这项研究中,研究人员对11个胞嘧啶和嘌呤碱编辑(CBEs和ABEs)针对哺乳动物细胞中38538个基因的序列和活性关系进行了表征,然后利用这些结果去训练BE-Hive,BE-Hive是一个机器学习模型,可以准确地预测基础编辑基因型的结果(R≈0.9)和效率(R≈0.7)。
基于此,研究人员校正了3388个疾病相关的SNVs,其精度≥90%,其中包括675个BE-Hive正确预测的不被编辑的带有旁观者核苷酸的等位基因。
研究人员发现了之前无法预测的C-to-G或C-to-A编辑的决定因素,并利用这些发现纠正了174个致病转位SNVs的编码序列,精确度≥90%。(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的6月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science子刊:世界上首次!在体内利用碱基编辑器让隐性遗传性耳聋小鼠恢复部分听力
doi:10.1126/scitranslmed.aay9101
在美国,每8个12岁或以上的人中,就有1个双耳听力丧失。虽然助听器和人工耳蜗等技术可以放大声音,但是它们无法纠正这个问题。但是,鉴于遗传异常导致了一半的听力丧失病例,基因编辑或许可以做到这一点。两年前,Yeh和美国布罗德研究所成员David R. Liu教授首次在小鼠模型中修复一种显性突变并阻止听力丧失。但是,Liu说,“大多数遗传疾病不是由显性突变引起的,而是由隐性突变引起的,包括大多数遗传性听力丧失。”
如今,在一项新的研究中,Liu、Yeh和来自哈佛大学、布罗德研究所和霍华德休斯医学研究所的研究人员取得了另一个“第一”:他们恢复了因TMC1隐性突变而全聋的小鼠的部分听力,这是利用基因组编辑修复隐性致病突变的第一个成功例子。相关研究结果发表在2020年6月3日的Science Translational Medicine期刊上,论文标题为“In vivo base editing restores sensory transduction and transiently improves auditory function in a mouse model of recessive deafness”。

图片来自Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aay9101。
论文共同通讯作者、哈佛大学医学院耳鼻喉科和神经科教授Jeffrey Holt利用基因疗法成功治疗了TMC1相关的耳聋,具体而言就是他们将携带这个基因健康版本的细胞递送到不健康的细胞群体中,以抵消致病突变。但是Holt实验室博士后研究员Volha Shubina-Aleinik说,基因疗法的持续时间可能有限。“这就是为何我们需要诸如基因编辑之类的可能持续一生都有效的更先进技术。”
Yeh花了数年时间设计出一种碱基编辑器,它可以找到并消除致病突变,并用正确的DNA代码进行取代。但是即使她在体外展示了良好的效果,也存在一个问题:碱基编辑器太大,无法装入到传统的递送载体---腺相关病毒(AAV)中。为了解决这个问题,她所在的团队将碱基编辑器分成两半,每一半都用自己的病毒载体递送到身体中去。一旦位于体内,这两个病毒载体需要共同感染同一个细胞,在那里,这种碱基编辑器的两半会重新连接在一起,并前往寻找它们的靶标。尽管进入细胞比较复杂,但是事实证明这种碱基编辑器是有效的,仅造成最低限度的不必要的缺失或插入。
2.Cell Stem Cell:中科院揭示克服基因组印记障碍可以提高哺乳动物克隆效率
doi:10.1016/j.stem.2020.05.014
体细胞核移植(SCNT,又称克隆)技术在动物生产和再生医学方面具有很大的潜力。然而,克隆效率极低和克隆胚胎中经常观察到的异常情况限制了这种技术的发展和应用。虽然克隆胚胎容纳着完整的基因组DNA序列,但是多种表观遗传学障碍是制约克隆效率的因素。
在一项新的研究中,来自中国科学院遗传与发育生物学研究所和中国科学院动物研究所的研究人员通过实验证实修复H3K27me3介导的非经典印记(non-canonical imprinting)可以极大地提高克隆效率。相关研究结果于2020年6月18日在线发表在Cell Stem Cell期刊上,论文标题为“Overcoming Intrinsic H3K27me3 Imprinting Barriers Improves Post-implantation Development after Somatic Cell Nuclear Transfer”。
在这项新的研究中,这些研究人员揭示了H3K27me3依赖性印记基因在克隆胚胎的植入后胎盘中发生异常双等位基因表达,这与这些基因在受精卵的正常胚胎中发生单等位基因表达不同,这说明异常的H3K27me3印记可能是动物克隆的表观遗传障碍。
为了用实验证明这一点,这些研究人员利用单倍体胚胎干细胞技术产生了4个主要H3K27me3印记基因(Sfmbt2、Gab1、Smoc1和Jade1)发生单等位基因缺失的体细胞。他们先是利用CRISPR/Cas9介导的基因编辑技术在单倍体胚胎干细胞中进行单等位基因缺失实验。
然后将这些细胞作为人工精子,培育出4个主要H3K27me3印迹基因发生单等位基因缺失的小鼠。这些基因的单等位基因表达可以模拟这些基因的印记表达状态。
3.Nature:警惕!基因编辑胚胎导致大量DNA突变和重组!
doi:10.1038/d41586-020-01906-4
三项研究显示大量的DNA缺失和重组增加了对遗传基因组编辑的安全性担忧。
使用CRISPR-Cas9基因编辑工具修改人类胚胎的一系列实验,揭示了该过程如何在目标位点或附近对基因组造成不必要的巨大改变。
这些研究本月发表在预印本服务器bioRxiv上,还没有经过同行评审。但综合起来,它们让科学家们对一些人所说的CRISPR-Cas9编辑的风险有了一个很好的认识。先前的实验表明,该工具可以使"脱靶"基因突变远离靶点,但在最近的研究中确定的变化可能被标准的评估方法忽略。
伦敦弗朗西斯克里克研究所的发育生物学家Kathy Niakan和她的同事于6月5日在网上发布了第一篇预印本研究。在这项研究中,研究人员使用CRISPR-Cas9在POU5F1基因中制造突变,该基因对胚胎发育很重要。在18个基因组编辑的胚胎中,约22%的胚胎含有不需要的突变,这些突变会影响POU5F1周围DNA。它们包括DNA重排和数千个DNA字母的大量缺失--远远超出了研究人员使用这种方法的通常预期。
另一个由纽约哥伦比亚大学的干细胞生物学家Dieter Egli领导的研究小组,研究了由带有导致失明的EYS基因突变的精子形成的胚胎。研究小组使用CRISPR-Cas9试图纠正这种突变,但是大约一半的被测胚胎丢失了大量的染色体片段--有时甚至是整个染色体--EYS所在的位置。
由波特兰的俄勒冈健康与科学大学的生殖生物学家Shoukhrat Mitalipov领导的第三组研究人员研究了使用会导致心脏疾病的突变精子制成的胚胎。这个团队还发现了编辑会影响含有突变基因的染色体的大部分区域的迹象。
在所有的研究中,研究人员仅将胚胎用于科学目的,而不是用于怀孕。三份预印本的主要作者拒绝与《自然》新闻团队讨论他们工作的细节,直到这些文章在同行评审的期刊上发表。
4.Science:重大突破!科学家开发出一种超快速的CRISPR-Cas9基因编辑技术 能在几秒钟内实现精准基因编辑!
doi:10.1126/science.aay8204; doi:10.1126/science.abc3997
近日,一项刊登在国际杂志Science上的研究报告中,来自约翰霍普金斯大学等机构的科学家们通过研究利用光敏核苷酸开发了一种新方法来加速CRISPR-Cas9基因编辑的过程,文章中,研究者描述了整个实验过程及其这种新方法的精准性;在Science杂志同一期的一篇展望文章中,来自纪念斯隆凯特琳癌症中心的科学家们还概述了CRISPR-Cas9基因编辑技术的进化历程。

图片来源:Ella Marushchenko。
在CRISPR-Cas9基因编辑过程中,酶类Cas9能被用作剪刀在基因编辑的特定位点切割DNA链,同时导向RNA分子则会帮助Cas9酶类结合到预想链的DNA位点上,目前该过程的部分流程需要几个小时才能完成,这项研究中,研究人员能将整个过程缩短到几秒钟时间。
文章中,研究人员通过添加光敏核苷酸分子来改变部分导向RNA的序列,这就会阻断导向RNA在光被引入之前完成其工作,一旦研究者引入光,结合过程就会在几秒内发生,研究者将这种方法称之为“笼中法”(caged approach),因为导向RNA分子会被限制,直至其被指示去完成它的工作,研究者将这种方法称之为超快速CRISPR基因编辑手段(vfCRISPR)。
研究者指出,推迟编辑过程随后迅速对其激活,这或许就能为详细研究该过程提供一定的可能性,同时这种新方法还能提高基因编辑的精准性,并能允许一次编辑单个等位基因;同时,这种新方法还能帮助研究者开发出杂合突变,并以新的方法来研究复杂的特性,最后研究者Medhi表示,文章中我们描述了如何将CRISPR-Cas9工具从一种钝化的工具转变为一种精确的工具,vfCRISPR技术似乎是一项变革性的科学进步,因为其能帮助研究人员更好地理解基因编辑过程中参与双链断裂的细胞反应的动力学变化。
5.Cell重磅!华人科学家David R.Liu开发预测基因编辑结果的新方法!
doi:10.1016/j.cell.2020.05.037
虽然碱基编辑器被广泛用于实现定点突变,但决定碱基编辑结果的因素还没有被很好地理解,所以往往需要试验进行验证。近日来自Broad研究所、哈佛大学、麻省理工学院和布莱根妇女医院和哈佛医学院的研究人员在华人科学家David R.Liu的带领下,开发了一种机器学习模型以预测剪辑编辑的结果,无需实验就可以预测基因编辑的结果,相关研究成果发表在Cell上,该研究题为"Determinants of Base Editing Outcomes from Target Library Analysis and Machine Learning"。
在这项研究中,研究人员对11个胞嘧啶和嘌呤碱编辑(CBEs和ABEs)针对哺乳动物细胞中38538个基因的序列和活性关系进行了表征,然后利用这些结果去训练BE-Hive,BE-Hive是一个机器学习模型,可以准确地预测基础编辑基因型的结果(R≈0.9)和效率(R≈0.7)。
基于此,研究人员校正了3388个疾病相关的SNVs,其精度≥90%,其中包括675个BE-Hive正确预测的不被编辑的带有旁观者核苷酸的等位基因。
研究人员发现了之前无法预测的C-to-G或C-to-A编辑的决定因素,并利用这些发现纠正了174个致病转位SNVs的编码序列,精确度≥90%。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


