《科学》子刊:运动会诱导骨骼肌表达一种酶,能增强肌肉功能,预防甚至逆转胰岛素抵抗
来源:奇点糕 2022-01-01 20:34
现代社会中胰岛素抵抗和2型糖尿病等代谢疾病的流行,与人体力劳动和运动的普遍缺乏密切相关。然而,运动的缺乏在2型糖尿病病理生理中的作用,以及运动如何改善胰岛素抵抗,仍困惑着广大医学研究人员。前不久,国际顶级期刊《科学》子刊Science Advances公布了澳大利亚莫纳什大学Tony Tiganis教授在内分泌和运动医学领域的一项重磅研究成果。他们发现,运动
前不久,国际顶级期刊《科学》子刊Science Advances公布了澳大利亚莫纳什大学Tony Tiganis教授在内分泌和运动医学领域的一项重磅研究成果。
他们发现,运动通过诱导骨骼肌NOX4表达,促进ROS介导的适应性反应,进而增强肌肉功能,维持氧化还原平衡,逆转胰岛素抵抗。这一发现从氧化应激的角度详细揭示了运动维持血糖健康的机制,为衰老和肥胖相关的胰岛素抵抗提供了一个潜在的治疗靶点。
既往已有多项动物实验和人群试验证实运动能促进线粒体生成,增加胰岛素敏感性。有研究认为这与运动引起的ROS产生和KEAP1/NFE2L2通路激活有关。
ROS是细胞呼吸的自然副产物,包括H2O2、O2??和?OH等,是细胞的内源性氧化剂。运动期间ROS的产生主要由NOX家族催化,其中,NOX4位于骨骼肌细胞,能直接产生H2O2和O2??。运动后,ROS氧化KEAP1,导致与KEAP1结合的转录因子NFE2L2得以释放入核,促进线粒体相关基因和抗氧化防御系统基因的表达。然而迄今为止,详细机制尚未完全阐明。
于是,Tiganis团队以NFE2L2和NOX4为突破口,首先检测了二者在小鼠和人类骨骼肌运动前后的变化情况,发现运动后NFE2L2和NOX4表达上调。考虑到NFE2L2能与NOX4启动子区域结合,研究人员推断NOX4是NFE2L2的靶基因,运动通过上调NFE2L2而促进NOX4表达。
为了证明这一推测,Tiganis团队使用NFE2L2的激活剂——莱菔硫烷,代替运动刺激NFE2L2,进行细胞和动物实验,观察NOX4表达情况。他们发现:成肌细胞和小鼠经莱菔硫烷处理后,NOX4表达升高;而敲除NFE2L2后,莱菔硫烷的处理不能提高NOX4表达。这一结果验证了他们的猜想。
随后,Tiganis团队研究了骨骼肌NOX4缺失对ROS生成的影响,发现敲除成肌细胞的NOX4后,H2O2生成减少,运动状态下的H2O2激发生成也被消除。这证明ROS生成必需骨骼肌NOX4。此外,特异性敲除小鼠骨骼肌的NOX4后,在ROS生成减少的同时,运动能力和运动耐力也显着降低。
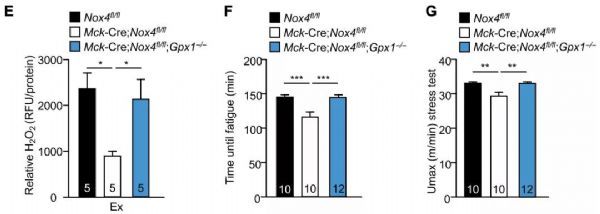
那么ROS生成减少和运动能力降低,这两者之间又是什么关系呢?考虑到氧化还原酶GPX-1能通过还原H2O2来消除ROS,于是,Tiganis团队沉默了NOX4敲除鼠的GPX-1基因,以抵消NOX4敲除引起的ROS减少。他们发现,敲除GPX-1后,NOX4敲除鼠的运动能力和耐力随H2O2水平恢复了正常。因此,骨骼肌NOX4敲除通过减少H2O2生成,而损害运动能力。
之前有研究表明,运动能力的强弱与骨骼肌线粒体含量的多寡有关。于是,Tiganis团队对比了GPX-1与NOX4双敲鼠、NOX4敲除鼠和正常鼠骨骼肌中相关基因的表达情况,发现线粒体生成基因(Pcg1a、Nrf1、Nrf2和Tfam)和线粒体呼吸链相关基因,在NOX4敲除后表达降低,在NOX4敲除的基础上再敲除GPX-1后则表达恢复。这个结果在NOX4敲除的成肌细胞中也得到了验证,证明骨骼肌NOX4敲除通过降低H2O2水平,来抑制线粒体生成,进而损害小鼠的运动能力。
实际上,已有研究发现NFE2L2参与运动诱导的线粒体生成,NFE2L2激活剂莱菔硫烷能增强小鼠运动能力。因此,Tiganis团队推测:NOX4敲除鼠线粒体生成减少引起的运动能力降低,可能和NFE2L2的缺失有关。
使用莱菔硫烷处理NOX4敲除鼠,发现NOX4敲除引起的NFE2L2表达降低得到纠正,并抑制了线粒体生成相关基因表达的减少。运动耐力检测发现,莱菔硫烷治疗挽救了NOX4敲除鼠运动耐力的下降。
这些发现证明骨骼肌NOX4敲除通过减少H2O2,而抑制NFE2L2,进而减弱线粒体生成,最终损害运动能力。
Tiganis团队注意到,骨骼肌收缩产生ROS,能增强NFE2L2介导的抗氧化防御。而且,前期实验已证明NOX4为肌肉收缩产生ROS所必须。因此,Tiganis和他的同事提出假说:NOX4与抗氧化防御有关,即NOX4的缺失能导致抗氧化防御的缺陷。
细胞和动物实验发现,NOX4敲除引起NFE2L2及NFE2L2靶基因表达的降低,并消除运动对NFE2L2表达的促进作用。无偏蛋白质组学和WB证实,抗氧化防御基因表达下降(线粒体SOD2、GCLM、PRDX6、NQO1、PRDX1至PRDX3和H2O2酶),脂质过氧化(4-HNE)、蛋白质氧化和损伤(蛋白质羰基化)和肌肉损伤(CK)等氧化损伤增加。
在NOX4敲除的基础上再敲除GPX-1以抑制H2O2的减少,能大幅度挽救抗氧化防御基因的表达下降,减轻骨骼肌氧化损伤。因此,骨骼肌NOX4敲除通过减少H2O2,来抑制NFE2L2,进而减弱抗氧化防御,增加氧化损伤。
鉴于衰老引起的胰岛素抵抗和2型糖尿病与氧化损伤有关。基于上述实验已发现的NOX4/H2O2/NFE2L2/抗氧化防御信号轴,Tiganis和他的同事进一步推测:衰老小鼠的胰岛素抵抗可能归因于NOX4表达的降低。
研究人员比较了衰老鼠和年轻鼠的NOX4表达情况,发现衰老鼠骨骼肌NOX4的表达下降了46%!随后研究人员还发现NOX4敲除鼠餐后血糖和胰岛素水平升高,胰岛素反应减弱,骨骼肌对葡萄糖摄取减少,出现胰岛素抵抗。对NOX4敲除鼠敲除GPX1以积累H2O2,或服用莱菔硫烷以激活NFE2L2,都能逆转NOX4敲除鼠出现的胰岛素抵抗。
肥胖也能通过加剧全身的氧化应激促进胰岛素抵抗。Tiganis团队发现,饮食诱导的肥胖小鼠骨骼肌NOX4表达减少44%!于是,他们大胆推测:NOX4缺乏能加剧饮食诱导肥胖引起的胰岛素抵抗。
Tiganis和他的同事评估了高脂饮食催肥后的NOX4敲除鼠的肌肉发育和葡萄糖稳态,发现体重、身体成分和肌肉组织形态无改变,但骨骼肌线粒体生成减少,胰岛素抵抗加剧,葡萄糖不耐受程度升高,骨骼肌葡萄糖摄取能力降低,胰岛素信号转导降低(AKT在Ser473的磷酸化水平下降),运动带来的胰岛素增敏效应也减弱。
既然线粒体SOD2缺失或线粒体内ROS增加,能降低胰岛素信号转导,促进胰岛素抵抗。那么,NOX4/H2O2/NFE2L2/抗氧化防御信号轴减弱引起的胰岛素抵抗是否与此有关呢?
Tiganis和他的同事先对NOX4敲除后的成肌细胞进行了检测,发现在H2O2生成减少和抗氧化防御基因表达降低的同时,线粒体SOD2蛋白表达降低,线粒体内O2??增加,蛋白质羰基化增加,胰岛素信号减弱。
而使用莱菔硫烷或敲除KEAP1激活NFE2L2后,蛋白质羰基化降低,胰岛素信号恢复。使用线粒体靶向抗氧化剂,SOD模拟物,或线粒体靶向四肽SS31阻断线粒体O2??生成,也能减少蛋白质羰基化,恢复缺陷的胰岛素信号。
这些结果表明,NOX4/H2O2/NFE2L2/抗氧化防御/线粒体氧化应激信号轴,在胰岛素抵抗的发展中发挥了重要作用。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->