揭秘Piezo蛋白介导机体触觉的分子机制
来源:本站原创 2019-08-28 13:29
2019年8月28日 讯 /生物谷BIOON/ --我们的身体能够感知多种机械刺激,我们的触觉能够有效区分微风吹过皮肤的感觉和疼痛的按压感,而其它系统则能够检测到肌肉的伸展,甚至血压;我们感知这些东西的能力需要一种外力,其能够在遍布机体不同组织的感觉神经元细胞的微小末梢转化为电信号,其中两个相关蛋白:Piezo1和Piezo2离子通道就能够通过允许正离子在细胞膜表面流动来响应在细胞膜上的力,从而介
2019年8月28日 讯 /生物谷BIOON/ --我们的身体能够感知多种机械刺激,我们的触觉能够有效区分微风吹过皮肤的感觉和疼痛的按压感,而其它系统则能够检测到肌肉的伸展,甚至血压;我们感知这些东西的能力需要一种外力,其能够在遍布机体不同组织的感觉神经元细胞的微小末梢转化为电信号,其中两个相关蛋白:Piezo1和Piezo2离子通道就能够通过允许正离子在细胞膜表面流动来响应在细胞膜上的力,从而介导动物机体中多种机械刺激过程。
这种机械性的电转导由感觉神经元中的Piezo2以及非神经元中的Piezo1所介导,其能对诸如剪切力和渗透力等驱动力作出反应,近日,一项刊登在国际杂志Nature上的研究报告中,研究者Wang等人报道了几乎完整的Piezo2的结构,同时研究者Lin等人在文章中描述了Piezo1中转导发生的机制。
Piezo离子通道由三个相同的Piezo蛋白所组成,每个蛋白都含有2500个氨基酸残基,解析如此庞大的结构并找到每个原子的位置时一项非常大的挑战,尽管如此,在过去几年里,研究人员已经在近原子的分辨率下描述了Piezo1的部分结构。
研究者Wang及其同事进一步研究了Piezo2的近原子分辨率结构,并解析了38个跨膜螺旋,这是单粒子低温电子显微镜(cryo-EM)“分辨率革命”的又一成就,cryo-EM能通过分析数千个单个蛋白的分子图像来获得分子结构,这些蛋白分子能被随机冻结在一层薄薄的非晶冰中,实践证明,cryo-EM能够解析大型膜蛋白(比如离子通道)的结构,而利用X射线晶体学技术无法直接或许这些膜蛋白的结构。
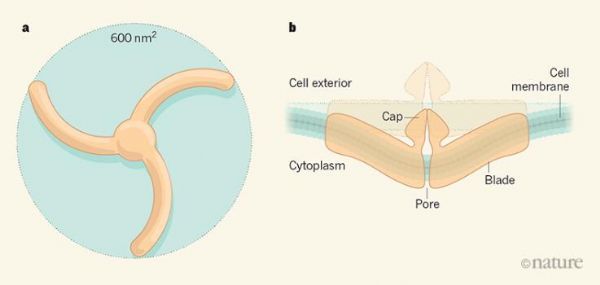
图片来源:Wang et al
目标蛋白的模型通常需要cryo-EM的分析作为模板,研究者Wang等人利用此前报道的Piezo1的结构作为Piezo2的模型,由此所产生的Piezo2的巨大结构或许就是多个实验室多年研究的结晶。这些研究结果表明,Piezo通道有四个关键特征,研究者给予这些特征进行了描述,即螺旋桨(propeller),帽(cap),孔(pore)和纳米碗(nano-bowl)(有时也称为圆顶);螺旋桨结构有三个叶片,每个叶片都由一个组成蛋白质组成,其围绕中心均匀分布,每个叶片的长度为200埃分辨率,而且每个叶片包含36个α螺旋,其拥有穿过脂质双层的正确长度,并能疏水性地嵌入其中。因此,螺旋串可能会在膜上来回“编织”,三个类似弹簧的刀片结构共同限定了约600平方纳米的膜区域,其能用于膜拉伸传感器的声音布置。
帽结构则位于孔外较大的细胞外结构域中,其类似于参与其它三聚体离子通道的门控相关的帽状结构,孔区域由6个α螺旋组成,其拥有允许正离子通过的内表面电荷,Piezo1和Piezo2的孔隙能在被解析的结构中夹紧,Piezo1中有一个收缩部位,而Piezo2中则有两个收缩部位。
那么,驱动力打开孔的转导机制时什么呢?膜蛋白能通过两种常规的方式来检测外力,其能够简单地感知脂质膜本身的伸展程度,或被其它蛋白拉伸或推动,两种类型的Piezo通道均具有弯曲的几何形状,就好像一个通向细胞外部的碗状结构一样,这种不寻常的形状就提示了一种简单的驱动力传导机制。如果蛋白质的曲线引发了膜的局部变形的话,那么横向拉伸就能使得膜和蛋白变平,如果蛋白质结构的扁平化能与开启通道的门控结构相关的话,那么就不需要辅助蛋白来进行转导了。
研究者Lin等人使用了两个方法来检测了这种说法,首先,他们对脂质囊泡中的Piezo1进行了研究,这非常重要,因为此前报道的Piezo结构是在洗涤剂的聚集体中获得的,而并非在脂质中,所以研究者并不清楚Piezos如何坐落到脂质双层中并与之相互作用,研究者指出,Piezo1确实会将囊泡折叠成为非球形结构,在第二项试验中,研究者使用原子力显微镜(AFM)探针对Piezo通道施加外力,结果发现,碗状结构在生物压力下发生了可逆的变平效应。
值得注意的是,AFM垂直于对膜所施加的力量,而并不是横向穿越膜,但实验结果仍然证实了碗状结构在适当外力下的弹性,然而,该实验并未解决是否生物性的刺激能够直接拉伸细胞膜或通过辅助的蛋白来发挥作用。同样研究者也并不清楚碗状结构的扁平化如何打开孔状结构,细胞外帽结构或许对于孔状结构的开启非常重要,正如研究者Wang所说的那样,消除大部分突变能够使得通道对膜的变形不再敏感,然而,当大部分蛋白被剔除时,或许就有许多方法能够解释蛋白功能的丧失了。
后期研究人员还需要深入研究来验证细胞膜拉伸或蛋白质相互作用在细胞中的传导机制,首先第一个任务就是解决在人工脂质膜中解析两个所分离的Piezo离子通道的原子结构,而不是在洗涤剂中,在理想状况下,通过在不同渗透下条件下利用冷冻的脂质囊泡就能够完成。根据膜的拉伸模型,渗透力会拉伸膜结构,同时在不同的门控状态下偏离Piezo通道,利用cryo-EM或测定通过孔的离子流就能够对这些状态进行检测,这就表明,Piezo实际上能够在没有其它蛋白的帮助下进行开启,在诸如此类实验中,这两个Piezo通道就会表现出不同的行为。
蛋白之间相互作用的模型能通过电子断层扫描进一步探索,这种方法能够有效区分和定位神经细胞中不同类型的膜蛋白,并识别出之间发生相互作用的细胞质蛋白质,这种实时观察力的传递也很重要,在活细胞中,离子通道的活性及其构象变化能够被实时测定,这或许将是一个强有力的实验,其能够检测蛋白质之间的相互作用是否会影响Piezo的信号传导,并调查通道的变平如何与孔结构中的门相互连接,当然了,每一项研究都面临着巨大的技术挑战,而这种高风险的研究也需要科学家们不断付出努力,因为机体的触觉对于我们寻找存在感、感知物体至关重要。(生物谷Bioon.com)
参考资料:
【1】Coste B, Xiao B, Santos JS, et al. Piezo proteins are pore-forming subunits of mechanically activated channels. Nature. 2012 Feb 19;483(7388):176-81. doi: 10.1038/nature10812.
【2】Murthy SE, Dubin AE, Patapoutian A. Piezos thrive under pressure: mechanically activated ion channels in health and disease. Nat Rev Mol Cell Biol. 2017 Dec;18(12):771-783. doi: 10.1038/nrm.2017.92. Epub 2017 Oct 4.
【3】Li Wang, Heng Zhou, Mingmin Zhang, et al. Structure and mechanogating of the mammalian tactile channel PIEZO2, Nature (2019) doi:10.1038/s41586-019-1505-8
【4】Yi-Chih Lin, Yusong R. Guo, Atsushi Miyagi, et al. Force-induced conformational changes in PIEZO1, Nature (2019) doi:10.1038/s41586-019-1499-2
【5】Ge J, Li W, Zhao Q, et al. Architecture of the mammalian mechanosensitive Piezo1 channel. Nature. 2015 Nov 5;527(7576):64-9. doi: 10.1038/nature15247. Epub 2015 Sep 21.
【6】Saotome K, Murthy SE, Kefauver JM, et al. Structure of the mechanically activated ion channel Piezo1. Nature. 2018 Feb 22;554(7693):481-486. doi: 10.1038/nature25453. Epub 2017 Dec 20.
【7】Qiancheng Zhao, Heng Zhou, Shaopeng Chi, et al. Structure and mechanogating mechanism of the Piezo1 channel, Nature volume 554, pages 487–492 (22 February 2018) doi:10.1038/nature25743
【8】Guo YR, MacKinnon R. Structure-based membrane dome mechanism for Piezo mechanosensitivity. Elife. 2017 Dec 12;6. pii: e33660. doi: 10.7554/eLife.33660.
【9】Cheng Y. Single-Particle Cryo-EM at Crystallographic Resolution. Cell. 2015 Apr 23;161(3):450-457. doi: 10.1016/j.cell.2015.03.049.
【10】Mansoor SE, Lü W, Oosterheert W, et al. X-ray structures define human P2X(3) receptor gating cycle and antagonist action. Nature. 2016 Oct 6;538(7623):66-71. doi: 10.1038/nature19367. Epub 2016 Sep 14.
【11】Chen X, Nelson CD, Li X, et al. PSD-95 is required to sustain the molecular organization of the postsynaptic density. J Neurosci. 2011 Apr 27;31(17):6329-38. doi: 10.1523/JNEUROSCI.5968-10.2011.
【12】Sasmal DK, Lu HP. Single-molecule patch-clamp FRET microscopy studies of NMDA receptor ion channel dynamics in living cells: revealing the multiple conformational states associated with a channel at its electrical off state. J Am Chem Soc. 2014 Sep 17;136(37):12998-3005. doi: 10.1021/ja506231j. Epub 2014 Sep 5.
【13】Edwin W. McCleskey. A mechanism for touch, Nature (2019) doi: 10.1038/d41586-019-02454-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。