西湖大学郭天南:COVID-19的多组学研究,照亮被忽视的角落
来源:西湖欧米 2022-03-20 20:47
COVID-19 仍在全球肆虐,且似乎不会从地球消失。近日,西湖大学郭天南团队在 Cell Reports Medicine 发表了题为:的评述,在这篇评述中,郭天南等人讨论了多组学技术在揭示 COVID-19 发病、进展和传播背后的分子机制中所起的作用,并讨论了标准化的缺失如何限制了它们在临床中的应用。截至 2022 年 2 月 12 日,200 多个国家
COVID-19 仍在全球肆虐,且似乎不会从地球消失。近日,西湖大学郭天南团队在 Cell Reports Medicine 发表了题为:的评述,在这篇评述中,郭天南等人讨论了多组学技术在揭示 COVID-19 发病、进展和传播背后的分子机制中所起的作用,并讨论了标准化的缺失如何限制了它们在临床中的应用。
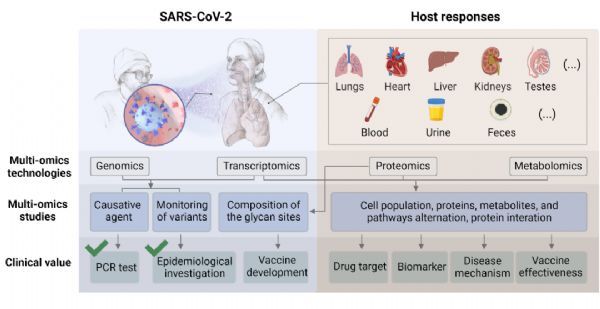
截至 2022 年 2 月 12 日,200 多个国家和地区报告了超过 4.05 亿例 COVID-19 确诊病例及580 万例死亡病例。虽然疫苗接种并没能阻止 SARS-CoV-2 的传播,但却降低了成人和儿童感染后发展成重症或死亡的风险。多组学技术研究揭示了病原体的分子特征与结构,以及宿主对病毒感染和疫苗接种后反应的潜在分子机制(本文中图 1 和图 2)。
病原体
多组学技术极大加深了我们对 SARS-CoV-2 以及宿主反应的理解,这些技术包括但不限于第二代测序、蛋白质组学和代谢组学(图 2)。事实上,新冠大流行病原体的确定还需要归功于基因组学。基于这个结果,人们开发了PCR试剂盒,并将之迅速应用于临床,取代了原始的体温检测法,有效提高了COVID-19诊断的准确性。
SARS-CoV-2的突变会导致其致病性、传染性、传播性或抗原性的变化。例如,研究发现 E484K 是一种免疫逃逸突变,可以减少抗体介导的中和作用。NGS 技术的迅速应用不仅有助于 Delta 和 Omicron 等突变毒株的发现,而且有助于跟踪调查它们在不同地区的传播情况。在津巴布韦对 SARS-CoV-2 变异毒株流行病学调查的一项研究中发现,60% 的病例是输入性的,这表明人口流动是其传播的关键因素,进一步支持了检疫和限制人口流动的重要性。基于质谱(MS)的对新冠病毒刺突(S)糖蛋白质的研究也有助于疫苗的研发。病毒的 S 蛋白会与宿主细胞中的 ACE2 蛋白产生相互作用,利用这一点,抗体通过靶向作用于 S 蛋白来中和病毒。因此,S蛋白的结构,包括其糖基化位点,对疫苗的设计十分关键。Watanabe 等人表达了重组刺突蛋白三聚体,并通过质谱确定了 22 个糖基化位点的糖基组成(例如,N234 和 N709 位点上糖基主要属于寡甘露糖型)。这个研究不仅深化了我们对 S 蛋白结构的了解,而且还为评估疫苗和治疗性抗体开发中的免疫原质量提供了基准。
宿主对病原体的反应
虽然多组学帮助我们在了解病原体的性质和结构上取得了一定的进展,但新冠病毒感染患者的症状,如哪些患者会发展成重症,仍然难以预测。如果有一种精确而实用的方法来根据疾病严重程度对患者进行分类,并确定那些能在 SARS-CoV-2 感染中幸存下来的大多数患者,那么许多对全球大流行的担忧就可以得到缓解。此外,不同人群对新出现的突变毒株的免疫反应是否存在差异?不同的疫苗和接种次数是如何影响人体对 SARS-CoV-2 的免疫力的?要解决这些问题及许多其他关键问题,我们需要全面了解宿主对这种病原体及其疫苗的反应。大多数多组学研究能够基于多种器官和临床标本,探究宿主对病原体的成千上万种分子变化,这是传统的方法难以实现的。
COVID-19 宿主反应研究最初仅限于观察如发烧和咳嗽等的临床症状,进一步延伸到观察胸部 CT 及如 CRP 和 SAA1 等的循环蛋白生物标志物指标的变化。这些标志物已用于其他传染病的观察,基于这些经验,它们也被用于监测 COVID-19 的临床进展。多组学研究监测了人体内大量由于感染新冠发生改变的分子,极大地拓展潜在的标志物种类,这些发现通常难以用传统的分析方法检测到(图2)。例如,基于COVID-19患者血清的蛋白质组学和代谢组学研究已有效地应用于测量约 2000 个血液中的分子,其中 93 种蛋白质和 204 种代谢物在重症患者中表现出显着的特异性失调。该研究还强调了血小板脱颗粒、巨噬细胞和补体系统的关键作用。大多数关键分子变化已在多个国家/地区的其他新冠多组学研究中得到证实,验证了蛋白质组学和代谢组学技术的可靠性以及他们在临床决策中的潜在价值。
值得一提的是,尿液作为一种非侵入性的临床生物标本,其中包含的蛋白质和小分子代谢物也可以很容易地被质谱检测到。研究人员在尿液中检测到了近 4000 种蛋白质,而由于血清中高丰度蛋白质的存在,使用相同的质谱方法仅能检测到约1500种蛋白质。值得注意的是,可在血清中检测到的蛋白有 80% 可在尿液中检测到,而在尿液中检测到的蛋白仅有 31% 可以在血清中检测到。
为什么我们需要检测这些分子呢?这些发现对抗疫有何帮助?多项组学研究表明,在经过合理设计的组学实验中,机器学习可以筛查用于分类和监测疾病进展的生物标志物。例如,基于血清中表达的 22 种蛋白质和 7 种代谢物的随机森林模型可以可靠地指示 COVID-19 的严重程度,并在一定程度上预测疾病预后。同样,基于尿液蛋白的模型也可用于监测 COVID-19 疾病进展。
除了血液中的循环分子外,其他器官中的分子变化对于揭示宿主反应也至关重要。病理切片检查在宏观和微观层面为诊断提供了丰富的信息,被广泛认可为疾病诊断的“金标准”。然而,在新冠患者的多器官病理切片中观察到的改变与非典型性肺炎(SARS)和中东呼吸综合征(MERS)患者中呈现的的组织病理学区别并不明显,而是高度相似。基于质谱的蛋白质组学现在能够在多器官尸检样品中表征超过 10,000 种蛋白质,并发现了参与凝血,血管生成,纤维化和脂肪酸代谢等过程的多种失调蛋白质。如果没有这样的高深度的蛋白质组学技术,而使用基于假设的研究方法来探索新冠感染后人体的变化,那么目前已知的几个重要发现,如肺部组织蛋白酶 L(Cathepsin L) 的上调与 COVID-19 死亡率之间存在潜在联系或INSL3 蛋白减少与睾丸中间质细胞受损之间的关联,将耗费无法估量的精力与时间。蛋白质组学使我们能够“看到”病理表现背后的分子变化。患者的组织标本,特别是肺组织,可能具有传染性,在分析之前必须进行灭活,这通常通过福尔马林固定来实现,而其通常会导致mRNA 降解,使得基于福尔马林固定的样本的转录组学分析存在挑战性。相比之下,蛋白可以被有效地从福尔马林固定的组织中提取,然后进行质谱分析。
组学技术还能够发现病毒的靶细胞,这是传统技术难以实现的。鼻咽拭子的单细胞 RNA 测序(Single-cell RNA sequencing, scRNA-seq)显示,在 COVID-19 感染期间,咽部的纤毛细胞 (ciliated cell) 减少,同时分泌细胞 (secretory cell)、次胞质体 (deuterosomal cell)扩增和巨噬细胞(macrophages)增加。没有其他技术可以替代单细胞 RNA 测序直接从临床标本中获得这样的结果。不仅如此,scRNA-seq 也可以用于解码同种细胞的多种亚细胞群。例如,淋巴细胞减少症(血液中循环淋巴细胞的显着减少)是 COVID-19 患者的常见症状。各种淋巴细胞在抗病毒免疫中发挥着不同的作用,基于这些淋巴细胞的 scRNA-seq研究发现了三种不同淋巴细胞亚细胞群响应模式与患者的预后有关。
对疫苗的反应
多组学研究还可能为疫苗的使用提供指导意见,尽管这些数据目前尚不充分。全球已接种超过 100 亿剂疫苗,包括 mRNA 疫苗、灭活病毒疫苗和基于腺病毒的疫苗等。虽然所有疫苗都对预防SARS-CoV-2 感染起到了一定的保护作用,但 mRNA 疫苗被证实比其他疫苗带来了更高的中和抗体滴度。然而,这种保护作用不仅通过中和抗体起作用,而且还由其他免疫效应机制介导,包括 T 细胞和先天免疫细胞。例如,在没有检测到中和抗体的情况下,即使只接种一剂,mRNA 疫苗对预防感染也达到了 80%的有效性。此外,高达 6% 的被接种人在第二次注射后血清中仍然检测不到中和抗体。
据美国疾控中心报道,截至 2022 年 2 月 12 日,超过0.004% 的被接种人出现了严重的副作用,包括过敏反应、血栓形成伴血小板减少综合征、吉兰-巴雷综合征甚至死亡。中和抗体的浓度随时间推移而下降,突破性感染时有发生,尤其是当面对新兴的免疫逃逸突变毒株如 Omicron时。迄今为止,针对特定突变毒株的定制疫苗尚未出现,尽管其在预防 COVID-19 方面具有不可否认的重要性。解决疫苗的保护性免疫不确定性的一项有争议但务实的政策是强制加强疫苗的接种。
疫苗接种的这些局限性,是目前多个国家数亿被接种人次所遇到的普遍问题。理论上,通过实时监测血清抗体含量变化可以为人群的流行病学追踪提供信息,更重要的是,可能为指导疫苗剂量和接种间隔提供有用的信息。然而,即使是中和抗体的检测也没有被广泛用于指导临床决策,这可能是因为大规模血液采样的可行性有限,并且缺乏通用的标准流程。监测尿蛋白的变化可能是评估对病毒免疫力的更实际的手段,但是,目前也还没有相关的数据公布。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->