研究揭示蛋白质泛素化与SUMO化修饰交互作用在减数分裂中的新机制
来源:动物所 2020-01-11 08:37
蛋白质翻译后修饰(Post-translational modification,PTM)是生物体生命活动的重要调控方式,蛋白质的泛素化(Ubiquitylation)与SUMO化修饰(small ubiquitin-related modifier;SUMOylation)是当前蛋白质翻译后修饰研究领域的热点。研究发现蛋白质的泛素化与SUMO化修饰之间存在
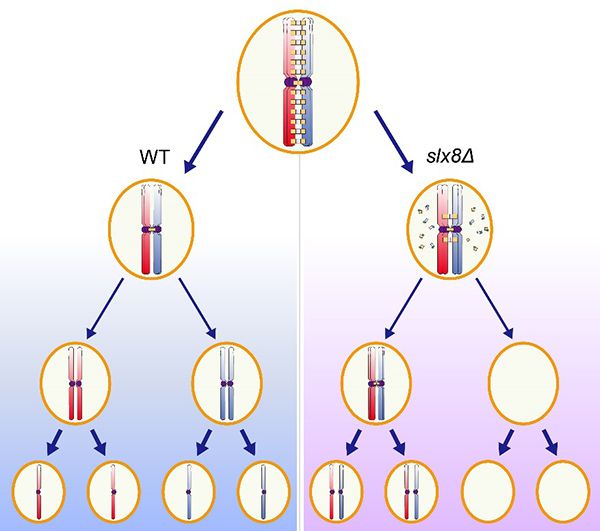
蛋白质翻译后修饰(Post-translational modification,PTM)是生物体生命活动的重要调控方式,蛋白质的泛素化(Ubiquitylation)与SUMO化修饰(small ubiquitin-related modifier;SUMOylation)是当前蛋白质翻译后修饰研究领域的热点。研究发现蛋白质的泛素化与SUMO化修饰之间存在交互作用(Ubiquitylation-SUMOylation Crosstalk),其中SUMO靶向泛素连接酶(SUMO-targeted ubiquitin ligases;STUbLs)是一种重要的泛素化-SUMO化交互调控因子。蛋白质泛素化与SUMO化修饰之间的交互作用极大的丰富了两种翻译后修饰功能的复杂程度,SUMO靶向泛素连接酶在基因调控、维持基因组稳定性、胚胎发育、癌症等多种生理过程中均发挥重要作用,然而蛋白质的泛素化与SUMO化修饰交互作用在减数分裂过程发挥何种功能,SUMO靶向泛素连接酶如何参与减数分裂调控目前还知之甚少。
为了研究蛋白质泛素化与SUMO化修饰交互作用在减数分裂中的作用机制,研究人员首先在酵母减数分裂过程中对SUMO靶向泛素连接酶进行功能筛选,发现复合物Slx5p-Slx8p任一蛋白的缺失均会影响减数分裂的正常进行。进一步研究发现敲除SLX8影响减数分裂同源染色体间联会复合体组分蛋白的降解,而未能有效降解的联会复合体蛋白影响同源染色体正确分离。Slx8p的泛素连接酶活性以及SUMO识别结构域对其在减数分裂的功能至关重要,预示Slx8p介导的蛋白质泛素化与SUMO化修饰交互作用在减数分裂同源染色体的正确分离过程中发挥重要作用。为了进一步验证该结论,研究人员在SLX8敲除菌株中表达融合的泛素-SUMO蛋白,将泛素化与SUMO化修饰人为联系起来,结果发现泛素-SUMO融合蛋白可以部分拯救SLX8敲除造成的减数分裂异常。为了进一步明确Slx5p-Slx8p在减数分裂过程中的关键作用底物,研究人员体外重构了Slx5p-Slx8p泛素化体系,发现Slx5p-Slx8p可以在SUMO化修饰的联会复合体蛋白Zip1p以及Ecm11p上直接催化泛素化修饰。在SLX8敲除菌株减数分裂过程中利用AID系统诱导Ecm11p蛋白的降解可以部分拯救其减数分裂异常。因此,SUMO靶向泛素连接酶Slx5p-Slx8p可以在SUMO化修饰的联会复合体蛋白Ecm11p上催化泛素化并介导其降解,进而调控同源染色体的正确分离。
以上工作首次阐明SUMO靶向泛素连接酶Slx5p-Slx8p在减数分裂过程中介导蛋白质泛素化与SUMO化修饰交互作用,促进SUMO化修饰的联会复合体蛋白的降解进而调控同源染色体的正确分离。为人们进一步理解蛋白质翻译后修饰的复杂调控提供了新思路。相关结果于2020年1月1日以题为“Slx5p-Slx8p promotes accurate chromosome segregation by mediating the degradation of synaptonemal complex components during meiosis”发表在Advanced Science (https://doi.org/10.1002/advs.201900739)。中国科学院动物研究所刘超、赵海超、肖赛为共同第一作者,动物所李卫研究员和北京医院老年医学研究所李国平副研究员为论文共同通讯作者。该项目得到了中国医学科学院创新工程、国家自然基金委以及中国科学院青年促进会的支持。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


