近期肝癌研究进展一览
来源:本站原创 2020-10-27 23:07
本期为大家带来的是肝癌相关领域的最新研究进展,希望读者朋友们能够喜欢。
2020年10月27日 讯 /生物谷BIOON/ --本期为大家带来的是肝癌相关领域的最新研究进展,希望读者朋友们能够喜欢。
1. JCRC:新研究揭示肝癌生物标志物
DOI: 10.1007/s00432-020-03378-5
由Skoltech的Olga Dontsova教授领导的一组科学家发现了一种新型的肝脏特异性非编码RNA。研究人员追踪了健康肝脏中受癌变影响的RNA,并建议使用特定RNA作为生物标记物,为各种肝癌的术后诊断提供新的指导。
该研究发表在《Journal of Cancer Research and Clinical Oncology》上。这项研究得到了俄罗斯科学基金会(RSF)的资助。
肿瘤标记物可帮助医生确定患者是否患有癌症。任何在疾病和健康个体中表现出不同浓度的物质都可以用作肿瘤标志物:包括非编码RNA。非编码RNA分为存在于所有人体细胞中的通用RNA和存在于某些器官和组织中的组织特异性RNA。
科学家在肝脏中发现了一个以前未描述的非编码RNA,可用作生物标记。他们之所以将其命名为新分子HELIS,是因为与经典的肿瘤标志物不同,该标志物可以作为一种健康的肝脏生物标志物,甚至可以被称为抗肿瘤标志物。
Skoltech生命科学中心(CLS)的研究科学家,论文的第一作者Olga Burenina认为,这可能是一个优势:“许多经典的肿瘤标志物并不总是在癌症的情况下出现,或者可能具有由于非癌性疾病(例如肝硬化或肝炎)引起的血红蛋白水平升高。”
参与联合研究的其他组织包括俄罗斯联邦卫生部Blokhin俄罗斯癌症研究中心的癌变研究所和彼得罗夫斯基国家外科研究中心,后者提供了6种肝肿瘤的术后样本。科学家成功地表明,所有样本中的HELIS水平均下降,远低于正常水平,而几种恶性肿瘤则完全消失。然后,科学家研究了这些样品中某些已知非编码RNA的行为,并选择了3种其他潜在的肿瘤标志物。结果,他们获得了由4种生物标志物组成的组,这些标志物在各种类型的肝癌差异表达,并且重要的是,有助于区分良性和恶性肿瘤。
“目前,还没有一个好的肝癌诊断标志物,因此医生主要根据超声或CT检查做出诊断,并通过手术切除整个肿瘤,而与怀疑的癌症类型无关。由于很少进行活检,根据10到14天后可获得的组织学结果进行最终诊断。” Olga Burenina解释说。
新的生物标记物组可用于基于术后肝肿瘤样品的快速初步诊断,以及用于临床病例的其他分析.
2. Cell:揭示失控的cAMP分子诱发肝癌的分子机制
doi:10.1016/j.cell.2020.07.043
自从人类第一次控制火以来,他们就开始在火周围扎营、传播信息,当有危险靠近时互相发出信号,同样地,细胞周围携带特殊信息的特定分子或许也能根据需要来帮助调节我们机体的功能,一种被称为环AMP(cAMP)的分子或许就在细胞内自由移动,并帮助管理机体的不同过程,而不可思议的是,其似乎会在正确的地方和正确的时间对环境的变化不断做出反应,那么cAMP到底是如何做到这一点的,目前科学家们并不清楚,日前来自加利福尼亚大学等机构的科学家们就对此进行了解释,相关研究结果刊登在了国际杂志Cell上。
研究者Susan Taylor教授说道,我们非常感兴趣研究cAMP对机体健康的影响,这项研究中,我们通过对荧光工具进行工程化修饰使其能将基因编辑技术CRISPR与生物传感器技术相结合;这种荧光探针就能帮助研究者以一种全新的方式来观察细胞内部,结果发现,失控的cAMP或许会导致一种罕见肝癌的发生,即纤维板层肝细胞癌(FLC,fibrolamellar carcinoma)。研究者解释道,cAMP和钙离子是人类细胞所需的两种重要的次级信号分子,其作用位点通常是由结合蛋白、激酶和支架蛋白精心调节的,从而就会形成信号分子群落。
研究者认为,细胞通常是由膜所包裹的细胞器组成,这些细胞器就好像是工厂里的房间一样发挥着特殊的功能,比如细胞的能量工厂—线粒体,研究者惊讶地发现,一种能结合cAMP的主要蛋白能通过一种类似于油滴在水中形成的过程来在细胞中形成无膜(没有壁)的细胞器。cAMP会被动态地隔离到这些无膜的细胞器中,当这些结构被破坏时,cAMP就会淹没细胞,从而导致细胞失控生长,进而诱发肿瘤;研究者表示,大部分FLC患者均携带有一种突变,在该突变中,重要的cAMP调节蛋白会被加入到一种不相关的蛋白质中,尽管研究人员知道这种杂交蛋白会导致FLC肿瘤的形成,但他们并不清楚其中的具体分子机理。
这项研究中,研究者发现,致癌的融合蛋白会干扰含有cAMP的无膜细胞器,从而促使cAMP淹没细胞,而失去形成这些含有cAMP的无膜细胞器能力的正常肝脏细胞则会表现出失控的细胞生长模式,这就是癌症发生的标志,本文研究还揭示了FLC发生背后的特殊机制,以及失控的cAMP如何导致癌症。研究者Jin Zhang表示,尽管只占到了细胞总体积1%的比例,但这些无膜细胞器却可以吸收99%的细胞组织,而且这些含有cAMP的无膜细胞器还能被FLC致癌融合蛋白完全干扰,从而就能帮助研究人员意外发现其致癌效应的机制。
由于cAMP对每个人类细胞都非常重要,其存在于大脑、心脏和胰腺细胞的无膜细胞器中,因此目前研究人员正在分析上述特殊细胞类型中这些动态结构的功能;最近研究人员开始关注生物系统中所形成的多种无膜细胞器,未来研究人员将会深入分析这些无膜细胞器中还存在什么东西,并深入理解到底是什么样的规则能促进特殊的分子进入并停留在这些无膜细胞器中,由于其与癌症发生直接相关,后期研究人员还将继续在分子层面上深入研究揭示失控的cAMP诱发癌症的分子机制。
3. J Hepatol:母亲肥胖会增加后代患肝癌的概率,且可以世代累积!
DOI: 10.1016/j.jhep.2020.03.050
科学家认识到母亲的肥胖和肥胖母亲的后代患肝癌之间的联系,但其机制尚不清楚。在一项发表在Journal of Hepatology杂志上的新研究中,研究人员在肥胖的母鼠体内发现了一种microRNA,它似乎可以传递肝癌易感性,增加子代和后代患肝癌的几率。
世界人口的三分之一超重或肥胖,这种全球肥胖流行病正威胁着人类健康。肥胖会增加患代谢性疾病的风险,如非酒精性脂肪肝病(NAFLD)和肝细胞癌(HCC)。在美国,最近诊断出的HCC中,有高达50%是由NAFLD等肝脏代谢紊乱引起的。
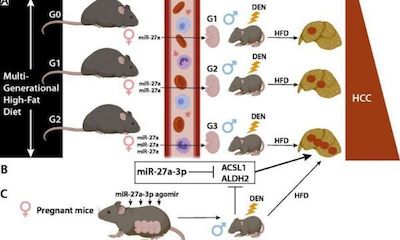
母亲肥胖直接影响到后代的健康,在肥胖症和代谢疾病中扮演着关键角色。流行病学研究表明,肥胖是肝癌的独立危险因素。这项新研究为母亲的肥胖是否以及如何影响后代的肿瘤发病率提供了见解。
研究人员用二乙基亚硝胺(DEN)诱导食用高脂肪食物的肥胖小鼠患上肝癌,随后进行了RNA测序,以确定基因和microRNAs的世代变化。他们发现,向怀孕小鼠注射microRNA miR-27a-3p不仅增加了肝脏的miR-27a-3p,降低了子代(胎儿期、幼龄期和成体期)中Acsl1和Aldh2两个基因的表达,而且还加剧了接受过DEN处理的子代HCC的发展。
高脂肪饮食引起的母亲肥胖会导致后代易患DEN诱发的HCC,研究人员证实这种易感性是世代累积的。此外,发生肝癌的几率在两代之间增加。例如,肥胖母亲和祖母所生孩子的严重程度要高于肥胖母亲但祖母体重正常的孩子。
研究人员还分析了人类HCC样本。研究人员表示,他们的发现提供了母体肥胖与后代疾病发展之间的机制联系,这将有助于探索对胎儿和发育性疾病的治疗和预防。对于孕妇来说,血清miR-27a-3p水平对后代的健康至关重要,未来可能被用作诊断或预测的生物标志物。因此,研究人员呼吁全球共同努力解决人类多代肥胖问题,以更好地解决我们面临的这个共同问题。
这项研究在新陈代谢和表观遗传学的十字路口为癌症研究开辟了一条新途径。它带来了关于母亲压力如何影响其后代,进而影响HCC发展的新信息。继承的模式并不是传统的代际传承模式。这是多代的,因为对HCC的易感性在几代之后逐渐增加。
4. Cell:科学家开发出一种新型的血液检测手段 或能有效改善对肝癌人群的筛查
DOI:10.1016/j.cell.2020.05.038
近日,一项刊登在国际杂志Cell上的研究报告中,来自美国国家癌症研究所等机构的科学家们通过研究开发出了一种新型检测手段,其能帮助识别更有可能患上肝细胞癌(HCC, hepatocellular carcinoma)的人群,肝细胞癌是一种最常见的肝癌类型,这种新方法能利用简单的血液检测手段来检查患者此前是否暴露于特定的病毒感染中。
研究者Xin Wei Wang说道,当与当前的筛选手段结合在一起时,这种新型检测手段在筛查HCC风险人群中扮演着非常重要的角色,其能帮助临床医生尽可能早地发现和并治疗HCC,这种新方法相对简单且便宜,仅需要患者少量的血液样本就能进行检测。特定的因素会增加个体患HCC的风险,比如乙肝或丙肝病毒感染、或肝硬化等,存在风险因素的人群常常会被推荐每隔6个月进行HCC的筛查,即利用超声检查或对血液中的α-甲胎蛋白进行检测。
并非每隔携带HCC风险因素的个体都会患病,尽管筛查能够帮助个体进行早期检测,但当癌症进展为晚期阶段或无法治愈的阶段时很多患者才被诊断出来,然而,早期发现的HCC患者往往有着更好的治愈机会。研究者表示,我们需要一种更好的方法来识别那些携带HCC最高风险的人群,以及应该频繁进行筛查的人群,更好的早期检测和监测手段尤为重要,因为目前HCC在美国的发病率不断上升。
研究者Tim Greten说道,目前我们的肝癌研究计划重点关注开发新方法来对HCC患者进行早期检测、诊断、治疗并改善患者的治疗结局,很多筛查检测手段能够检测癌细胞的多种特性,但这些特性会随着时间延续不断改变,肿瘤中并非所有的癌细胞都拥有相同的特征,因此研究人员就采用了一种不同的方法,即检测癌症微环境中的特性而并未癌细胞自身的特征。
深入研究后研究者发现,癌症的发生受到了病毒和免疫系统之间相互作用的影响,因此研究者就想知道是否病毒和宿主免疫系统之间的特性相互作用会增加机体患HCC的风险;为了剖析这一可能性,研究人员检测了参与者的血液样本来寻找过去病毒感染所留下的“足迹”,因为这些足迹会残留在抗体上,其能够反映机体免疫系统如何对感染产生反应,每个人机体足迹的混合物会创造一种特殊模式,研究者将其称之为病毒的暴露标记。
随后研究人员对约900人(包括150名HCC患者)血液样本中超过1000种不同的病毒足迹进行了检测,识别出了特殊的病毒暴露标记,其能准确区分HCC患者、慢性肝脏疾病患者和健康志愿者,这些特征中还包括了来自与61种不通过病毒的足迹信息;研究人员还对173名慢性肝脏疾病患者血液样本的标记进行了分析,在研究期间,有44名参与者患上了HCC,当患者癌症被诊断时,利用其血液样本进行分析,研究者就能从患HCC的个体机体中准确识别出特殊的标志,更重要的是,当研究者利用研究初期所采集的血液样本进行研究时,这些标记依然能被发现。
对这种标记的检测似乎要比对α-甲胎蛋白的检测要准确得多,下一步研究人员希望能够进入到临床试验阶段,他们将会与其他研究人员合作,在一项针对HCC风险因素的人群的前瞻性研究中检测这种新方法。研究者表示,病毒感染(并不会致癌)或会以一种影响机体患其它癌症的方式来改变宿主的免疫系统功能,比如,特定的感染会降低宿主免疫系统抑制癌症发生的能力,如今研究人员正在前列腺癌患者中检测这种特殊的病毒暴露标志,而其它研究人员则将这种方法应用于对亚洲人群多种癌症的筛查研究中,包括卵巢癌、食管癌、肝癌和乳腺癌等。
5. Hepatology:鉴别出治疗儿童肝癌的新型潜在基因靶点
近日,一项刊登在国际杂志Hepatology上的研究报告中,来自马萨诸塞大学医学院等机构的科学家们通过研究识别出了肝母细胞瘤(hepatoblastoma)的潜在新型治疗性靶点,肝母细胞瘤是一种罕见的儿童肝癌,目前并没有有效的治疗手段;文章中,研究人员分析了名为YAP1癌基因在肿瘤生存过程中扮演的关键角色。
研究者Jordan Smith表示,这项研究中,研究人员首次阐明了靶向YAP1的疗法在治疗儿童肝癌中的潜在效力,同时他们还指出,癌细胞的命运能被逆转,这或许就开启了一扇新型的治疗之门。每年在美国大约有100名儿童会被诊断为肝母细胞瘤,对于恶性疾病患儿而言,其生存率较低,仅为27%。对于这些患儿而言,研究人员束手无策,在60%-80%的患者中,直至肿瘤发展到无法用手术切除之前,肝癌几乎是没有任何症状的。

研究人员通常会采用化疗手段,但其容易对患儿产生严重的副作用,比如听力缺失或学习障碍等,而且患儿后期或许还需要进行心脏或肾脏移植。这项研究中,研究人员寻找了一种新方法来靶向作用关键基因,该基因能控制肝母细胞瘤中肿瘤的生存和生长,而且这种手段目前在成人癌症治疗中取得了成功;如果其能够在患儿机体中有效发挥作用的话,其或许就能减缓患儿对化疗手段的需求。
研究者通过对动物进行研究发现,关闭YAP1基因或能让90%以上的肿瘤萎缩,并能让患者的生存时间延长至230多天;关闭YAP1的表达不仅会促进肿瘤细胞死亡,还能促进肿瘤细胞亚群的分化,甚至能够挽救小鼠的肝脏损伤。下一步研究人员将会开发一种靶向作用肝脏的定制性疗法,并时刻追踪肝母细胞瘤细胞;最后研究者Smith表示,后期我们还会继续深入研究来开发更多治疗诸如肝母细胞瘤等儿童癌症的新型疗法。
6. Mol Ther:突破!研究开发肝癌治疗新方法
DOI: 10.1016/j.ymthe.2020.01.021
在最新一期的Molecular Therapy中,Skoltech和麻省理工学院的研究人员发表了一种治疗肝癌的新组合疗法。利用Zatsepin博士(Skoltech)擅长的siRNA方法,结合Anderson实验室(MIT)开发的脂质纳米颗粒技术,科学家们瞄准了与细胞凋亡(细胞死亡的调节程序)相关的蛋白质。与化疗联合使用,这种方法可以显着降低肝癌小鼠模型的肿瘤负荷。

肝癌是全球第四大常见癌症,自1980年以来发病率增加了两倍多。这种癌症的晚期具有很强的侵袭性,对所有传统的化疗都有耐药性。直到最近,多激酶抑制剂regorafenib和两种不同的检查点抑制剂才被批准用于索拉非尼治疗后进展的患者,但这仅仅增加了3个月的总生存期,突出了开发新的治疗方法的必要性。
"我们所做的只是关闭一种阻止细胞死亡的机制,特别是在肝细胞中,"Skoltech实验室的博士生、该研究第一作者Dominique Leboeuf解释道。"一旦这种机制被关闭,细胞就更容易死亡。这使得化疗更有效,杀死更多的癌细胞,防止癌细胞分裂。尽管我们的siRNA可以到达所有的肝细胞,但癌细胞更敏感,因为它们分裂得更快,所以它们会受到治疗的更大影响,而正常细胞可以存活。"
这些令人印象深刻的成果是Skoltech和麻省理工学院长期合作的成果,由Konstantin Piatkov教授、Timofei Zatsepin教授和Daniel Anderson教授领导。在NGP项目的资助下,研究在Skoltech和MIT进行,利用两个团队的优势,最大限度地为学生和研究人员提供学习经验。Timofei Zatsepin说:"这项研究是从K. Piatkov提出的一个清晰的想法开始的,当时我们刚开始在Skoltech建立外部联合实验室。这个项目结合了Konstantin在N-degron通路的知识,我在siRNA方面的专业知识以及Daniel Anderson在寡核苷酸药物递送方面的高超技术,开发了一种新的治疗肝癌的方法。首先,Dominique证实,所提出的分子机制允许选择性杀死肿瘤细胞,同时保留正常细胞,这对进一步的药物开发至关重要。我们与麻省理工学院的Daniel Anderson实验室合作,在动物模型上展示了这种组合疗法治疗肝癌的前景。我们相信siRNA与其他药物的结合将为许多难以治疗的疾病提供解决方案。"。
研究负责人Konstantin Piatkov 教授表示:"因为我们治疗的目标蛋白在所有类型的细胞中都有表达,所以这项研究中开发的组合治疗有可能应用于所有类型的癌症。我们的方法简单而普遍,我们相信它有可能在未来最终改善许多癌症患者的预后。"
7. J Hepatol: 好消息!新研究表明运动可以帮助预防肝癌!
DOI: 10.1016/j.jhep.2020.02.006
肝癌是全球第四大最常见的癌症死亡原因,并且由于"糖尿病大流行"而迅速增长。Journal of Hepatology上发表的一项新研究提供了强有力的证据,表明志愿的运动有助于预防最常见的肝癌--肝细胞癌,并确定了相关的分子信号通路。
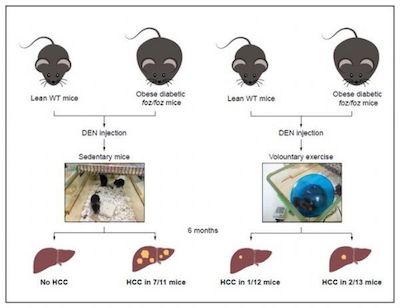
脂肪肝是肥胖和糖尿病的常见疾病,也是全球肝癌发病率迅速上升的原因之一。全世界每年有超过80万人被诊断出患有这种癌症。它也是导致癌症死亡的主要原因,全球每年有70多万人死于癌症。
"到目前为止,对肝癌的有效治疗方法很少(死亡率接近于发病率),因此非常需要预防肝癌的方法,"澳大利亚国立大学(ANU)医学院肝脏研究组首席研究员Geoffrey C. Farrell博士解释说。"一些人口数据表明,经常锻炼的人患肝癌的可能性较低,但针对这是否有真正的生物学基础的研究很少,如果有,识别产生这种保护作用的分子机制的研究也很少,而且这些研究结果还没有定论。"
研究人员研究了运动是否能减少肥胖/糖尿病小鼠肝癌的发生。基因驱使老鼠进食,从而导致肥胖和患上2型糖尿病,它们在年轻时被注射低剂量的致癌物。一半的老鼠被允许定期接触滚轮;另一半则没有,一直坐着不动。通过测量运动轮的转动,这些老鼠每天跑40公里。这种方法在三个月内减缓了体重的增加,但在六个月的实验结束时,即使是运动的老鼠也变胖了。六个月后,大多数久坐不动的老鼠患上了肝癌,而运动的老鼠则没有患上。
本研究表明,运动可以阻止与肥胖和2型糖尿病相关的脂肪肝小鼠肝癌的发展。具体来说,几乎所有注射了低剂量致癌物质的肥胖老鼠在六个月内都患上了肝癌,而经常锻炼的老鼠却没有。在这些实验的时间范围内,它们完全不受肝癌发展的影响。体重控制并不能减轻肝癌的发展。
研究人员还开展了详细的机制研究,部分阐明了运动如何预防肝癌。他们发现,自主运动的有益影响是通过分子信号途径发挥的,其中两种途径为抑癌基因p53和应激激活蛋白激酶JNK1。
研究人员首先证明了JNK1的激活是一个关键因素,可以通过运动来"关闭",并通过对缺乏JNK1的肥胖小鼠的单独研究证明了它的参与。他们还证明,被称为"细胞的守护者"和"致癌基因的警察"的p53的激活对细胞周期抑制剂p27的调节很重要,从而阻止注定会癌变的细胞的持续生长。
"锻炼已经被证明可以改善肝硬化患者的一些结果。如果目前在动物模型上的研究与患有脂肪肝的人类非常相似,并能在患者身上进行复制,那么运动即使不能完全预防肝癌,也有可能延缓肝癌的发病并减轻其严重程度,从而极大地改善患者的预后。此外,了解相关的分子途径为我们指出了一些方法,可以利用药物或药物营养素来发挥运动的强大保护作用,从而降低超重的糖尿病患者患肝癌的风险。"
8. Cell Rep:治疗恶性肝癌的新方法
在一项新的研究中,研究者们们发现了可能驱动罕见但致命的肝癌的最关键基因,为开发针对这些基因的药物提供了路线图。
这种名叫纤维细胞癌的肝癌占所有肝癌的1-5%,其主要影响儿童和青少年群体。由于被检测到时往往处于转移阶段,因此留给患者的生存时间往往很少。

在这项发表于《Cell Reports》杂志上的文章中,作者使用了康奈尔公司开发的技术--染色质运行测序(ChRO-Seq),该技术能够提供整个基因组的转录图谱。该技术由研究的共同作者、康奈尔大学贝克动物健康研究所助理教授查尔斯-丹科(Charles Danko)开发,使研究人员能够确定与健康的肝脏组织相比,纤维细胞癌的DNA中哪些区域可能被激活,与其他所有公开的类似数据的癌症类型相比,研究人员也能确定哪些区域的DNA可能被激活。总之,该研究提供了首个关于这一肿瘤的基因组活动如何重构的线索。通过了解这些内部运作,研究人员发现了一种可能有效的药物组合疗法。
DNA大多由不编码基因的区域组成,被称为 "非编码DNA",其中包括被称为增强子的DNA序列,它们作为可调节的开关,可以向上或向下调节附近的基因转录活性。研究人员利用ChRO-Seq技术鉴定了这些增强子的致密性、高活性簇,被称为超级增强子。
"最近已经证明,在超级增强子附近的基因对驱动这些细胞的行为特别关键,"Sethupathy说。该研究小组确定了大约15个与超级增强剂非常密切相关的基因,这些基因与纤维素瘤组织特异性的超级增强剂密切相关。
随后,作者发现这些特定的基因与MAPK信号通路有强烈的联系。据了解,MAPK信号通路在其他类型的癌症中也变得异常活跃,进而导致细胞增殖失控并癌化。
"目前,FDA已经批准了针对黑色素瘤等其他癌症的,针对MAPK通路的药物,"Sethupathy说。该团队开发了一种纤维细胞癌的细胞模型,使他们能够测试这些药物作为一种潜在的癌症治疗方法的表现。他们发现,这些药物确实能够破坏肿瘤细胞的存活能力。
进一步,作者发现癌细胞中有两个基因(SLC16A14和CA12)表达量异常活跃。当研究人员注射了SLC16A14的抑制剂后,大部分肿瘤细胞死亡。用CA12的抑制剂结合较低剂量的FDA批准的MAPK抑制剂进行治疗也显示出了非常好的效果。
该小组计划使用更多的小鼠模型来进一步测试该联合疗法,并更深入地研究SLC16A14的功能。这是下一步设计临床试验的最终目标。
9. NEJM实锤!5万人10年大数据发现低剂量阿司匹林可降低肝癌风险
DOI: 10.1056/NEJMoa1912035
高风险的慢性病毒性肝炎的成年人中,长期服用低剂量阿司匹林的人患肝癌或死于与肝相关疾病的可能性更小。这项研究结果发表在《The New England Journal of Medicine》上,由瑞典卡罗林斯卡学院和?rebro大学医院以及美国麻省总医院的研究人员领导的一个团队完成。

"在美国和欧洲国家,肝癌和肝病死亡率正以惊人的速度上升,"该研究的第一作者、麻省总医院胃肠病学和肝脏病学部门的研究员Tracey Simon说。"尽管如此,目前还没有确定的治疗方法来预防肝癌的发展,或降低与肝脏相关的死亡风险。"
基于登记的大型研究
为了进行分析,研究人员检查了来自瑞典50275名患有慢性病毒性肝炎的成年人的登记信息。慢性病毒性肝炎是一种由乙型或丙型肝炎病毒引起的肝脏感染,是肝癌最常见的危险因素。在10年的时间里,服用小剂量阿司匹林(每天少于163毫克)的病人中有4.0%患了肝癌,不服用阿司匹林的病人中有8.3%患了肝癌。服用阿司匹林的人患肝癌的相对风险降低了31%。
重要的是,研究表明,一个人服用低剂量阿司匹林的时间越长,益处越大。与短期使用(3个月至1年)相比,使用1-3年的人肝癌死亡风险降低了10%,使用3-5年的人肝癌死亡风险降低了34%,使用5年以上的人肝癌死亡风险降低了43%。此外,服用阿司匹林超过10年的患者中,有11.0%的人死于与肝脏相关的疾病,相比之下,未服用阿司匹林的患者中有17.9%的人死于与肝脏相关的疾病,这意味着服用阿司匹林的患者的相对风险降低了27%。
不会增加内出血的风险
无论性别、肝炎的严重程度或乙型或丙型肝炎病毒的类型如何,服用阿司匹林的人体内出血的风险(长期服用阿司匹林时的一个担忧)并没有显着升高。
"这是第一个大规模的全国性研究,证明阿司匹林的使用可以显着降低肝癌的长期风险和与肝脏相关的死亡率,"该研究的资深作者、卡罗林斯卡学院医学流行病学和生物统计学教授Jonas F. Ludvigsson说道。
研究人员指出,需要进行前瞻性随机对照试验,以测试阿司匹林对肝病患者的疗效。
10. Nat Commun:肝癌细胞的异质性有助于解释患者肿瘤的进展
DOI: https://doi.org/10.1038/s41467-019-14050-z
西奈山医院的研究人员报告说,许多肝癌肿瘤含有高度多样化的细胞群,这种现象被称为肿瘤内部的异质性,会显着影响肿瘤生长的速度。免疫系统对这种异质性的贡献可能具有重要的临床意义。
在《Nature Communications》上发表的一项新研究中,研究小组报道约30%的肝细胞癌(HCC)患者会出现这种异质性,HCC是最常见的肝癌,其中一些肿瘤通过劫持不同基因网络快速生长。
"肿瘤是一个复杂的生态系统,我们的研究结果首次表明他们可以通过与免疫系统的相互作用而进化,"西奈山Tisch癌症研究所肝癌项目助理教授、该研究的通讯作者Augusto Villanueva博士说道。"通过更好地了解肿瘤的发展过程,我们了解了更多关于它们如何适应药理学压力,以及它们如何形成对癌症治疗的抵抗机制。这种更大的意识将有希望导致我们识别生物标记,可以预测哪些患者对治疗有反应。"
研究小组的一项发现是,单个肝癌活检可能会对肝脏肿瘤产生错误的描述。
Villanueva博士说:"就基因构成和免疫细胞浸润而言,有些肿瘤非常相似,而有些则非常不同。这意味着来自同一肿瘤的活检会根据取材地点产生不同的信息,从而影响患者的临床决策。这就是为什么我们的工作旨在了解肿瘤是如何演变的,以及它们可以采取的不同轨迹,这对未来的癌症研究以及有效治疗癌症非常重要。"
随着免疫疗法继续改变癌症的研究和治疗,最有希望的领域之一是肝癌。就发病率和死亡率而言,肝癌已经成为美国增长最快的恶性肿瘤,每年有3.3万新病例。两项使用PD-1免疫检查点抑制剂的2期临床试验在人体中取得了前所未有的反应,促使美国食品和药物管理局(Food and Drug Administration,FDA)加快批准这些药物用于晚期肝细胞癌的二线治疗。PD-1免疫检查点抑制剂有助于人体免疫系统识别和攻击癌细胞。
最近,一项结合PD-1免疫检查点抑制剂和抗血管生成药物的三期临床试验,与目前的一线治疗标准索拉非尼相比,提高了生存率。尽管如此,只有大约30%的HCC患者被认为对免疫检查点抑制有良好的反应--这种结果在免疫治疗中并不罕见。
"免疫系统的进化对肝癌产生了重要的约束,通过调查免疫细胞和癌症细胞在分子水平上之间的相互作用,我们试图预测肿瘤耐药性的机制,"该研究的第一作者Bojan Losic博士解释说。"考虑到免疫检查点抑制剂在某些异质实体肿瘤中的显着成功,我们的工作尤其相关。"
为了了解驱动肿瘤恶化的机制,来自西奈山和其他世界各地的医疗中心的研究小组对来自多个区域相同的14个肝癌患者的肿瘤结节的基因表达分析,免疫活动,和DNA突变进行了综合分子分析。这项研究是第一次在同一肿瘤结节的多个区域使用单细胞RNA测序,也是第一次评估免疫系统对肝癌进化的贡献。(生物谷Bioon.com)
1. JCRC:新研究揭示肝癌生物标志物
DOI: 10.1007/s00432-020-03378-5
由Skoltech的Olga Dontsova教授领导的一组科学家发现了一种新型的肝脏特异性非编码RNA。研究人员追踪了健康肝脏中受癌变影响的RNA,并建议使用特定RNA作为生物标记物,为各种肝癌的术后诊断提供新的指导。

该研究发表在《Journal of Cancer Research and Clinical Oncology》上。这项研究得到了俄罗斯科学基金会(RSF)的资助。
肿瘤标记物可帮助医生确定患者是否患有癌症。任何在疾病和健康个体中表现出不同浓度的物质都可以用作肿瘤标志物:包括非编码RNA。非编码RNA分为存在于所有人体细胞中的通用RNA和存在于某些器官和组织中的组织特异性RNA。
科学家在肝脏中发现了一个以前未描述的非编码RNA,可用作生物标记。他们之所以将其命名为新分子HELIS,是因为与经典的肿瘤标志物不同,该标志物可以作为一种健康的肝脏生物标志物,甚至可以被称为抗肿瘤标志物。
Skoltech生命科学中心(CLS)的研究科学家,论文的第一作者Olga Burenina认为,这可能是一个优势:“许多经典的肿瘤标志物并不总是在癌症的情况下出现,或者可能具有由于非癌性疾病(例如肝硬化或肝炎)引起的血红蛋白水平升高。”
参与联合研究的其他组织包括俄罗斯联邦卫生部Blokhin俄罗斯癌症研究中心的癌变研究所和彼得罗夫斯基国家外科研究中心,后者提供了6种肝肿瘤的术后样本。科学家成功地表明,所有样本中的HELIS水平均下降,远低于正常水平,而几种恶性肿瘤则完全消失。然后,科学家研究了这些样品中某些已知非编码RNA的行为,并选择了3种其他潜在的肿瘤标志物。结果,他们获得了由4种生物标志物组成的组,这些标志物在各种类型的肝癌差异表达,并且重要的是,有助于区分良性和恶性肿瘤。
“目前,还没有一个好的肝癌诊断标志物,因此医生主要根据超声或CT检查做出诊断,并通过手术切除整个肿瘤,而与怀疑的癌症类型无关。由于很少进行活检,根据10到14天后可获得的组织学结果进行最终诊断。” Olga Burenina解释说。
新的生物标记物组可用于基于术后肝肿瘤样品的快速初步诊断,以及用于临床病例的其他分析.
2. Cell:揭示失控的cAMP分子诱发肝癌的分子机制
doi:10.1016/j.cell.2020.07.043
自从人类第一次控制火以来,他们就开始在火周围扎营、传播信息,当有危险靠近时互相发出信号,同样地,细胞周围携带特殊信息的特定分子或许也能根据需要来帮助调节我们机体的功能,一种被称为环AMP(cAMP)的分子或许就在细胞内自由移动,并帮助管理机体的不同过程,而不可思议的是,其似乎会在正确的地方和正确的时间对环境的变化不断做出反应,那么cAMP到底是如何做到这一点的,目前科学家们并不清楚,日前来自加利福尼亚大学等机构的科学家们就对此进行了解释,相关研究结果刊登在了国际杂志Cell上。

研究者Susan Taylor教授说道,我们非常感兴趣研究cAMP对机体健康的影响,这项研究中,我们通过对荧光工具进行工程化修饰使其能将基因编辑技术CRISPR与生物传感器技术相结合;这种荧光探针就能帮助研究者以一种全新的方式来观察细胞内部,结果发现,失控的cAMP或许会导致一种罕见肝癌的发生,即纤维板层肝细胞癌(FLC,fibrolamellar carcinoma)。研究者解释道,cAMP和钙离子是人类细胞所需的两种重要的次级信号分子,其作用位点通常是由结合蛋白、激酶和支架蛋白精心调节的,从而就会形成信号分子群落。
研究者认为,细胞通常是由膜所包裹的细胞器组成,这些细胞器就好像是工厂里的房间一样发挥着特殊的功能,比如细胞的能量工厂—线粒体,研究者惊讶地发现,一种能结合cAMP的主要蛋白能通过一种类似于油滴在水中形成的过程来在细胞中形成无膜(没有壁)的细胞器。cAMP会被动态地隔离到这些无膜的细胞器中,当这些结构被破坏时,cAMP就会淹没细胞,从而导致细胞失控生长,进而诱发肿瘤;研究者表示,大部分FLC患者均携带有一种突变,在该突变中,重要的cAMP调节蛋白会被加入到一种不相关的蛋白质中,尽管研究人员知道这种杂交蛋白会导致FLC肿瘤的形成,但他们并不清楚其中的具体分子机理。
这项研究中,研究者发现,致癌的融合蛋白会干扰含有cAMP的无膜细胞器,从而促使cAMP淹没细胞,而失去形成这些含有cAMP的无膜细胞器能力的正常肝脏细胞则会表现出失控的细胞生长模式,这就是癌症发生的标志,本文研究还揭示了FLC发生背后的特殊机制,以及失控的cAMP如何导致癌症。研究者Jin Zhang表示,尽管只占到了细胞总体积1%的比例,但这些无膜细胞器却可以吸收99%的细胞组织,而且这些含有cAMP的无膜细胞器还能被FLC致癌融合蛋白完全干扰,从而就能帮助研究人员意外发现其致癌效应的机制。
由于cAMP对每个人类细胞都非常重要,其存在于大脑、心脏和胰腺细胞的无膜细胞器中,因此目前研究人员正在分析上述特殊细胞类型中这些动态结构的功能;最近研究人员开始关注生物系统中所形成的多种无膜细胞器,未来研究人员将会深入分析这些无膜细胞器中还存在什么东西,并深入理解到底是什么样的规则能促进特殊的分子进入并停留在这些无膜细胞器中,由于其与癌症发生直接相关,后期研究人员还将继续在分子层面上深入研究揭示失控的cAMP诱发癌症的分子机制。
3. J Hepatol:母亲肥胖会增加后代患肝癌的概率,且可以世代累积!
DOI: 10.1016/j.jhep.2020.03.050
科学家认识到母亲的肥胖和肥胖母亲的后代患肝癌之间的联系,但其机制尚不清楚。在一项发表在Journal of Hepatology杂志上的新研究中,研究人员在肥胖的母鼠体内发现了一种microRNA,它似乎可以传递肝癌易感性,增加子代和后代患肝癌的几率。
世界人口的三分之一超重或肥胖,这种全球肥胖流行病正威胁着人类健康。肥胖会增加患代谢性疾病的风险,如非酒精性脂肪肝病(NAFLD)和肝细胞癌(HCC)。在美国,最近诊断出的HCC中,有高达50%是由NAFLD等肝脏代谢紊乱引起的。

母亲肥胖直接影响到后代的健康,在肥胖症和代谢疾病中扮演着关键角色。流行病学研究表明,肥胖是肝癌的独立危险因素。这项新研究为母亲的肥胖是否以及如何影响后代的肿瘤发病率提供了见解。
研究人员用二乙基亚硝胺(DEN)诱导食用高脂肪食物的肥胖小鼠患上肝癌,随后进行了RNA测序,以确定基因和microRNAs的世代变化。他们发现,向怀孕小鼠注射microRNA miR-27a-3p不仅增加了肝脏的miR-27a-3p,降低了子代(胎儿期、幼龄期和成体期)中Acsl1和Aldh2两个基因的表达,而且还加剧了接受过DEN处理的子代HCC的发展。
高脂肪饮食引起的母亲肥胖会导致后代易患DEN诱发的HCC,研究人员证实这种易感性是世代累积的。此外,发生肝癌的几率在两代之间增加。例如,肥胖母亲和祖母所生孩子的严重程度要高于肥胖母亲但祖母体重正常的孩子。
研究人员还分析了人类HCC样本。研究人员表示,他们的发现提供了母体肥胖与后代疾病发展之间的机制联系,这将有助于探索对胎儿和发育性疾病的治疗和预防。对于孕妇来说,血清miR-27a-3p水平对后代的健康至关重要,未来可能被用作诊断或预测的生物标志物。因此,研究人员呼吁全球共同努力解决人类多代肥胖问题,以更好地解决我们面临的这个共同问题。
这项研究在新陈代谢和表观遗传学的十字路口为癌症研究开辟了一条新途径。它带来了关于母亲压力如何影响其后代,进而影响HCC发展的新信息。继承的模式并不是传统的代际传承模式。这是多代的,因为对HCC的易感性在几代之后逐渐增加。
4. Cell:科学家开发出一种新型的血液检测手段 或能有效改善对肝癌人群的筛查
DOI:10.1016/j.cell.2020.05.038
近日,一项刊登在国际杂志Cell上的研究报告中,来自美国国家癌症研究所等机构的科学家们通过研究开发出了一种新型检测手段,其能帮助识别更有可能患上肝细胞癌(HCC, hepatocellular carcinoma)的人群,肝细胞癌是一种最常见的肝癌类型,这种新方法能利用简单的血液检测手段来检查患者此前是否暴露于特定的病毒感染中。

研究者Xin Wei Wang说道,当与当前的筛选手段结合在一起时,这种新型检测手段在筛查HCC风险人群中扮演着非常重要的角色,其能帮助临床医生尽可能早地发现和并治疗HCC,这种新方法相对简单且便宜,仅需要患者少量的血液样本就能进行检测。特定的因素会增加个体患HCC的风险,比如乙肝或丙肝病毒感染、或肝硬化等,存在风险因素的人群常常会被推荐每隔6个月进行HCC的筛查,即利用超声检查或对血液中的α-甲胎蛋白进行检测。
并非每隔携带HCC风险因素的个体都会患病,尽管筛查能够帮助个体进行早期检测,但当癌症进展为晚期阶段或无法治愈的阶段时很多患者才被诊断出来,然而,早期发现的HCC患者往往有着更好的治愈机会。研究者表示,我们需要一种更好的方法来识别那些携带HCC最高风险的人群,以及应该频繁进行筛查的人群,更好的早期检测和监测手段尤为重要,因为目前HCC在美国的发病率不断上升。
研究者Tim Greten说道,目前我们的肝癌研究计划重点关注开发新方法来对HCC患者进行早期检测、诊断、治疗并改善患者的治疗结局,很多筛查检测手段能够检测癌细胞的多种特性,但这些特性会随着时间延续不断改变,肿瘤中并非所有的癌细胞都拥有相同的特征,因此研究人员就采用了一种不同的方法,即检测癌症微环境中的特性而并未癌细胞自身的特征。
深入研究后研究者发现,癌症的发生受到了病毒和免疫系统之间相互作用的影响,因此研究者就想知道是否病毒和宿主免疫系统之间的特性相互作用会增加机体患HCC的风险;为了剖析这一可能性,研究人员检测了参与者的血液样本来寻找过去病毒感染所留下的“足迹”,因为这些足迹会残留在抗体上,其能够反映机体免疫系统如何对感染产生反应,每个人机体足迹的混合物会创造一种特殊模式,研究者将其称之为病毒的暴露标记。
随后研究人员对约900人(包括150名HCC患者)血液样本中超过1000种不同的病毒足迹进行了检测,识别出了特殊的病毒暴露标记,其能准确区分HCC患者、慢性肝脏疾病患者和健康志愿者,这些特征中还包括了来自与61种不通过病毒的足迹信息;研究人员还对173名慢性肝脏疾病患者血液样本的标记进行了分析,在研究期间,有44名参与者患上了HCC,当患者癌症被诊断时,利用其血液样本进行分析,研究者就能从患HCC的个体机体中准确识别出特殊的标志,更重要的是,当研究者利用研究初期所采集的血液样本进行研究时,这些标记依然能被发现。
对这种标记的检测似乎要比对α-甲胎蛋白的检测要准确得多,下一步研究人员希望能够进入到临床试验阶段,他们将会与其他研究人员合作,在一项针对HCC风险因素的人群的前瞻性研究中检测这种新方法。研究者表示,病毒感染(并不会致癌)或会以一种影响机体患其它癌症的方式来改变宿主的免疫系统功能,比如,特定的感染会降低宿主免疫系统抑制癌症发生的能力,如今研究人员正在前列腺癌患者中检测这种特殊的病毒暴露标志,而其它研究人员则将这种方法应用于对亚洲人群多种癌症的筛查研究中,包括卵巢癌、食管癌、肝癌和乳腺癌等。
5. Hepatology:鉴别出治疗儿童肝癌的新型潜在基因靶点
近日,一项刊登在国际杂志Hepatology上的研究报告中,来自马萨诸塞大学医学院等机构的科学家们通过研究识别出了肝母细胞瘤(hepatoblastoma)的潜在新型治疗性靶点,肝母细胞瘤是一种罕见的儿童肝癌,目前并没有有效的治疗手段;文章中,研究人员分析了名为YAP1癌基因在肿瘤生存过程中扮演的关键角色。
研究者Jordan Smith表示,这项研究中,研究人员首次阐明了靶向YAP1的疗法在治疗儿童肝癌中的潜在效力,同时他们还指出,癌细胞的命运能被逆转,这或许就开启了一扇新型的治疗之门。每年在美国大约有100名儿童会被诊断为肝母细胞瘤,对于恶性疾病患儿而言,其生存率较低,仅为27%。对于这些患儿而言,研究人员束手无策,在60%-80%的患者中,直至肿瘤发展到无法用手术切除之前,肝癌几乎是没有任何症状的。

研究人员通常会采用化疗手段,但其容易对患儿产生严重的副作用,比如听力缺失或学习障碍等,而且患儿后期或许还需要进行心脏或肾脏移植。这项研究中,研究人员寻找了一种新方法来靶向作用关键基因,该基因能控制肝母细胞瘤中肿瘤的生存和生长,而且这种手段目前在成人癌症治疗中取得了成功;如果其能够在患儿机体中有效发挥作用的话,其或许就能减缓患儿对化疗手段的需求。
研究者通过对动物进行研究发现,关闭YAP1基因或能让90%以上的肿瘤萎缩,并能让患者的生存时间延长至230多天;关闭YAP1的表达不仅会促进肿瘤细胞死亡,还能促进肿瘤细胞亚群的分化,甚至能够挽救小鼠的肝脏损伤。下一步研究人员将会开发一种靶向作用肝脏的定制性疗法,并时刻追踪肝母细胞瘤细胞;最后研究者Smith表示,后期我们还会继续深入研究来开发更多治疗诸如肝母细胞瘤等儿童癌症的新型疗法。
6. Mol Ther:突破!研究开发肝癌治疗新方法
DOI: 10.1016/j.ymthe.2020.01.021
在最新一期的Molecular Therapy中,Skoltech和麻省理工学院的研究人员发表了一种治疗肝癌的新组合疗法。利用Zatsepin博士(Skoltech)擅长的siRNA方法,结合Anderson实验室(MIT)开发的脂质纳米颗粒技术,科学家们瞄准了与细胞凋亡(细胞死亡的调节程序)相关的蛋白质。与化疗联合使用,这种方法可以显着降低肝癌小鼠模型的肿瘤负荷。

肝癌是全球第四大常见癌症,自1980年以来发病率增加了两倍多。这种癌症的晚期具有很强的侵袭性,对所有传统的化疗都有耐药性。直到最近,多激酶抑制剂regorafenib和两种不同的检查点抑制剂才被批准用于索拉非尼治疗后进展的患者,但这仅仅增加了3个月的总生存期,突出了开发新的治疗方法的必要性。
"我们所做的只是关闭一种阻止细胞死亡的机制,特别是在肝细胞中,"Skoltech实验室的博士生、该研究第一作者Dominique Leboeuf解释道。"一旦这种机制被关闭,细胞就更容易死亡。这使得化疗更有效,杀死更多的癌细胞,防止癌细胞分裂。尽管我们的siRNA可以到达所有的肝细胞,但癌细胞更敏感,因为它们分裂得更快,所以它们会受到治疗的更大影响,而正常细胞可以存活。"
这些令人印象深刻的成果是Skoltech和麻省理工学院长期合作的成果,由Konstantin Piatkov教授、Timofei Zatsepin教授和Daniel Anderson教授领导。在NGP项目的资助下,研究在Skoltech和MIT进行,利用两个团队的优势,最大限度地为学生和研究人员提供学习经验。Timofei Zatsepin说:"这项研究是从K. Piatkov提出的一个清晰的想法开始的,当时我们刚开始在Skoltech建立外部联合实验室。这个项目结合了Konstantin在N-degron通路的知识,我在siRNA方面的专业知识以及Daniel Anderson在寡核苷酸药物递送方面的高超技术,开发了一种新的治疗肝癌的方法。首先,Dominique证实,所提出的分子机制允许选择性杀死肿瘤细胞,同时保留正常细胞,这对进一步的药物开发至关重要。我们与麻省理工学院的Daniel Anderson实验室合作,在动物模型上展示了这种组合疗法治疗肝癌的前景。我们相信siRNA与其他药物的结合将为许多难以治疗的疾病提供解决方案。"。
研究负责人Konstantin Piatkov 教授表示:"因为我们治疗的目标蛋白在所有类型的细胞中都有表达,所以这项研究中开发的组合治疗有可能应用于所有类型的癌症。我们的方法简单而普遍,我们相信它有可能在未来最终改善许多癌症患者的预后。"
7. J Hepatol: 好消息!新研究表明运动可以帮助预防肝癌!
DOI: 10.1016/j.jhep.2020.02.006
肝癌是全球第四大最常见的癌症死亡原因,并且由于"糖尿病大流行"而迅速增长。Journal of Hepatology上发表的一项新研究提供了强有力的证据,表明志愿的运动有助于预防最常见的肝癌--肝细胞癌,并确定了相关的分子信号通路。

脂肪肝是肥胖和糖尿病的常见疾病,也是全球肝癌发病率迅速上升的原因之一。全世界每年有超过80万人被诊断出患有这种癌症。它也是导致癌症死亡的主要原因,全球每年有70多万人死于癌症。
"到目前为止,对肝癌的有效治疗方法很少(死亡率接近于发病率),因此非常需要预防肝癌的方法,"澳大利亚国立大学(ANU)医学院肝脏研究组首席研究员Geoffrey C. Farrell博士解释说。"一些人口数据表明,经常锻炼的人患肝癌的可能性较低,但针对这是否有真正的生物学基础的研究很少,如果有,识别产生这种保护作用的分子机制的研究也很少,而且这些研究结果还没有定论。"
研究人员研究了运动是否能减少肥胖/糖尿病小鼠肝癌的发生。基因驱使老鼠进食,从而导致肥胖和患上2型糖尿病,它们在年轻时被注射低剂量的致癌物。一半的老鼠被允许定期接触滚轮;另一半则没有,一直坐着不动。通过测量运动轮的转动,这些老鼠每天跑40公里。这种方法在三个月内减缓了体重的增加,但在六个月的实验结束时,即使是运动的老鼠也变胖了。六个月后,大多数久坐不动的老鼠患上了肝癌,而运动的老鼠则没有患上。
本研究表明,运动可以阻止与肥胖和2型糖尿病相关的脂肪肝小鼠肝癌的发展。具体来说,几乎所有注射了低剂量致癌物质的肥胖老鼠在六个月内都患上了肝癌,而经常锻炼的老鼠却没有。在这些实验的时间范围内,它们完全不受肝癌发展的影响。体重控制并不能减轻肝癌的发展。
研究人员还开展了详细的机制研究,部分阐明了运动如何预防肝癌。他们发现,自主运动的有益影响是通过分子信号途径发挥的,其中两种途径为抑癌基因p53和应激激活蛋白激酶JNK1。
研究人员首先证明了JNK1的激活是一个关键因素,可以通过运动来"关闭",并通过对缺乏JNK1的肥胖小鼠的单独研究证明了它的参与。他们还证明,被称为"细胞的守护者"和"致癌基因的警察"的p53的激活对细胞周期抑制剂p27的调节很重要,从而阻止注定会癌变的细胞的持续生长。
"锻炼已经被证明可以改善肝硬化患者的一些结果。如果目前在动物模型上的研究与患有脂肪肝的人类非常相似,并能在患者身上进行复制,那么运动即使不能完全预防肝癌,也有可能延缓肝癌的发病并减轻其严重程度,从而极大地改善患者的预后。此外,了解相关的分子途径为我们指出了一些方法,可以利用药物或药物营养素来发挥运动的强大保护作用,从而降低超重的糖尿病患者患肝癌的风险。"
8. Cell Rep:治疗恶性肝癌的新方法
在一项新的研究中,研究者们们发现了可能驱动罕见但致命的肝癌的最关键基因,为开发针对这些基因的药物提供了路线图。
这种名叫纤维细胞癌的肝癌占所有肝癌的1-5%,其主要影响儿童和青少年群体。由于被检测到时往往处于转移阶段,因此留给患者的生存时间往往很少。

在这项发表于《Cell Reports》杂志上的文章中,作者使用了康奈尔公司开发的技术--染色质运行测序(ChRO-Seq),该技术能够提供整个基因组的转录图谱。该技术由研究的共同作者、康奈尔大学贝克动物健康研究所助理教授查尔斯-丹科(Charles Danko)开发,使研究人员能够确定与健康的肝脏组织相比,纤维细胞癌的DNA中哪些区域可能被激活,与其他所有公开的类似数据的癌症类型相比,研究人员也能确定哪些区域的DNA可能被激活。总之,该研究提供了首个关于这一肿瘤的基因组活动如何重构的线索。通过了解这些内部运作,研究人员发现了一种可能有效的药物组合疗法。
DNA大多由不编码基因的区域组成,被称为 "非编码DNA",其中包括被称为增强子的DNA序列,它们作为可调节的开关,可以向上或向下调节附近的基因转录活性。研究人员利用ChRO-Seq技术鉴定了这些增强子的致密性、高活性簇,被称为超级增强子。
"最近已经证明,在超级增强子附近的基因对驱动这些细胞的行为特别关键,"Sethupathy说。该研究小组确定了大约15个与超级增强剂非常密切相关的基因,这些基因与纤维素瘤组织特异性的超级增强剂密切相关。
随后,作者发现这些特定的基因与MAPK信号通路有强烈的联系。据了解,MAPK信号通路在其他类型的癌症中也变得异常活跃,进而导致细胞增殖失控并癌化。
"目前,FDA已经批准了针对黑色素瘤等其他癌症的,针对MAPK通路的药物,"Sethupathy说。该团队开发了一种纤维细胞癌的细胞模型,使他们能够测试这些药物作为一种潜在的癌症治疗方法的表现。他们发现,这些药物确实能够破坏肿瘤细胞的存活能力。
进一步,作者发现癌细胞中有两个基因(SLC16A14和CA12)表达量异常活跃。当研究人员注射了SLC16A14的抑制剂后,大部分肿瘤细胞死亡。用CA12的抑制剂结合较低剂量的FDA批准的MAPK抑制剂进行治疗也显示出了非常好的效果。
该小组计划使用更多的小鼠模型来进一步测试该联合疗法,并更深入地研究SLC16A14的功能。这是下一步设计临床试验的最终目标。
9. NEJM实锤!5万人10年大数据发现低剂量阿司匹林可降低肝癌风险
DOI: 10.1056/NEJMoa1912035
高风险的慢性病毒性肝炎的成年人中,长期服用低剂量阿司匹林的人患肝癌或死于与肝相关疾病的可能性更小。这项研究结果发表在《The New England Journal of Medicine》上,由瑞典卡罗林斯卡学院和?rebro大学医院以及美国麻省总医院的研究人员领导的一个团队完成。

"在美国和欧洲国家,肝癌和肝病死亡率正以惊人的速度上升,"该研究的第一作者、麻省总医院胃肠病学和肝脏病学部门的研究员Tracey Simon说。"尽管如此,目前还没有确定的治疗方法来预防肝癌的发展,或降低与肝脏相关的死亡风险。"
基于登记的大型研究
为了进行分析,研究人员检查了来自瑞典50275名患有慢性病毒性肝炎的成年人的登记信息。慢性病毒性肝炎是一种由乙型或丙型肝炎病毒引起的肝脏感染,是肝癌最常见的危险因素。在10年的时间里,服用小剂量阿司匹林(每天少于163毫克)的病人中有4.0%患了肝癌,不服用阿司匹林的病人中有8.3%患了肝癌。服用阿司匹林的人患肝癌的相对风险降低了31%。
重要的是,研究表明,一个人服用低剂量阿司匹林的时间越长,益处越大。与短期使用(3个月至1年)相比,使用1-3年的人肝癌死亡风险降低了10%,使用3-5年的人肝癌死亡风险降低了34%,使用5年以上的人肝癌死亡风险降低了43%。此外,服用阿司匹林超过10年的患者中,有11.0%的人死于与肝脏相关的疾病,相比之下,未服用阿司匹林的患者中有17.9%的人死于与肝脏相关的疾病,这意味着服用阿司匹林的患者的相对风险降低了27%。
不会增加内出血的风险
无论性别、肝炎的严重程度或乙型或丙型肝炎病毒的类型如何,服用阿司匹林的人体内出血的风险(长期服用阿司匹林时的一个担忧)并没有显着升高。
"这是第一个大规模的全国性研究,证明阿司匹林的使用可以显着降低肝癌的长期风险和与肝脏相关的死亡率,"该研究的资深作者、卡罗林斯卡学院医学流行病学和生物统计学教授Jonas F. Ludvigsson说道。
研究人员指出,需要进行前瞻性随机对照试验,以测试阿司匹林对肝病患者的疗效。
10. Nat Commun:肝癌细胞的异质性有助于解释患者肿瘤的进展
DOI: https://doi.org/10.1038/s41467-019-14050-z
西奈山医院的研究人员报告说,许多肝癌肿瘤含有高度多样化的细胞群,这种现象被称为肿瘤内部的异质性,会显着影响肿瘤生长的速度。免疫系统对这种异质性的贡献可能具有重要的临床意义。
在《Nature Communications》上发表的一项新研究中,研究小组报道约30%的肝细胞癌(HCC)患者会出现这种异质性,HCC是最常见的肝癌,其中一些肿瘤通过劫持不同基因网络快速生长。

"肿瘤是一个复杂的生态系统,我们的研究结果首次表明他们可以通过与免疫系统的相互作用而进化,"西奈山Tisch癌症研究所肝癌项目助理教授、该研究的通讯作者Augusto Villanueva博士说道。"通过更好地了解肿瘤的发展过程,我们了解了更多关于它们如何适应药理学压力,以及它们如何形成对癌症治疗的抵抗机制。这种更大的意识将有希望导致我们识别生物标记,可以预测哪些患者对治疗有反应。"
研究小组的一项发现是,单个肝癌活检可能会对肝脏肿瘤产生错误的描述。
Villanueva博士说:"就基因构成和免疫细胞浸润而言,有些肿瘤非常相似,而有些则非常不同。这意味着来自同一肿瘤的活检会根据取材地点产生不同的信息,从而影响患者的临床决策。这就是为什么我们的工作旨在了解肿瘤是如何演变的,以及它们可以采取的不同轨迹,这对未来的癌症研究以及有效治疗癌症非常重要。"
随着免疫疗法继续改变癌症的研究和治疗,最有希望的领域之一是肝癌。就发病率和死亡率而言,肝癌已经成为美国增长最快的恶性肿瘤,每年有3.3万新病例。两项使用PD-1免疫检查点抑制剂的2期临床试验在人体中取得了前所未有的反应,促使美国食品和药物管理局(Food and Drug Administration,FDA)加快批准这些药物用于晚期肝细胞癌的二线治疗。PD-1免疫检查点抑制剂有助于人体免疫系统识别和攻击癌细胞。
最近,一项结合PD-1免疫检查点抑制剂和抗血管生成药物的三期临床试验,与目前的一线治疗标准索拉非尼相比,提高了生存率。尽管如此,只有大约30%的HCC患者被认为对免疫检查点抑制有良好的反应--这种结果在免疫治疗中并不罕见。
"免疫系统的进化对肝癌产生了重要的约束,通过调查免疫细胞和癌症细胞在分子水平上之间的相互作用,我们试图预测肿瘤耐药性的机制,"该研究的第一作者Bojan Losic博士解释说。"考虑到免疫检查点抑制剂在某些异质实体肿瘤中的显着成功,我们的工作尤其相关。"
为了了解驱动肿瘤恶化的机制,来自西奈山和其他世界各地的医疗中心的研究小组对来自多个区域相同的14个肝癌患者的肿瘤结节的基因表达分析,免疫活动,和DNA突变进行了综合分子分析。这项研究是第一次在同一肿瘤结节的多个区域使用单细胞RNA测序,也是第一次评估免疫系统对肝癌进化的贡献。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


