Cancer Res: 同时抑制IGF1R和ERK增加胰腺癌对自噬抑制剂的敏感性
来源:本站原创 2021-12-30 10:27
胰腺导管腺癌(PDAC)的侵袭性要求改进的治疗方法的发展。由于KRAS突变存在于95%的PD AC中,并且对生命或维持至关重要,因此一种促进策略包括利用KRAS依赖的代谢扰动。KR突变体PD AC自噬的宏代谢过程上调,PD AC的生长依赖于自噬
胰腺导管腺癌(PDAC)的侵袭性要求改进的治疗方法的发展。由于KRAS突变存在于95%的PD AC中,并且对生命或维持至关重要,因此一种促进策略包括利用KRAS依赖的代谢扰动。KR突变体PD
AC自噬的宏代谢过程上调,PD AC的生长依赖于自噬。然而,溶酶体抑制剂羟基氯喹(HCQ)抑制自噬作为肿瘤治疗已显示出有限的临床疗效。
图片来源: https://pubmed.ncbi.nlm.nih.gov/34921013/
HCQ/CQ是目前唯一获得临床批准的自噬抑制剂,作为单药治疗胰腺癌尚未显示出明显的临床疗效。在本研究中,作者推测新生或治疗诱导的获得性补偿机制可能与HCQ的有限疗效有关。为了评估这种可能性,作者采用了两种截然不同的经验策略。
首先,作者使用癌症信号网络或聚焦于CRISPR-C AS9文库的遗传功能丧失筛查来鉴定影响PDAC细胞系对环磷酰胺(CQ)敏感性的基因。其次,作者完成了RPPA信号谱分析,以确定CQ处理后的补偿活动。这两种策略都集中在IGF1R上。
然而,作者还发现IGF1R抑制导致了补偿性ERK活性,为共同靶向ERK和IGF1R以进一步增加PDAC对自噬的依赖奠定了基础。最后作者认为,同时靶向IGF1R、ERK和自噬的三联疗法可能为PDAC的治疗提供一种有效的治疗策略。
作者以前曾报道,PDAC中KRAS或MEK/ERK的基因抑制会导致明显的代谢改变,从而增加对自噬的依赖。在本研究中,作者再次确认M APK1(ERK2)的缺失是自噬抑制的顶级增敏剂之一。此外,GSEA显示,增强CQ敏感性的CRISPR HITS对应于最近被鉴定为在PDAC中抑制ERK MAPK信号时丢失的顶级转录基因集。
作者的RPPA分析也显示CQ诱导RTK的补偿激活。本研究中发现的RTKs激活的代谢信号通路直接拮抗自噬,特别是Ras-RAF-M EK-ERK或PI3K-AKT-mTOR信号通路。接下来,作者利用CRISPR-CAS9筛查结果来识别具有软管损失的RTK,这些RTK将使细胞对CQ敏感。这一分析使作者将重点放在IGF1R上。作者发现,抑制IGF1R可增加PD AC细胞的自噬能力,并与CQ/HCQ协同作用降低细胞存活率和体内生长。
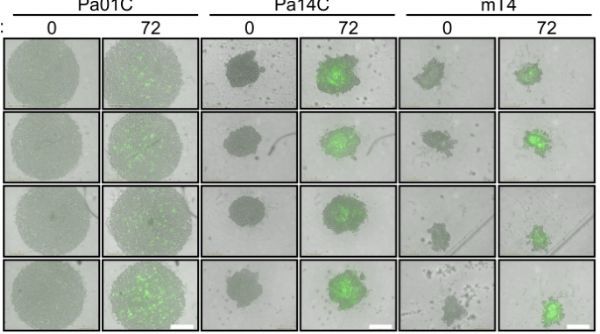
IGF1R和自噬双重抑制对3D和在体模型PDAC增殖的影响
图片来源: https://pubmed.ncbi.nlm.nih.gov/34921013/
作者发现IGF1R的激活是一种共有的补偿活性,加入IGF1R抑制剂可增强ERK抑制剂和CQ同时治疗的效果。IGF1R是一个有吸引力的靶点,因为较高的IGF1R蛋白表达与PDAC患者的预后有关,因此被建议作为一种生物标志物来识别更多需要多药注册的侵袭性癌症。
然而,应该注意的是,目前尚不清楚IGF1Ri、Erki和HCQ同时治疗的患者将如何耐受,也不知道它将如何影响晚期疾病患者最关心的恶病质。因此,这一结合需要进一步研究,以解决这些问题。在这项研究中,作者强调了一条通过利用每种治疗途径的补偿通路激活来提高靶向治疗的有效性的途径,这些靶向治疗消除了IGF1R、MEK/ER K和自噬活性。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。