Nature:揭示肠道微生物改变的饮食模式刺激机体免疫细胞发育的分子机制
来源:生物谷原创 2023-07-06 16:21
来自哈佛医学院等机构的科学家们通过研究揭示了这一过程,指出了食物和健康之间的一个关键中介,即组成机体微生物组的倡导菌群或与人类共生的微生物群落。
饮食和健康密不可分的概念并不新鲜,几千年来,人们早已经知道,营养不良是引起很多健康问题的原因,但是解释饮食是如何改变机体细胞、组织和器官功能背后的确切机制的相关研究仍然很少。近日,一篇发表在国际杂志上题为“Gut microbial fatty acid isomerization modulates intraepithelial T cells”的研究报告中,来自哈佛医学院等机构的科学家们通过研究揭示了这一过程,指出了食物和健康之间的一个关键中介,即组成机体微生物组的倡导菌群或与人类共生的微生物群落。
这项在小鼠机体中进行的研究表明,肠道菌群能以诸如亚油酸(linoleic acid)等常见脂肪酸为食,并将其转化为共轭亚油酸(CLA,conjugated linoleic acid);随后这种副产物能作为一种生物级联信号,最终刺激特定类型的免疫系统发育并驻留在小肠组织中。这项研究中,研究者观察到,机体中这种级联反应被打断的小鼠更容易屈服于常见的食源性病原体,相关研究发现详细揭示了肠道微生物、食物和机体免疫力之间的错综复杂的相互作用,同时还强调了理解肠道中单一的微生物如何改变特定器官的功能并对健康产生重要影响的重要性。
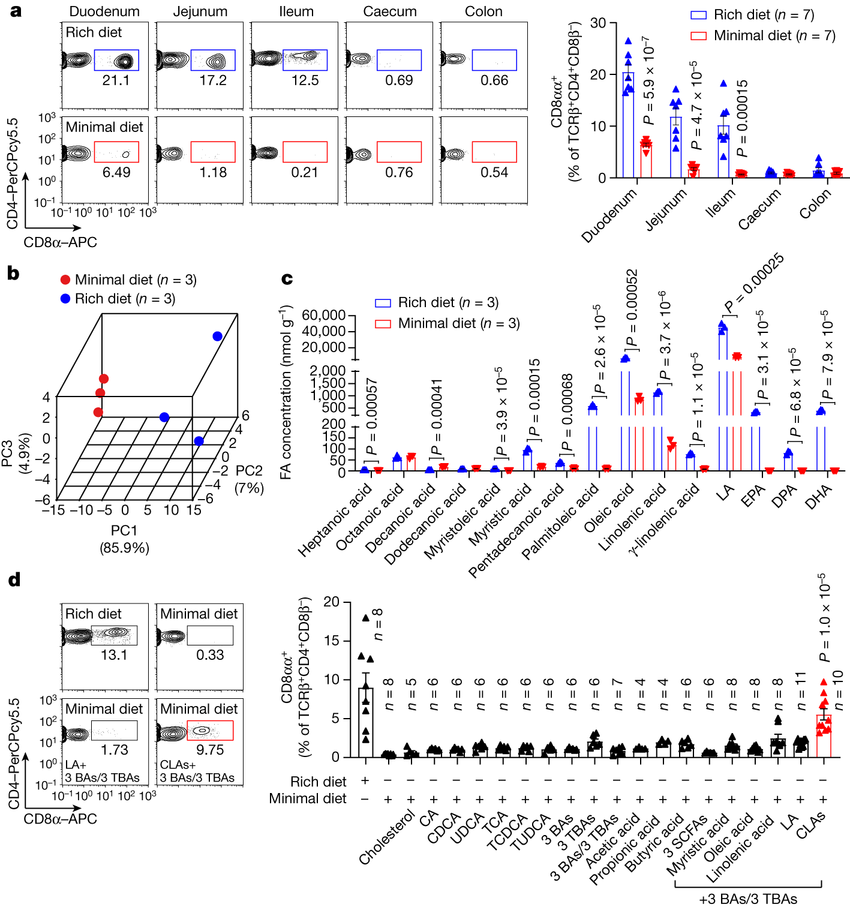
揭示肠道微生物改变的饮食模式刺激机体免疫细胞发育的分子机制。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06265-4
研究者Dennis Kasper说道,饮食-微生物-免疫系统能引起科学家们的极大关注,但却缺乏细节来阐明这三种组分是如何在一起协同工作并发挥作用的;本文中,研究人员关于饮食和微生物组如何建立宿主机体的免疫系统背后的机制给出了一种最清晰的阐释。最初研究者注意到,无菌小鼠(一种常见的实验室模型,其机体中并没有微生物的自然定植,因此其机体中是无菌的)缺少一种称之为CD4+CD8αα+上皮内淋巴细胞(IELs,intraepithelial lymphocytes),后者是一种通常能在小肠特定部位定植的细胞类型。
有意思的是,那些无菌而摄入仅由维持生命的必要营养物质所组成的最低限度饮食的小鼠也缺乏这些细胞,然而,CD4+CD8αα+ IELs存在于被喂食由许多不同营养物质所组成的典型丰富的商业化饮食的无菌小鼠体内。研究人员怀疑,饮食和微生物组之间的相互作用或许会导致CD4+CD8αα+ IELs细胞的存在或缺失,因此他们分析了这种最低限度的饮食中缺少哪种营养物质,最终锁定了多种脂肪酸;当给携带典型微生物组的最低限度小鼠喂食单一的脂肪酸后,研究者发现,摄入一种称之为亚油酸的长链脂肪酸的小鼠会开始在其小肠中生长出CD4+CD8αα+ IELs细胞。
研究者Kasper解释道,定植在肠道中的很多细菌都会产生名为亚油酸异构酶(LAI,linoleic acid isomerase)的酶类,其能将亚油酸转化为一种共轭形式,其中一些亚油酸的双键和单键会被重新排列;而进一步的调查研究显示,CLA(亚油酸的共轭形式)在被喂食最低限度饮食携带典型微生物组的小鼠或被喂食丰富饮食的小鼠机体中的水平都较低,这或许就表明,这种细菌是将亚油酸转化为CLA的必要条件。当研究人员将产生LAI的细菌定植到无菌小鼠体内并给予其喂食丰富食物后,这些动物就会在其小肠组织中生长出CD4+CD8αα+ IELs细胞;相反,当研究人员给予其肠道中定植通过遗传修饰无法产生LAI的细菌时,这些小鼠体内并不会发育出CD4+CD8αα+ IELs细胞,这就表明,这些细菌酶类所产生的CLA对于这些免疫细胞的生长至关重要。
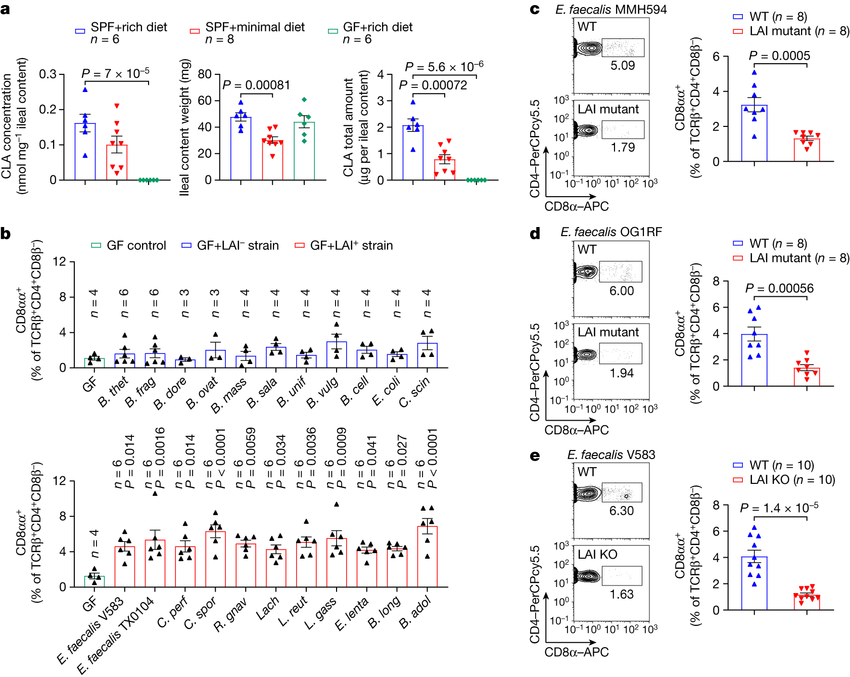
揭示肠道微生物改变的饮食模式刺激机体免疫细胞发育的分子机制。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06265-4
进一步调查研究结果表明,CLA刺激CD4+CD8αα+ IELs细胞发育背后或许存在一种更完整的机制,研究人员发现,小肠中的一些免疫细胞能在其表面产生一种名为肝细胞核因子4g (HNF4g,hepatocyte nuclear factor 4g)的蛋白,其是CLA的受体分子。当CLA吸附到这些受体上时,细胞就会产生名为白介素18R(IL-18R)的不同蛋白,这反过来就会降低名为ThPOK的第三种蛋白质的产生,而ThPOK产生地越少,发展的CD4+CD8αα+ IELs细胞就越多。研究者表示,这一复杂的通路对于机体抵御感染的免疫力有着非常明显的影响;实际上,当研究人员干扰这种级联反应的任何部分时(比如阻断IL-18R或HNF4g的产生),机体中级联反应被关闭的小鼠就不会产生CD4+CD8αα+ IELs细胞,也无法抵御鼠伤寒沙门氏菌(一种常会引起食物中毒的细菌种类)引起的感染。
研究者表示,饮食-微生物-免疫系统三者之间的更多例子目前尚未出现的原因之一在于这些通路较为复杂;而通过调查这些复杂的通路,研究人员或许就能更好地理解机体的微生物组是如何维持健康以及在机体不健康时是如何进行干预的。综上,本文研究结果揭示了细菌脂肪酸代谢通路通过调节CD4+ T 细胞和CD4+CD8αα+细胞之间的相对数量在控制宿主机体上皮内免疫平衡方面所扮演的关键角色和作用。(生物谷Bioon.com)
原始出处:
Song, X., Zhang, H., Zhang, Y. et al. Gut microbial fatty acid isomerization modulates intraepithelial T cells. Nature (2023). doi:10.1038/s41586-023-06265-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


