慢性肾脏病相关性瘙痒(CKD-aP)药物!外周κ阿片受体(KOR)激动剂Korsuva在美欧进入审查!
来源:本站原创 2021-03-31 17:27
Korsuva是一款突破性药物,在3期临床显著改善瘙痒强度和生活质量。

2021年03月31日讯 /生物谷BIOON/ --Cara Therapeutics是一家临床阶段的生物制药公司,专注于开发和商业化新的化学物质,旨在通过选择性靶向外周κ阿片受体(KOR)来缓解瘙痒。近日,该公司与合作伙伴Vifor Pharma联合宣布,欧洲药品管理局(EMA)已受理Korsuva(CR845,difelikefalin)注射液的营销授权申请(MAA),该药用于治疗血液透析患者慢性肾脏病相关瘙痒(CKD-aP)。EMA将通过集中营销授权程序对MAA进行审查,预计将于2022年第二季度作出审查决定。
本月初,美国FDA受理了Korsuva治疗血液透析患者CKD-aP的新药申请(NDA)并授予了优先审查。此前,FDA已授予Korsuva治疗该适应症的突破性药物资格(BTD)。FDA已指定《处方药用户收费法》(PDUFA)目标日期为2021年8月23日。FDA表示,目前不打算召开咨询委员会会议来讨论申请。
如果获得批准,Korsuva将成为第一个治疗血液透析患者慢性肾脏病相关瘙痒(CKD-aP)的药物。
慢性肾脏病相关性瘙痒(CKD-aP)是接受血液透析的慢性肾脏病患者中发生的一种疾病,许多透析患者(60-70%)会出现瘙痒,30-40%的病例报告为中度或重度。
Korsuva活性药物成分为difelikefalin,这是一种首创(first-in-class)KOR激动剂,作用于人体外周神经系统和某些免疫细胞。
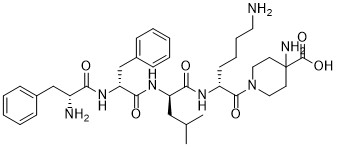
difelikefalin化学结构式(图片来源:medkoo.com)
Korsuva MAA和NDA均基于2项关键3期临床试验的阳性数据,包括在美国开展的KALM-1试验和全球性KALM-2试验,以及来自额外32项临床研究的支持性数据。在3期临床试验中,伴有中度至重度CKD-aP的血液透析患者,接受Korsuva注射液治疗后,瘙痒强度和生活质量指标均表现出统计学意义的显著改善。
Cara Therapeutics总裁兼首席执行官Derek Chalmers博士表示:“EMA受理Korsuva的监管申请,标志着我们的另一个重要里程碑。我们期待着为全世界患有慢性顽固性瘙痒的血液透析患者带来这种首创(first-in-class)疗法,Korsuva有潜力从根本上改变这一严重未满足需求的治疗模式。我们期待着在审查过程中与EMA合作,并与我们的商业合作伙伴Vifor Pharma一起,继续专注于为Korsuva注射液在整个欧洲地区的上市做准备。”
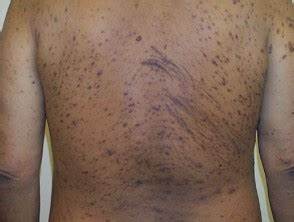
慢性肾脏病相关瘙痒症(CKD-aP,图片来源:DermNet NZ)
慢性肾病相关性瘙痒(CKD-aP)是一种难治性全身瘙痒病,在接受透析的慢性肾脏疾病患者中发生频率高、强度大。在没有透析的III-V期CKD患者中也有瘙痒的报道。综合、纵向、多国研究估计,终末期肾病(ESRD)患者CKD-aP的加权患病率约为40%,约25%的患者报告严重瘙痒。
大多数透析患者(约60%至70%)报告瘙痒,其中30%至40%报告中度或重度瘙痒。来自ITCH National Registry Study(瘙痒国家注册研究)的最新数据显示,在瘙痒患者中,约59%的患者每天或几乎每天都会出现症状,持续一年以上。鉴于其与CKD/ESRD的关系,大多数患者将持续数月或数年的症状,目前使用的止痒药,如抗组胺药和皮质类固醇,无法提供一致的、充分的缓解。中重度慢性瘙痒反复被证明直接降低生活质量,导致损害生活质量的症状(如睡眠质量差),并与抑郁相关。CKD-aP也是血液透析患者死亡率的独立预测因子,主要与炎症和感染风险增加有关。(生物谷Bioon.com)
原文出处:VFMCRP and Cara Therapeutics announce European Medicines Agency has accepted to review the Marketing Authorization application for difelikefalin
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


