造血干细胞研究进展(第15期)
来源:生物谷原创 2025-11-28 16:10
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。
造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
1. PNAS:造血系统藏双引擎!胚胎期前体才是免疫细胞主力军,衰老免疫力下降真相被破解
DOI: 10.1073/pnas.2505510122
长久以来,我们都认为骨髓中的造血干细胞(HSC)是血液生成的 “唯一源头”——从红细胞到免疫细胞,所有血细胞都源于这个 “全能干细胞”,再通过多能祖细胞逐步分化成熟。
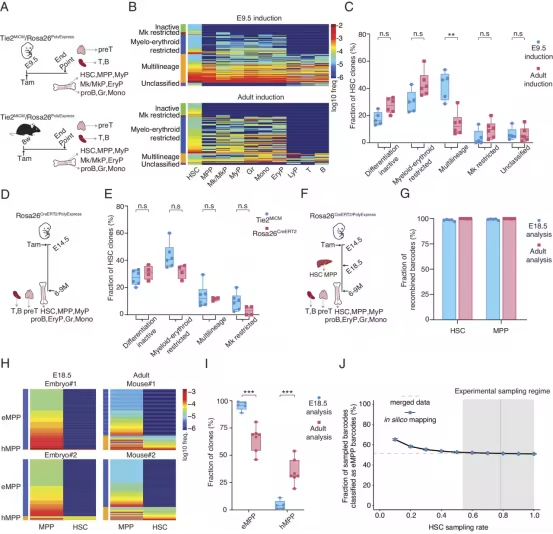
但这个沿用数十年的经典模型,如今被一项突破性研究彻底改写。由德国癌症研究中心 Hans-Reimer Rodewald、Thomas Höfer 教授与中国南京医科大学 Xi Wang 教授联合领导的国际团队,在《PNAS》发表的成果揭示:人体存在两个平行运转的造血系统,而大多数免疫细胞的 “真正摇篮”,竟是胚胎早期就已存在、完全独立于造血干细胞的胚胎多能前体(embryonic multipotent precursors, eMPPs)。
血液作为维持生命的 “流动组织”,包含数千亿个需持续更新的细胞,既要靠红细胞输送氧气,也要靠淋巴细胞等免疫细胞抵御病菌。此前的层级模型认为,造血干细胞是绝对核心,能分化出所有血细胞类型。但近年来,越来越多证据显示这个模型过于简化,而新的细胞谱系追踪技术终于让 “隐藏的造血系统” 浮出水面。
研究团队开发了先进的细胞标记技术,能在数月内精准追踪小鼠体内单个血细胞的发育轨迹,结果令人意外:约三分之一的血细胞来自 eMPPs 系统,且这两个造血 “引擎” 有着明确的功能分工——eMPPs 系统是 “免疫细胞专属工厂”,优先产生淋巴细胞等核心免疫细胞;而造血干细胞及其后代(hematopoietic multipotent progenitors, hMPPs)则是 “基础造血部队”,主要负责生成粒细胞、红细胞等髓系细胞,二者平行运转、各司其职。更关键的是,eMPPs 并非胚胎期的 “临时产物”,而是持续活跃至成年期,成为维持免疫系统功能的核心力量。
2. 全球首个"人源全组分"骨髓模型问世!Cell Stem Cell:3D 复刻造血微环境,血癌研究告别动物实验
DOI: 10.1016/j.stem.2025.10.009
我们体内的 “造血工厂”——骨髓,是个由成骨细胞、血管、神经、免疫细胞等多种组分构成的复杂网络,它默默维系着血细胞生成,一旦功能失常(如血癌发生),就会引发严重健康危机。几十年来,科学家们一直依赖动物实验或简化细胞系统研究骨髓,但始终无法复现人体骨髓的真实复杂性。
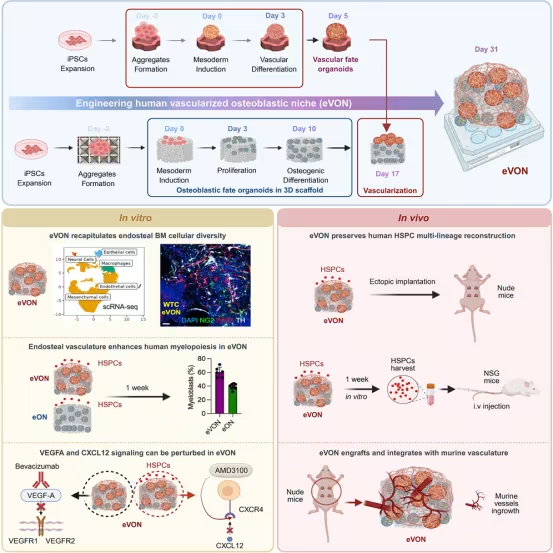
如今,巴塞尔大学和巴塞尔大学医院的研究团队在《细胞・干细胞》杂志上报告了一项突破性成果:他们成功构建出全球首个完全由人类细胞构成的 3D 骨髓骨内膜龛模型(eVON),首次整合了血管、神经、免疫细胞等所有关键组分,为血癌研究、药物测试和个性化治疗开辟了全新路径。
骨髓中的骨内膜龛是造血的核心微环境,位于骨表面附近,不仅调控正常血细胞生成,还与血癌的化疗抵抗密切相关。这个微环境的构成极其复杂,包含血管网络、成骨细胞、周细胞、交感神经纤维和巨噬细胞等多种细胞,且各组分间通过精准的分子信号协同作用。在此之前,没有任何一个人源模型能完整复现这种结构与功能的完整性,而 eVON 模型的出现彻底改变了这一局面。
研究团队的构建思路源于对人体骨髓发育的模拟:他们首先选用羟基磷灰石制成的 3D 多孔支架,这种天然矿物质与人体骨小梁的无机成分和结构高度相似,为细胞生长提供了理想的物理支撑。随后,他们利用人类诱导多能干细胞(hiPSC),通过发育导向的分化策略,让干细胞逐步形成成骨细胞、血管内皮细胞、周细胞等基础组分。更令人惊叹的是,这个模型还自发分化出了此前从未在人源骨髓模型中出现的关键细胞——TH+交感神经纤维和 CD68+巨噬细胞样细胞,形成了完整的神经-血管-免疫网络,与天然人类骨内膜龛的细胞组成几乎一致。
3.Small突破性研究!多尺度生物工程支架革新造血干细胞扩增与脑类器官功能,赋能再生医学与新型生物计算
doi:10.1002/smll.202504070
在血液疾病临床治疗中,造血干细胞移植常因供体干细胞数量不足陷入困境;而人脑作为人体最复杂的器官,其发育机制与疾病研究始终受伦理约束和实验材料限制,难以深入推进。这些难题长期制约着再生医学与神经科学的发展,直到近日Small刊发一项突破性研究通过生物工程多尺度技术构建的支架系统,为干细胞扩增与类器官研究提供了新方向,有望推动相关领域技术革新。
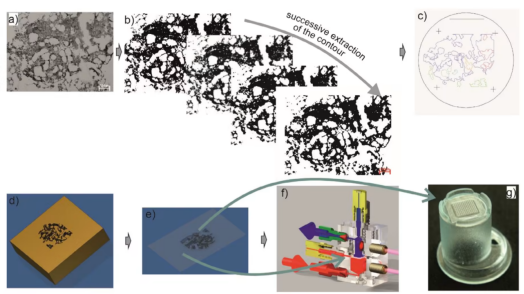
该研究团队聚焦造血干细胞与脑类器官两大核心方向,构建了多尺度生物工程支架系统。在造血干细胞研究中,团队以人类长骨横截面形态为基础,研发出聚二甲基硅氧烷三维支架。这种支架不仅具备透明特性,方便实时观察细胞状态,还能轻松收获培养后的细胞,同时兼容常规24孔细胞培养板,适配现有实验室操作体系,可精准复现骨髓的宏观、微观及纳米尺度微环境。
实验结果显示,该三维支架在14天体外培养过程中,能高效扩增人类造血干细胞,同时维持细胞的多向分化潜能与自我更新能力,其扩增效果显著优于传统二维聚苯乙烯培养皿及无结构二维聚二甲基硅氧烷表面。进一步研究发现,氧化硅涂层可提升支架表面亲水性,进而增加造血干细胞总产量;而未涂层支架更利于长期未成熟造血干细胞的增殖,且支架内大量细胞会表达造血干细胞特异性表面标志物CD34。未来研究将聚焦诱导多能干细胞来源造血干细胞的培养优化,同时通过调整支架刚度、表面参数及构建共培养体系,进一步贴近天然造血干细胞微环境。
4. Cell Stem Cell:血癌基因DNMT3A的惊人新角色!科学家解锁造血干细胞长寿的奥秘
DOI:10.1016/j.stem.2025.06.010
在探索血液癌症的神秘世界中,科学家们一直在寻找隐藏在基因背后的秘密,DNMT3A基因不仅在造血干细胞的发育中扮演着关键角色,还与血液癌症的发生密切相关。近日,一篇发表在国际杂志Cell Stem Cell上题为“Non-canonical functions of DNMT3A in hematopoietic stem cells regulate telomerase activity and genome integrity”的研究报告中,来自华盛顿大学医学院等机构的科学家们通过研究揭示了DNMT3A基因在造血干细胞长寿和基因组稳定性方面的新功能,这些功能与其已知的DNA甲基化作用无关。
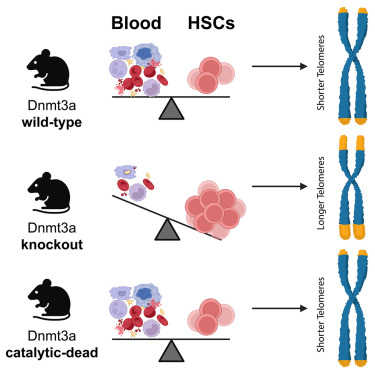
造血干细胞(HSCs, hematopoietic stem cell)是血液系统中的“种子细胞”,主要负责生成红细胞、白细胞和血小板等所有类型的血细胞;DNMT3A基因在调控造血干细胞的命运决策中起着至关重要的作用。然而,当该基因发生突变时,造血干细胞的正常功能就会受到干扰从而导致血液癌症的风险增加,比如,急性髓系白血病(AML)是一种常见的血液癌症,其发病与DNMT3A基因的突变密切相关。据统计,DNMT3A是人类克隆性造血(CH)中突变频率最高的基因之一,这种突变可能随着年龄增长或受到环境因素(如吸烟)的影响而积累。
长期以来,科学家们一直认为DNMT3A的主要功能是通过DNA甲基化来调控基因表达,然而,这项研究中,研究人员发现,DNMT3A在造血干细胞中还具有与DNA甲基化无关的非典型功能,他们通过构建一系列具有不同程度DNA甲基化受损的Dnmt3a基因敲除小鼠模型,结果发现,即使在DNA甲基化能力完全丧失的情况下,Dnmt3a蛋白仍能够拯救Dnmt3a缺陷型造血干细胞的克隆扩增,这一发现表明,Dnmt3a在造血干细胞中可能具有独立于DNA甲基化的其他重要功能。
研究中最令人惊讶的发现之一是DNMT3A对端粒长度的调控作用,端粒是DNA分子末端的“帽子”,每次细胞分裂时都会变短,这样就会限制细胞的分裂次数;然而,研究人员发现,当DNMT3A基因缺失或功能异常时,造血干细胞的端粒长度不会缩短,反而能维持在较长的状态,这意味着这些细胞可以无限增殖,而这正是癌症细胞的一个重要特征。此外,Dnmt3a基因敲除的造血干细胞还显示出更高的端粒酶活性,这进一步支持了其能维持端粒长度的能力。
5. 骨髓“小工厂”新突破!Stem Cell Res Ther:基因改造基质细胞巧建仿生微环境,无需额外养料也能养好造血干细胞
doi:10.1186/s13287-025-04474-4
在血液疾病治疗领域,造血干祖细胞(HSPCs)基因疗法已展现出巨大潜力,比如CRISPR/Cas9-based HSPCs基因疗法获批用于镰状细胞病治疗。但目前HSPCs的体外培养仍面临难题:培养压力影响移植效果,外源性细胞因子补充又推高基因治疗产品成本。
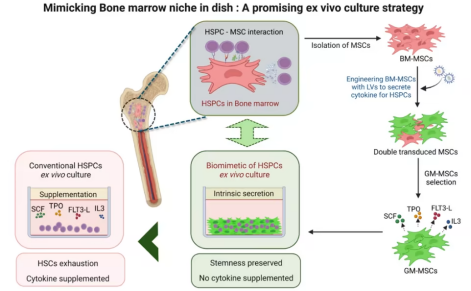
近期,发表在Stem Cell Res Ther上的一项研究Engineering biomimetic bone marrow niche with gene modified mesenchymal stromal cells for ex vivo culture of human hematopoietic stem and progenitor cells为解决这些问题带来了新希望。
研究团队开发了一种基因修饰的人骨髓间充质干细胞(GM-MSCs),其能分泌干细胞因子(SCF)、血小板生成素(TPO)、FMS样酪氨酸激酶3配体(FLT3L)和白细胞介素3(IL3),可模拟骨髓细胞微环境来辅助HSPCs培养。
在这种GM-MSCs的支持下,HSPCs的增殖效果与标准培养条件相当,且无需外部细胞因子补充。更重要的是,这些HSPCs能保留干细胞特性,包括集落形成能力、干性基因特征,以及在NBSGW小鼠体内长期多谱系重建的能力。同时,该仿生饲养层还能支持并减轻基于同源定向修复(HDR)的HSPCs基因编辑相关压力,这种基因编辑旨在重新激活胎儿血红蛋白,有望应用于β-血红蛋白病的基因治疗。
6. Nat Cell Biol:人体造血干细胞的代谢图谱,科学家解锁血液疾病治疗的新钥匙
doi:10.1038/s41556-025-01709-7
近日,一篇发表在国际杂志Nature Cell Biology上题为“Differentiation, ageing and leukaemia alter the metabolic profile of human bone marrow haematopoietic stem and progenitor cells”的研究报告中,来自海德堡大学等机构的科学家们通过研究全面剖析了人体造血干祖细胞(HSPCs,haematopoietic stem and progenitor cells)的代谢图谱,并探究其在分化、衰老以及急性髓系白血病(AML)发生过程中的变化。
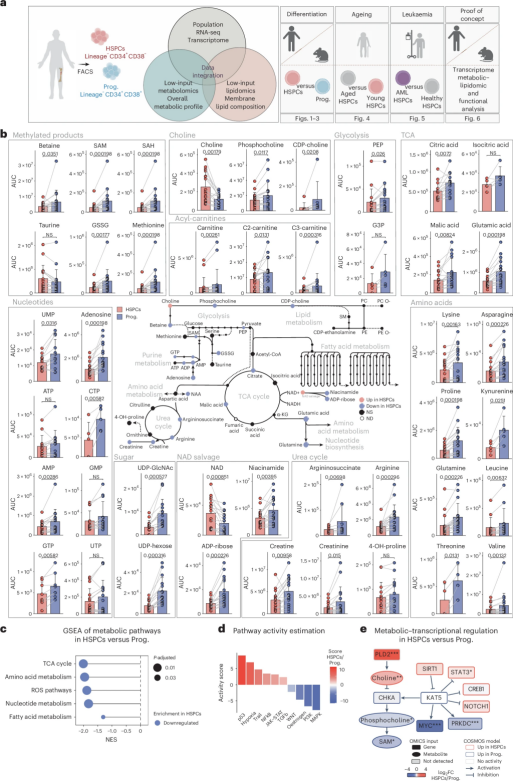
由于人体中造血干祖细胞的数量稀少且难以获取,此前对其代谢进行的相关研究相对有限。为了克服这一挑战,研究人员采用了低输入量的靶向代谢组学和非靶向脂质组学技术,并结合单细胞RNA测序对来自86名健康供体和AML患者的造血干祖细胞进行了综合分析。通过这种方法,研究人员就能从极少量的细胞样本中检测到多达193种代谢物和脂质,从而为揭示造血干祖细胞的代谢特征提供了前所未有的深度和精度。
实验中,研究人员首先从健康年轻个体(20-40岁)的骨髓中分离出造血干祖细胞及其下游祖细胞,随后利用液相色谱-质谱联用技术(LC-MS)对这些细胞进行代谢物检测;结果显示,与下游祖细胞相比,造血干祖细胞中多种关键代谢物的水平较低,这与其相对静止的代谢状态相符合,比如,参与三羧酸循环(TCA cycle)的代谢物、氨基酸和核苷酸在造血干祖细胞中的含量显著低于祖细胞;此外,造血干祖细胞中的胆碱(choline)含量较高,而随着细胞分化和衰老,机体胆碱的水平会逐渐下降,尤其在AML患者中,胆碱水平还会进一步降低,这一发现表明,胆碱可能在维持造血干祖细胞的干性特征中发挥着重要作用。
为了进一步验证胆碱对造血干祖细胞功能的影响,研究人员进行了体外实验,结果发现,胆碱的补充能促进造血干祖细胞中脂质的合成并增强其干性特征,具体来说,胆碱处理后的造血干祖细胞在体外表现出更强的自我更新能力和静止状态,这就表明,胆碱能通过调节脂质代谢来维持造血干祖细胞的功能,对小鼠机体中的造血干细胞进行类似的代谢分析后,研究者还发现,其代谢特征与人类造血干祖细胞高度相似,这就为后续的动物模型研究提供了基础。
7. Cell:我国科学家揭示在异基因造血干细胞移植中,干细胞输注时间对急性移植物抗宿主病发病率和严重程度的影响
DOI: 10.1016/j.cell.2025.03.022
人类造血干细胞形态上类似于小淋巴细胞,在骨髓中仅占有核细胞的1%左右。人类造血干细胞来自胚胎期卵黄囊的间皮细胞,是人体内最独特的体细胞群。跟APSC多能细胞一样,是一类具有自我复制和多向分化潜能的原始细胞,它也是维持生命不息的最基本动力,多功能活化细胞抗衰老就是通过利用由自体采集的组织细胞,经实验室分离、培养后,将增殖的干细胞注入回人体内,通过多功能活化细胞自我靶向性功能准确到达相应的受损器官和组织,以达到修复衰老、病变的细胞,重建功能正常细胞和组织的目的。
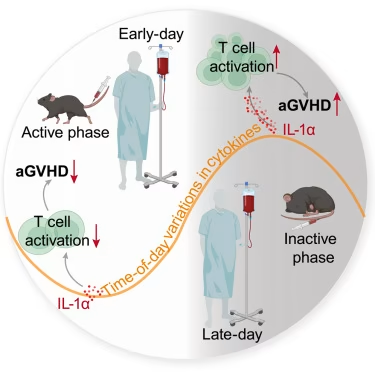
在一项发表在Cell杂志上的新研究中,来自中国科技大学、中国科学院和华中科技大学等研究机构的研究人员确定了造血干细胞输注时间对异基因造血干细胞移植(allo-HSCT)中急性移植物抗宿主病(aGVHD)发病率和严重程度的影响,这凸显了移植受者昼夜节律(即生物钟)的作用。
异基因造血干细胞移植是治疗血液系统恶性肿瘤、骨髓衰竭综合征和先天性免疫缺陷等疾病的关键策略。然而,尽管采取了有效的预防措施,aGVHD仍然是异基因造血干细胞移植中常见的并发症和移植相关死亡的主要原因。
输注时间如何影响aGVHD的发展。他们的研究结果强调了输注时间在异基因造血干细胞移植中的重要性,并建议在一天的早期输注应作为预防aGVHD的一种简单而有效的方法。
为了研究其机制,研究人员建立了MHC不匹配的异种aGVHD小鼠模型,在一天中的不同时间注入造血干细胞。他们的研究结果表明,虽然造血干细胞采集的时间对aGVHD的发展没有影响,但移植受者的昼夜节律显著影响了aGVHD的发病和严重程度。
8. Nat Commun:新研究揭示人类造血干细胞如何抑制体内的炎症和免疫反应
DOI: 10.1038/s41467-025-57096-y
我们的血液由许多细胞类型组成,这些细胞类型由造血干细胞分化而来。由法兰克福医科大学和歌德大学领导的一个国际研究团队如今研究了人类血细胞的发育途径。他们的发现令人惊讶:即使是造血干细胞也具有能够抑制体内炎症和免疫反应激活的表面蛋白。这一发现尤其适用于造血干细胞移植,例如用于治疗白血病。该研究发表在《Nature Communications》杂志上。
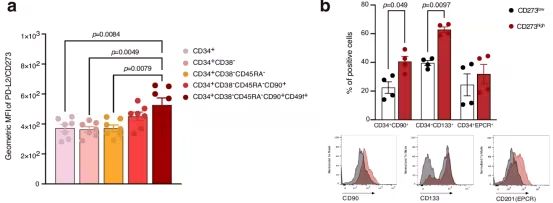
在这项新的研究中,该团队由法兰克福大学医学二系的Michael Rieger教授领导,从分子上解码了人类造血干细胞分化为所有特殊血细胞类型的途径。通过使用最先进的测序方法,他们确定了62000多个细胞中的基因和蛋白质表达模式,并利用高性能计算分析了由此产生的数据。
Rieger解释说,“我们能够全面了解造血干细胞的分子过程,并发现新的表面蛋白,这些蛋白对造血干细胞与其骨髓环境之间的复杂相互作用至关重要。这为我们提供了关于造血干细胞独特特征的详细见解,以及哪些基因调节造血干细胞分化。我得实验室新建立的这项技术将非常精确地回答健康研究中许多悬而未决的问题。”
在这项研究中,该团队发现了一个意想不到的发现。论文第一作者、博士生Tessa Schmachtel总结道,“我们在造血干细胞表面发现了一种名为PD-L2的蛋白,我们知道它通过阻止免疫防御细胞(T细胞)的激活和增殖以及抑制称为细胞因子的炎性物质的释放来抑制其免疫反应。”
9. Nature:重大进展!揭示毛细血管的剪切应力和一氧化氮是造血干细胞存活和免疫豁免的关键
DOI: 10.1038/s41586-024-08352-6
如今,一个国际研究团队在一项发表在Nature杂志上的研究中确定了一种使干细胞能够逃避免疫排斥的重要机制。他们揭示了组织中的特殊干细胞如何创造一个“免疫豁免的”环境,即体内干细胞在不受免疫系统攻击的情况下存活和发挥作用的区域。该团队由Kazuhiro Furuhashi和Joji Fujisaki领导。
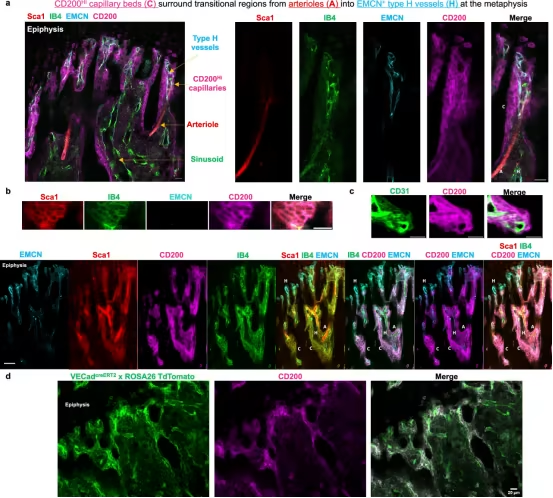
该团队专注于造血干细胞(HSC),它产生血细胞,通常被临床医生用来治疗白血病和遗传性血液疾病。能够移植这些细胞而不引发患者的免疫反应或需要服用大量的免疫抑制药物将是提高其有效性的有价值的方法。
该团队发现了一种独特的造血干细胞亚群,其表达高水平的一氧化氮(因而称为“NOhi-HSC”),并发现这些细胞还含有高水平的免疫调节受体CD200R,这是一种在免疫抑制和耐受中起关键作用的蛋白。
他们还发现,这些NOhi-HSC的存活取决于它们靠近具有独特发夹曲线形状的专门血管的位置。他们得出结论,这些毛细血管的弯曲性质会影响血流动力学,从而产生更大的剪切应力——血液沿血管壁移动的力。剪切应力通过增加一氧化氮水平来调节NOhi-HSC的行为,而这种水平通过调节细胞信号通路在NOhi-HSC的维持、存活和功能中起着重要作用。剪切应力和这些特殊毛细血管中更高的一氧化氮水平,可以创造出最佳的微环境。这些发现可能解释了NOhi-HSC如何在逃避免疫检测的同时保持存活和增殖。
10. Nat Immunol:新研究揭示FLI-1可激活静止的造血干细胞,有望开发出更有效的骨髓移植和基因疗法
DOI: 10.1038/s41590-025-02087-w
干细胞是未成熟的细胞,在几乎所有组织中都具有基本的再生作用。它们通常处于静止、缓慢分裂的状态,但在受伤后,它们可以通过切换到激活状态以便迅增殖殖并变成成熟的功能细胞,从而修复受损的组织。比如,造血干细胞大多驻留在骨髓中并保持静止状态,直到它们被刺激或“动员”进入血液。
威尔康奈尔医学院研究人员领导的一项发表在Nature Immunology杂志上的临床前研究发现,一种名为FLI-1的DNA转录调节蛋白在造血干细胞的再生过程中起着至关重要的作用。他们指出骨髓中静止的成体造血干细胞经动员后中短暂产生FLI-1会激活它们,使它们迅速扩大数量,并有更好的机会成功移植到新的宿主中。这一发现可能会导致更有效的骨髓移植和基因疗法。
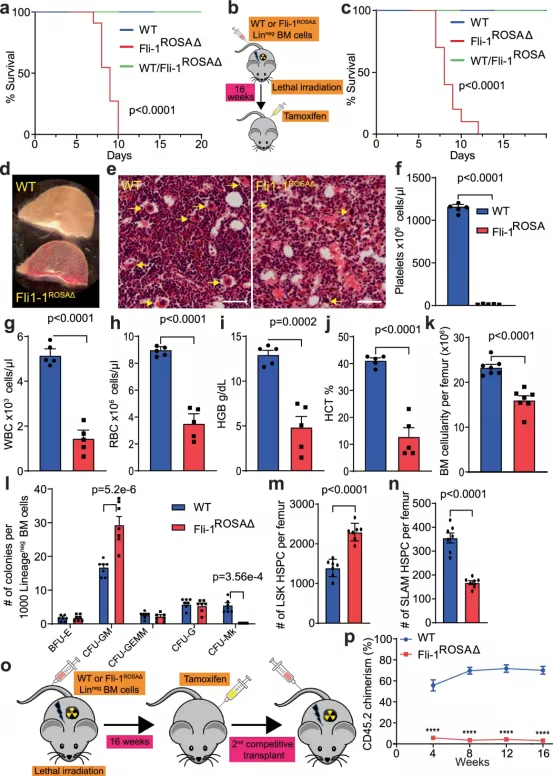
论文通讯作者、威尔康奈尔医学院遗传医学教授Shahin Rafii博士说,“我们在这项研究中概述的方法可以大大提高骨髓移植和靶向骨髓细胞的基因疗法的效率,特别是在供体的有活力的造血干细胞供应非常有限的情况下。”
在这项研究中,研究人员使用单细胞分析和其他技术来分析静止和激活的造血干细胞之间基因活性的差异。最终,他们将注意力集中在FLI-1上,这是一种可以控制数千个基因活性的转录因子蛋白。他们发现,它的缺失使造血干细胞保持静止,并在很大程度上关闭了这些细胞与周围骨髓细胞的相互作用,特别是组成血管的内皮细胞。
相比之下,FLI-1的活性恢复了造血干细胞与其微环境中的内皮细胞壁龛(也称为血管壁龛)的连接和共适应性。FLI-1将它们推入激活的再生状态,大大提高了它们在新宿主中扩展和恢复血细胞供应的能力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


