Science子刊:新研究揭示tau蛋白才是导致阿尔茨海默病的真正元凶
来源:本站原创 2020-01-12 16:39
2020年1月12日讯/生物谷BIOON/---在一项新的研究中,来自美国加州大学旧金山分校的研究人员发现对病理性tau蛋白“缠结物”进行大脑成像可提前一年或更长时间可靠地预测阿尔茨海默病患者中发生脑萎缩的位置。相比之下,数十年来一直是阿尔茨海默病研究和药物开发的重点的淀粉样蛋白“斑块”的位置,在预测随着这种疾病进展大脑损伤如何展现出来方面几乎没有用。相关研
2020年1月12日讯/生物谷BIOON/---在一项新的研究中,来自美国加州大学旧金山分校的研究人员发现对病理性tau蛋白“缠结物”进行大脑成像可提前一年或更长时间可靠地预测阿尔茨海默病患者中发生脑萎缩的位置。相比之下,数十年来一直是阿尔茨海默病研究和药物开发重点的淀粉样蛋白“斑块”的位置,在预测随着这种疾病的进展大脑损伤如何展现出来方面几乎没有用。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Prospective longitudinal atrophy in Alzheimer’s disease correlates with the intensity and topography of baseline tau-PET”。
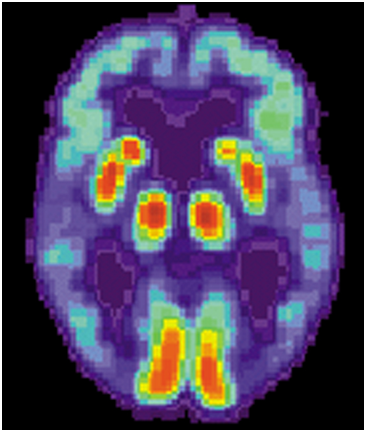
这些研究结果使得科学家们日益认识到tau比淀粉样蛋白更直接地导致阿尔茨海默病中的大脑变性,同时也证实了近期开发的基于tau的PET(正电子发射断层扫描)大脑成像技术(下称tau-PET)可加快针对阿尔茨海默病的临床试验并改善个性化患者治疗。
论文共同作者、加州大学旧金山分校PET成像计划负责人Gil Rabinovici博士说,“tau的扩散与来年大脑发生的变化之间的匹配非常惊人。tau-PET成像不仅预测我们将观察到多大的脑萎缩,而且还可以预测这种萎缩将发生的位置。这些预测比我们使用其他成像工具所能做的任何事情都要强大得多,而且进一步证实tau是这种疾病的主要驱动因素。”
随着基于淀粉样蛋白的疗法遭遇失败,人们对Tau的兴趣日益浓厚
研究阿尔茨海默病的科学家们长期以来一直在争论淀粉样蛋白斑块和tau蛋白缠结物的相对重要性。这两种错误折叠蛋白聚集物可在患者大脑的尸检研究中观察到,最早是由Alois Alzheimer在20世纪初首次发现的。几十年来,“淀粉样蛋白阵营(amyloid camp)”占据了主导地位,导致人们进行了多次备受瞩目的努力,以便利用靶向淀粉样蛋白的药物延缓阿尔茨海默病,但结果令人失望或喜忧参半。
许多科学家们如今正在重新研究tau蛋白,这种蛋白曾被简单地视为标记死亡细胞的“墓碑”而被人们所忽视,并正在研究tau是否真地可能是这种疾病的重要生物学驱动力。淀粉样蛋白广泛聚集在整个大脑中,这种聚集有时甚至会在没有症状的人的大脑中发生,相比之下,对阿尔茨海默病患者的尸检表明,tau恰好聚集在脑萎缩最严重的地方以及有助于解释患者症状差异的其他位置(比如,与语言相关的区域和与记忆相关的区域)。
论文通讯作者兼论文第一作者、Rabinovici实验室博士后研究员Renaud La Joie博士说,“没有人怀疑淀粉样蛋白在阿尔茨海默病中起作用,但是越来越多的关于tau的发现开始改变人们对导致这种疾病的真正原因的看法。不过,仅查看死后的大脑组织,就很难证实tau蛋白缠结物会导致大脑退化,反之则不会。我们的团队的主要目标之一是开发非侵入性大脑成像工具,以便使得我们能够观察tau蛋白在这种疾病早期堆积的位置是否预示着后来的脑退化。”
tau-PET扫描可预测患者在未来发生脑萎缩的位置
尽管早期有人怀疑tau可能无法在活体大脑中测量,但是科学家们最近开发了一种名为flortaucipir的可注射分子(目前正处于美国食品药品管理局的审查中),这种分子与错误折叠的tau结合,并发出可通过PET扫描捕获到的轻度放射性信号。
Rabinovici和加州大学伯克利分校的William Jagust博士是最早采用tau-PET成像技术来研究tau蛋白缠结物在正常衰老大脑中的分布和开展针对阿尔茨海默病患者的小型横断面研究的首批科学家之一。他们的这项新的研究代表了首次尝试测试阿尔茨海默病患者中的tau水平是否可以预测未来的脑退化。
La Joie通过加州大学伯克利分校记忆与衰老中心招募了32名患有早期阿尔茨海默病的参与者,并使用两种不同的示踪剂对所有的参与者进行PET扫描,以测量其大脑中的淀粉样蛋白和tau蛋白水平。在研究开始时以及以后的一到两年的随访中,这些参与者还接受了MRI扫描以测量其大脑的结构完整性。
这些研究人员发现在研究开始时这些参与者大脑中的总体tau水平可以预测到随访时(平均15个月后)会发生多少脑退化。此外,tau堆积的局部模式可预测在相同位置随后发生的脑萎缩,其准确率超过40%。相比之下,基线淀粉样蛋白PET扫描正确地预测了仅3%的在未来发生的脑退化。
La Joie说,“观察到tau蛋白的堆积可以预测脑退化的发生位置,这就支持了我们的假设,即tau是阿尔茨海默病中的神经变性的关键驱动因素。”
值得注意的是,PET扫描显示与年龄较大的参与者相比,年轻的参与者的大脑中的tau总体水平较高,并且基线tau水平与随后的脑萎缩之间存在更强的关联性。这些研究人员表示,这表明其他因素,比如其他的异常蛋白或血管损伤,可能在迟发性阿尔茨海默病中起更大作用。
预测脑萎缩的能力是一种“有价值的精准医疗工具”
这些研究结果使得人们更加希望,当前在加州大学伯克利分校记忆与衰老中心以及其他地方正在研究的靶向tau的药物可能会通过阻断这种疾病中神经变性的主要驱动因素而为患者提供临床益处。这些研究人员表示,与此同时,使用tau-PET预测未来脑退化的能力可能能够进行更为个性化的痴呆护理并加快正在进行的临床试验。
Rabinovici说,“人们听到阿尔茨海默病确诊时想要知道的事情之一就是未来对自己或亲人的影响。这是记忆的长期衰退,还是快速进展到痴呆?患者多长时间才能够独立生活?他们会失去说话或独自走动的能力吗?这些是我们目前无法回答的问题。如今,这种成像工具首次使得我们能够通过揭示导致这种疾病的生物学过程让患者对将要发生的事情有所了解。”
Rabinovici和他的团队还预计,基于tau-PET成像预测未来脑萎缩的能力将使得针对阿尔茨海默病的临床试验能够快速评估实验性药物是否可以改变针对单个患者的预测性特定轨迹,这一点在目前是无法实现的,这是因为这种疾病在不同个体之间的进展变化很大。由此获得的新见解就可能能够调整药物剂量,或者如果第一种药物不影响tau水平或不改变患者的预测性脑萎缩轨迹,那么就可能改用到其他的实验性化合物。
Rabinovici说:“tau-PET可能是未来临床试验中的一种极为有价值的精准医疗工具。能够灵敏地跟踪活的患者体内tau蛋白积累的能力将使得临床研究人员首次寻求可以减慢甚至阻止针对每个患者预测的特定脑萎缩模式的药物。”(生物谷 Bioon.com)
参考资料:
1.Renaud La Joie et al. Prospective longitudinal atrophy in Alzheimer's disease correlates with the intensity and topography of baseline tau-PET. Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aau5732.
2.Alzheimer 'tau' protein far surpasses amyloid in predicting toll on brain tissue
https://medicalxpress.com/news/2020-01-alzheimer-tau-protein-surpasses-amyloid.html

对阿尔茨海默病患者的大脑进行PET扫描,图片来自public domain。
这些研究结果使得科学家们日益认识到tau比淀粉样蛋白更直接地导致阿尔茨海默病中的大脑变性,同时也证实了近期开发的基于tau的PET(正电子发射断层扫描)大脑成像技术(下称tau-PET)可加快针对阿尔茨海默病的临床试验并改善个性化患者治疗。
论文共同作者、加州大学旧金山分校PET成像计划负责人Gil Rabinovici博士说,“tau的扩散与来年大脑发生的变化之间的匹配非常惊人。tau-PET成像不仅预测我们将观察到多大的脑萎缩,而且还可以预测这种萎缩将发生的位置。这些预测比我们使用其他成像工具所能做的任何事情都要强大得多,而且进一步证实tau是这种疾病的主要驱动因素。”
随着基于淀粉样蛋白的疗法遭遇失败,人们对Tau的兴趣日益浓厚
研究阿尔茨海默病的科学家们长期以来一直在争论淀粉样蛋白斑块和tau蛋白缠结物的相对重要性。这两种错误折叠蛋白聚集物可在患者大脑的尸检研究中观察到,最早是由Alois Alzheimer在20世纪初首次发现的。几十年来,“淀粉样蛋白阵营(amyloid camp)”占据了主导地位,导致人们进行了多次备受瞩目的努力,以便利用靶向淀粉样蛋白的药物延缓阿尔茨海默病,但结果令人失望或喜忧参半。
许多科学家们如今正在重新研究tau蛋白,这种蛋白曾被简单地视为标记死亡细胞的“墓碑”而被人们所忽视,并正在研究tau是否真地可能是这种疾病的重要生物学驱动力。淀粉样蛋白广泛聚集在整个大脑中,这种聚集有时甚至会在没有症状的人的大脑中发生,相比之下,对阿尔茨海默病患者的尸检表明,tau恰好聚集在脑萎缩最严重的地方以及有助于解释患者症状差异的其他位置(比如,与语言相关的区域和与记忆相关的区域)。
论文通讯作者兼论文第一作者、Rabinovici实验室博士后研究员Renaud La Joie博士说,“没有人怀疑淀粉样蛋白在阿尔茨海默病中起作用,但是越来越多的关于tau的发现开始改变人们对导致这种疾病的真正原因的看法。不过,仅查看死后的大脑组织,就很难证实tau蛋白缠结物会导致大脑退化,反之则不会。我们的团队的主要目标之一是开发非侵入性大脑成像工具,以便使得我们能够观察tau蛋白在这种疾病早期堆积的位置是否预示着后来的脑退化。”
tau-PET扫描可预测患者在未来发生脑萎缩的位置
尽管早期有人怀疑tau可能无法在活体大脑中测量,但是科学家们最近开发了一种名为flortaucipir的可注射分子(目前正处于美国食品药品管理局的审查中),这种分子与错误折叠的tau结合,并发出可通过PET扫描捕获到的轻度放射性信号。
Rabinovici和加州大学伯克利分校的William Jagust博士是最早采用tau-PET成像技术来研究tau蛋白缠结物在正常衰老大脑中的分布和开展针对阿尔茨海默病患者的小型横断面研究的首批科学家之一。他们的这项新的研究代表了首次尝试测试阿尔茨海默病患者中的tau水平是否可以预测未来的脑退化。
La Joie通过加州大学伯克利分校记忆与衰老中心招募了32名患有早期阿尔茨海默病的参与者,并使用两种不同的示踪剂对所有的参与者进行PET扫描,以测量其大脑中的淀粉样蛋白和tau蛋白水平。在研究开始时以及以后的一到两年的随访中,这些参与者还接受了MRI扫描以测量其大脑的结构完整性。
这些研究人员发现在研究开始时这些参与者大脑中的总体tau水平可以预测到随访时(平均15个月后)会发生多少脑退化。此外,tau堆积的局部模式可预测在相同位置随后发生的脑萎缩,其准确率超过40%。相比之下,基线淀粉样蛋白PET扫描正确地预测了仅3%的在未来发生的脑退化。
La Joie说,“观察到tau蛋白的堆积可以预测脑退化的发生位置,这就支持了我们的假设,即tau是阿尔茨海默病中的神经变性的关键驱动因素。”
值得注意的是,PET扫描显示与年龄较大的参与者相比,年轻的参与者的大脑中的tau总体水平较高,并且基线tau水平与随后的脑萎缩之间存在更强的关联性。这些研究人员表示,这表明其他因素,比如其他的异常蛋白或血管损伤,可能在迟发性阿尔茨海默病中起更大作用。
预测脑萎缩的能力是一种“有价值的精准医疗工具”
这些研究结果使得人们更加希望,当前在加州大学伯克利分校记忆与衰老中心以及其他地方正在研究的靶向tau的药物可能会通过阻断这种疾病中神经变性的主要驱动因素而为患者提供临床益处。这些研究人员表示,与此同时,使用tau-PET预测未来脑退化的能力可能能够进行更为个性化的痴呆护理并加快正在进行的临床试验。
Rabinovici说,“人们听到阿尔茨海默病确诊时想要知道的事情之一就是未来对自己或亲人的影响。这是记忆的长期衰退,还是快速进展到痴呆?患者多长时间才能够独立生活?他们会失去说话或独自走动的能力吗?这些是我们目前无法回答的问题。如今,这种成像工具首次使得我们能够通过揭示导致这种疾病的生物学过程让患者对将要发生的事情有所了解。”
Rabinovici和他的团队还预计,基于tau-PET成像预测未来脑萎缩的能力将使得针对阿尔茨海默病的临床试验能够快速评估实验性药物是否可以改变针对单个患者的预测性特定轨迹,这一点在目前是无法实现的,这是因为这种疾病在不同个体之间的进展变化很大。由此获得的新见解就可能能够调整药物剂量,或者如果第一种药物不影响tau水平或不改变患者的预测性脑萎缩轨迹,那么就可能改用到其他的实验性化合物。
Rabinovici说:“tau-PET可能是未来临床试验中的一种极为有价值的精准医疗工具。能够灵敏地跟踪活的患者体内tau蛋白积累的能力将使得临床研究人员首次寻求可以减慢甚至阻止针对每个患者预测的特定脑萎缩模式的药物。”(生物谷 Bioon.com)
参考资料:
1.Renaud La Joie et al. Prospective longitudinal atrophy in Alzheimer's disease correlates with the intensity and topography of baseline tau-PET. Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aau5732.
2.Alzheimer 'tau' protein far surpasses amyloid in predicting toll on brain tissue
https://medicalxpress.com/news/2020-01-alzheimer-tau-protein-surpasses-amyloid.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


