细胞和基因疗法现状及其市场展望
来源:本站原创 2021-01-02 23:55
细胞疗法是指将正常的或生物工程改造过的人体细胞移植或输入患者体内,新输入的细胞可以替代受损细胞、或者具有更强的免疫杀伤功能,从而达到治疗疾病的目的。通常而言,细胞疗法主要包括肿瘤细胞免疫疗法和干细胞疗法两大类。细胞疗法在治疗癌症、血液病、心血管病、糖尿病、老年痴呆症等方面前景广阔。
细胞疗法是指将正常的或生物工程改造过的人体细胞移植或输入患者体内,新输入的细胞可以替代受损细胞、或者具有更强的免疫杀伤功能,从而达到治疗疾病的目的。通常而言,细胞疗法主要包括肿瘤细胞免疫疗法和干细胞疗法两大类。细胞疗法在治疗癌症、血液病、心血管病、糖尿病、老年痴呆症等方面前景广阔。
肿瘤细胞免疫疗法是指获取来自患者体内的免疫细胞,然后进行体外培养和扩增,再回输到病人体内,来激发以及增强机体的自身免疫功能以治疗肿瘤,主要包括过继细胞免疫疗法、肿瘤疫苗、非特异性免疫刺激和免疫检查点阻断疗法,其中过继细胞免疫疗法包括肿瘤浸润淋巴细胞(TIL)疗法、TCR-T细胞疗法、CAR-T细胞疗法、淋巴因子活化杀伤细胞(LAK)疗法、细胞因子诱导杀伤细胞(CIK)疗法、树突细胞疗法和自然杀伤细胞(NK)疗法。干细胞疗法是利用干细胞的自我更新能力和分化潜能,用于治疗血液系统疾病、神经系统疾病、心血管疾病、肝脏疾病和内分泌疾病等疾病。

来自健康供者免疫系统的人T细胞的扫描电镜图,图片来自NIAID。
在2021年,科学家们在基因疗法和细胞疗法领域取得重大的进展,让我们一起看看这个领域在这一年里取得的重要进展。
1.细胞疗法新进展
(1)揭示CAR-T细胞疗法的罕见副作用
2021年12月,Oliver Van Oekelen等人首次报告在完成靶向BCMA的CAR-T细胞(BCMA CAR-T)疗法的一个疗程三个多月后,一名多发性骨髓瘤患者开始出现类似帕金森病的进行性神经系统症状,包括震颤以及手写和步态的改变。在该患者的大脑基底神经节中发现了BCMA蛋白存在的证据,并在该区域发现了瘢痕,这表明BCMA CAR-T细胞至少在一部分患者中可以穿过血脑屏障,引起进行性神经认知和运动障碍。因此,CAR-T细胞疗法虽然对多发性骨髓瘤有效,但需要密切监测其神经毒性[1]。
(2)探究T细胞衰竭的原因
CAR-T细胞对形成实体瘤的癌症没有像治疗血癌那样有效,这是因为T细胞接触其靶抗原的时间过长(大约几周)时,就会触发衰竭,它们在实体瘤的情况下通常是这样。2021年12月,Charly R. Good等人设计出靶向一种称为间皮素(mesothelin)的细胞标志物的CAR-T细胞,并让这些T细胞暴露于表达间皮素的胰腺肿瘤细胞4周。在4周后,CAR-T细胞表现出典型的衰竭迹象,而且在来自癌症患者的处于衰竭状态的CAR-T细胞中发现了T细胞向自然杀伤细胞(NK细胞)转变的迹象。他们观察到CAR-T细胞衰竭伴随着两种蛋白ID3和SOX4水平的激增,这两种蛋白作为免疫细胞中大量基因的主开关发挥作用。沉默这两种明显的T细胞衰竭开关使处于衰竭状态的CAR-T细胞即使在长期暴露于肿瘤细胞后仍能保持大部分的肿瘤杀伤力[2]。

人淋巴细胞的电子显微图,图片来自Dr. Triche/National Cancer Institute。
2021年11月,Brooke Prinzing等人确定了一种表观遗传程序如何驱动T细胞衰竭。通过评估不同实体瘤模型中靶向一系列肿瘤抗原的人类CAR-T细胞,他们发现确实敲除DNMT3A基因普遍保留了它们攻击癌细胞的能力,不论它们靶向哪种肿瘤类型或抗原。这突出了DNMT3A在控制人类CAR-T细胞功能方面的核心作用。这些发现为在未来开展早期阶段的临床测试奠定基础[4]。
(3)提高CAR-T细胞的疗效
CAR-T细胞通常靶向癌细胞表面上的抗原,无法靶向癌细胞内的抗原。2021年10月,Mark Yarmarkovich等人针对这一点开发出一种靶向肿瘤细胞内对肿瘤的生长和生存至关重要的蛋白的新型癌症治疗方法。利用大型数据集和先进的计算方法的力量,他们能够识别出呈现在肿瘤细胞表面上的肽,并且能够用“以肽为中心(peptide-centric)”的嵌合抗原受体(peptide-centric chimeric antigen receptor, PC-CAR)T细胞(PC-CAR T细胞)靶向它们,其中PC-CAR T细胞是一类新的经过基因改造的T细胞,可刺激免疫反应,消除肿瘤。这一发现为用免疫疗法治疗更广泛的癌症以及在更大比例的人群中应用每种疗法打开了大门[5]。
T细胞,图片来自CC0 Public Domain。
2021年9月,Koichi Hirabayashi等人发现一种新开发的使用经过基因改造的T细胞来锁定和攻击癌细胞上的两种抗原的CAR-T细胞免疫疗法,对植入人类神经母细胞瘤组织的小鼠非常有效。这种双重靶向限制了肿瘤的重新生长,并防止神经母细胞瘤细胞躲避这些攻击性的T细胞[7]。
2021年8月,Lexus R. Johnson等人发现RN7SL1可以改善CAR-T细胞本身的功能。表达RN7SL1的CAR-T细胞有额外的优势,即持续时间更长,能更好地浸润肿瘤,更少地出现功能衰竭,并能保持更大的抗肿瘤功能[8]。与此同时,Yun Qu等人通过对CAR-T细胞进行基因改造,使之也释放出更多的腺苷脱氨酶(adenosine deaminase, ADA),肿瘤的免疫抑制微环境被打破。这有效地减少了T细胞衰竭,从而帮助这些细胞保持其杀癌能力[9]。
经过基因改造的Pmel-1 T细胞在高肿瘤负荷环境下增强过继性细胞治疗。图片来自Nature Biomedical Engineering, 2021, doi:10.1038/s41551-021-00781-2。
2021年3月,Yue Liu等人设计了一种合成T细胞受体(Synthetic T cell receptor)和一种抗原受体(Antigen Receptor),经过基因改造后表达这两种受体的T细胞(即STAR-T细胞)结合了CAR-T细胞的特征,但增加了内部的信号转导机制来模拟天然的T细胞。在多种小鼠模型中,相比于CAR-T细胞,STAR-T细胞能够更好地控制多种实体瘤类型而且没有出现功能衰竭[12]。
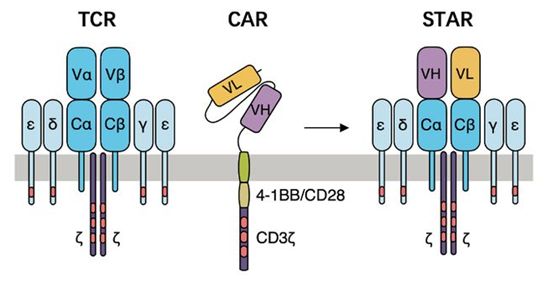
TCR、CAR和STAR受体的结构示意图,图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abb5191。
2021年1月,Max Jan等人利用常用的抗癌药物来那度胺为CAR-T细胞构建出“ON”开关和“OFF”开关来调节这些细胞的活性。他们发现给予常用的抗癌药物来那度胺可控制携带“ON”开关的CAR-T细胞和携带“OFF”开关的CAR-T细胞的效应功能。在未来,人们有望通过这种新的可切换的细胞疗法治疗疾病,同时减少毒性副作用[14]。
2.基因疗法新进展
(1)基因疗法有望治疗一系列疾病
2021年12月,两项发表在国际杂志NEJM期刊上的研究报告了一种名为LentiGlobin的基因疗法能使得接受一次性手术治疗的镰状细胞疾病患者体内的血液功能恢复正常,如今这些患者都能够产生稳定数量的含有健康血红蛋白的正常红细胞,此外,这些患者也并未遭受镰状细胞疾病所带来的严重疼痛发作。虽然这两项研究都揭示了LentiGlobin疗法在治疗镰状细胞疾病上的潜力和治疗效果,但还需阐明它可能带来的潜在风险[15][16]。
2021年11月,一项新的1/2期临床研究报告了一种治疗甲型血友病(hemophilia A,也称为VIII因子缺乏症)的新型基因疗法---注射SPK-8011(一种新型重组AAV载体,经改造后在宿主肝细胞中产生FVIII)---导致患上这种疾病的患者所缺乏的凝血因子在体内持续表达,从而减少了---在某些情形下完全消除了---痛苦的、可能危及生命的出血事件。这是首次证实甲型血友病患者在接受基因治疗后凝血因子VIII水平保持稳定[17]。
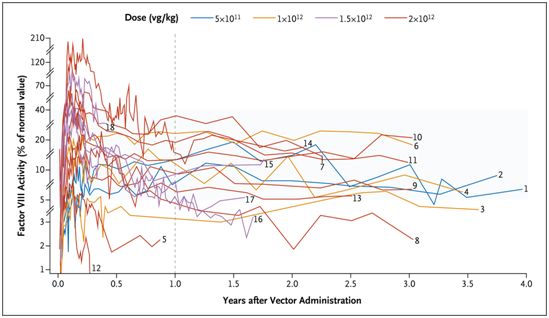
18例参与者输入SPK-8011后的凝血因子Ⅷ活性,图片来自NEJM, 2021, doi:10.1056/NEJMoa2104205。
2021年7月,Xinzheng Guo等人通过使用CaMKII活性的抗体标记,发现每当视网膜神经节细胞暴露于毒素或视神经因挤压伤出现创伤时,CaMKII通路信号就会受到损害,这表明CaMKII活性和视网膜神经节细胞的生存之间存在关联。在寻找干预的方法时,他们发现用基因疗法激活CaMKII通路被证明对视网膜神经节细胞有保护作用。在遭受毒性刺激(对这些细胞造成快速损害)之前和遭受视神经挤压伤(造成较慢的损害)之后,对小鼠进行基因治疗,增加了CaMKII的活性,有力地保护了视网膜神经节细胞[19]。
2021年2月,Aneal Khan等人在一项单臂试验性先导研究(NCT02800070)中,对5名患有1型(经典)法布里病的成年男性患者采用了自体慢病毒介导的CD34+造血干/祖细胞的基因疗法,这些细胞经改造后可表达α-galA。结果显示,并无由实验药物引起的严重的不良事件(AE)。所有患者在一周内产生的α-galA均接近正常水平。该研究揭示了基因治疗可能是法布里病患者的一个有效的治疗选择,但需要更多的研究来验证[20]。
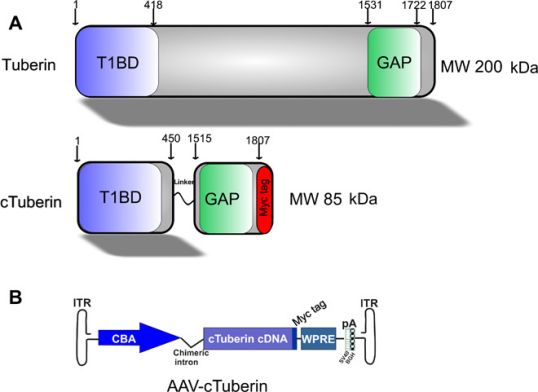
结节蛋白和cTuberin蛋白的示意图,图片来自Science Advances, 2021, doi:10.1126/sciadv.abb1703。
(2)新的递送平台
2021年9月,Mohammadsharif Tabebordbar等人开发出一个新的腺相关病毒(AAV)家族,它们改善了对肌肉组织的靶向性,这对肌肉疾病患者可能更安全、更有效。这组病毒载体(他们称之为MyoAAV)到达肌肉的效率比目前临床试验中使用的病毒载体高10倍以上,并且在很大程度上避开了肝脏。他们发现,由于这种效率的提高,MyoAAV可用于递送治疗性基因,其剂量比其他研究和临床试验中使用的病毒载体低约100至250倍,有可能减少肝脏损伤和其他严重副作用的风险[22]。
完全组装好的SEND保护囊从细胞中释放出来,经收集后可用于基因疗法,图片来自McGovern Institute。
(3)利用基因编辑开展基因疗法
2021年4月,F. Chemello等人成功地采用了一种新型的基因疗法来治疗杜兴氏肌肉萎缩症(Duchenne muscular dystrophy, DMD,也译为杜兴氏肌肉营养不良症)小鼠,利用基于CRISPR-Cas9的工具来恢复在许多DMD患者中缺失的一大部分dystrophin蛋白。这种方法可能会开发用于治疗DMD的方法,并为其他遗传性疾病的治疗提供参考[24]。
2021年1月,Luke W. Koblan等人利用一种基于腺相关病毒(AAV)的载体将编码用于碱基编辑的酶递送到患有早衰症的小鼠体内,接受治疗的小鼠就能避免这种疾病的发生。借助于这种技术,人们最终有望校正一系列人类遗传性疾病,包括儿童早衰症[25]。

twinPE介导CCR5的序列替换,图片来自Nature Biotechnology, 2021, doi:10.1038/s41587-021-01133-w。
(4)控制治疗基因表达水平
2021年7月,Alex Mas Monteys等人开发出一种“调光开关”系统("dimmer switch" system),该系统基于一种利用口服药物小分子的替代性RNA剪接技术,可以控制基因疗法载体所表达的蛋白水平;它可使基因疗法载体中的RNA就处于无活性状态,药物小分子的加入可促使所携带的RNA发生剪接而形成它的活性形式[27]。
3.基因疗法和细胞疗法市场展望
在全球范围内,细胞疗法和基因疗法已经和正在不断改变人类治疗一系列疾病的方式。至2019年底,全球共推出27种以上的细胞疗法/基因疗法产品,将近1000家公司从事这方面的研发和商业化,全球细胞疗法/基因疗法有望在2021年达到200亿美元。
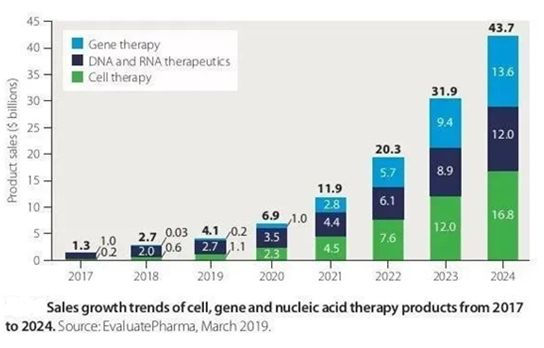
根据Evaluate Pharma预测, 细胞疗法、基因疗法以及核酸疗法的全球市场规模从2017年的10亿美元,将增长到2024年的440亿美元,复合年增长率高达65%。有了这样的市场价值预估,在过去的几年中,基因治疗和已经成为并且将继续成为最受关注的制药领域之一[28]。
在细胞疗法中,CAR-T细胞疗法、TCR-T细胞疗法和干细胞疗法发展前景和市场潜力巨大。就CAR-T细胞疗法而言,全球已有6款CAR-T细胞疗法上市,按上市时间排序,分别为诺华的Kymriah、吉利德的Yescarta和Tecartus、百时美(BMS)的Breyanzi和Abecma以及中国复星凯特的CAR-T细胞治疗产品益基利仑赛注射液(又称阿基仑赛注射液,商品名:奕凯达)。其中,前四种细胞疗法都是靶向CD19,用于治疗弥漫大B细胞淋巴瘤、B细胞急性淋巴细胞白血病、套细胞淋巴瘤;2021年3月上市的Abecma则是靶向BCMA,用于治疗多发性骨髓瘤。用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。2021年6月上市的奕凯达用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。
随着基因治疗发展,基因治疗产品采用的载体安全性和有效性逐渐提升,截至2019年底,全球上市基因治疗产品已达20余种。美国FDA批准上市的基因治疗产品有:Vitravene、Macugen、Rexin-G、Kynamro、Imlygic、Exondys51、Spinraza、Defibrotide、Luxturna、Patisiran、Zolgensma、Kymriah和Yescarta;欧盟批准上市的基因治疗产品有Vitravene、Glybera、Spinraza、Defibrotide、Luxturna、Patisiran、Strimvelis和Zalmoxis;中国批准上市的基因治疗产品有Gendicine和Oncorine;俄罗斯批准上市的基因治疗产品有Neovasculgen;韩国批准上市的基因治疗产品有Invossa[29]。
在未来,随着在分子生物学、基因、蛋白和组学等不同领域取得的新突破,科学家们将会开发越来越多的细胞治疗产品和基因治疗产品来治疗HIV感染、癌症、血液系统疾病、神经系统疾病和遗传疾病等一系列疾病。(生物谷 Bioon.com)
参考文献:
1.Oliver Van Oekelen et al. Neurocognitive and hypokinetic movement disorder with features of parkinsonism after BCMA-targeting CAR-T cell therapy. Nature Medicine, 2021, doi:10.1038/s41591-021-01564-7.
2. Charly R. Good et al. An NK-like CAR T cell transition in CAR T cell dysfunction. Cell, 2021, doi:10.1016/j.cell.2021.11.016.
3.Caitlin C. Zebley et al. CD19-CAR T cells undergo exhaustion DNA methylation programming in patients with acute lymphoblastic leukemia. Cell Reports, 202, doi:10.1016/j.celrep.2021.110079.
4.Brooke Prinzing et al. Deleting DNMT3A in CAR T cells prevents exhaustion and enhances antitumor activity. Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abh0272.
5. Mark Yarmarkovich et al. Cross-HLA targeting of intracellular oncoproteins with peptide-centric CARs. Nature, 2021, doi:10.1038/s41586-021-04061-6.
6. Edikan A. Ogunnaike et al. Fibrin gel enhances the antitumor effects of chimeric antigen receptor T cells in glioblastoma. Science Advances, 2021, doi:10.1126/sciadv.abg5841.
7. Koichi Hirabayashi et al. Dual-targeting CAR-T cells with optimal co-stimulation and metabolic fitness enhance antitumor activity and prevent escape in solid tumors. Nature Cancer, 2021, doi:10.1038/s43018-021-00244-2.
8. Lexus R. Johnson et al. The immunostimulatory RNA RN7SL1 enables CAR-T cells to enhance autonomous and endogenous immune function. Cell, 2021, doi:10.1016/j.cell.2021.08.004.
9. Yun Qu et al. Adenosine Deaminase 1 Overexpression Enhances the Antitumor Efficacy of Chimeric Antigen Receptor-Engineered T Cells. Human Gene Therapy, 2021, doi:10.1089/hum.2021.050.
10. Ian C. Miller et al. Enhanced intratumoural activity of CAR T cells engineered to produce immunomodulators under photothermal control. Nature Biomedical Engineering, 2021, doi:10.1038/s41551-021-00781-2.
11. Yiqian Wu et al. Control of the activity of CAR-T cells within tumours via focused ultrasound. Nature Biomedical Engineering, 2021, doi:10.1038/s41551-021-00779-w.
12. Yue Liu et al. Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors. Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abb5191.
13. Rogelio A. Hernandez-Lopez et al. T cell circuits that sense antigen density with an ultrasensitive threshold. Science, 2021, doi:10.1126/science.abc1855.
14. Max Jan et al. Reversible ON- and OFF-switch chimeric antigen receptors controlled by lenalidomide. Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abb6295.
15. Sunita Goyal et al. Acute Myeloid Leukemia Case after Gene Therapy for Sickle Cell Disease. New England Journal of Medicine, 2021, doi:10.1056/NEJMoa2109167.
16.Julie Kanter et al. Biologic and Clinical Efficacy of LentiGlobin for Sickle Cell Disease. New England Journal of Medicine, 2021, doi:10.1056/NEJMoa2117175.
17. Lindsey A. George et al. Multiyear Factor VIII Expression After AAV Gene Transfer for Hemophilia A. NEJM, 2021, doi:10.1056/NEJMoa2104205.
18. Patricia González-Rodríguez et al. Disruption of mitochondrial complex I induces progressive parkinsonism. Nature, 2021, doi:10.1038/s41586-021-04059-0.
19. Xinzheng Guo et al. Xinzheng Guo et al. Preservation of vision after CaMKII-mediated protection of retinal ganglion cells. Cell, 2021, doi:10.1016/j.cell.2021.06.031.
20. Aneal Khan et al. Lentivirus-mediated gene therapy for Fabry disease. Nature Communications, 2021, doi:10.1038/s41467-021-21371-5.
21. Pike-See Cheah et al. Gene therapy for tuberous sclerosis complex type 2 in a mouse model by delivery of AAV9 encoding a condensed form of tuberin. Science Advances, 2021, doi:10.1126/sciadv.abb1703.
22. Mohammadsharif Tabebordbar et al. Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species. Cell, 2021, doi:10.1016/j.cell.2021.08.028.
23. Michael Segel et al. Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery. Science, 2021, doi:10.1126/science.abg6155.
24. F. Chemello et al. Precise correction of Duchenne muscular dystrophy exon deletion mutations by base and prime editing. Science Advances, 2021, doi:10.1126/sciadv.abg4910.
25. Luke W. Koblan et al. In vivo base editing rescues Hutchinson–Gilford progeria syndrome in mice. Nature, 2021, doi:10.1038/s41586-020-03086-7.
26. Andrew V. Anzalone et al. Programmable deletion, replacement, integration and inversion of large DNA sequences with twin prime editing. Nature Biotechnology, 2021, doi:10.1038/s41587-021-01133-w.
27. Alex Mas Monteys et al. Regulated control of gene therapies by drug-induced splicing. Nature, 2021, doi:10.1038/s41586-021-03770-2.
28.Next-generation therapeutics: cell and gene therapy gathers pace
https://www.nature.com/articles/d43747-020-00715-y
29.Gene Therapy Arrives
https://www.nature.com/articles/d41586-019-03716-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


