深入解读代谢信号的产生如何有效遏制癌细胞发生转移
来源:本站原创 2019-07-17 22:00
2019年7月18日 讯 /生物谷BIOON/ --当肿瘤细胞从机体原发性位点侵袭到远端器官时,癌症往往就会具有致命性,这一过程称之为癌症转移,要发生这一复杂的事件,细胞必须侵入周围的组织中,进入血液并在另一个位点定植,从而开始形成肿瘤转移灶,癌症转移早期阶段的多个步骤(包括细胞迁移)常常会被一种称之为上皮间质转化(EMT,epithelial mesenchymal transition)的正常
2019年7月18日 讯 /生物谷BIOON/ --当肿瘤细胞从机体原发性位点侵袭到远端器官时,癌症往往就会具有致命性,这一过程称之为癌症转移,要发生这一复杂的事件,细胞必须侵入周围的组织中,进入血液并在另一个位点定植,从而开始形成肿瘤转移灶,癌症转移早期阶段的多个步骤(包括细胞迁移)常常会被一种称之为上皮间质转化(EMT,epithelial mesenchymal transition)的正常发育程序的异常激活所诱导,在此过程中,分布在机体表面的上皮细胞就会具有间质细胞的特征,同时其还具有一定的迁移特性,刊登在Nature杂志上的一篇研究报告中,研究者Wang等人就鉴别出了此前研究人员并不清楚的一种机制,即在细胞代谢过程中产生的特殊分子如何抑制EMT的诱导,并抑制小鼠机体中肺癌的转移。
图片来源:Wang et al.
在细胞代谢过程中所形成的分子在肿瘤细胞的生存、增殖和转移过程扮演着非常关键的角色,癌细胞的营养摄取水平高于正常水平,同时其代谢通路也会发生改变,这些特性会确保肿瘤常常会制造出其自身生长所需的代谢产物;当肿瘤细胞迁移到血液中时其会经历细胞压力,这主要表现为活性氧分子水平的增加,而且针对压力的代谢变化也会促进癌症发生转移,但目前研究人员并不清楚是否代谢通路会影响癌症转移的其它方面。
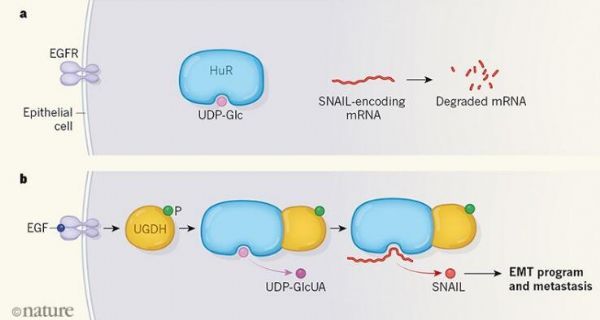
为了深入调查,研究者Wang及其同事通过对起源于上皮细胞的人类肺癌细胞进行研究,阻断了癌细胞中111种代谢酶类的表达,在体外对这些细胞进行培养,研究者发现,抑制UGDH酶的产生或会损伤细胞的迁移能力,UGDH能将UDP-葡萄糖(UDP-Glc)转化为UDP-葡糖醛酸(UDP-GlcUA),其是制造诸如透明质酸等多糖分子所必须的,透明质酸是上皮细胞所处的组织的细胞外基质材料的主要组分,透明质酸能够激活细胞表面的受体从而开启EMT过程,而且其在肿瘤细胞中的积累通常被认为与患者较差的临床预后直接相关。
更有意思的是,当研究者抑制UGDH的表达时,细胞的迁移或许并不会受到UDP-GlcUA或透明质酸水平下降的影响,但却会受到UDP-Glc积累的损伤;由于癌细胞中EMT与其迁移增加直接相关,因此研究人员就想深入研究阐明是否UDP-Glc对于诱导EMT具有一定的效应,研究者发现,剔除UGDH,同时UDP-Glc的积累会伴随编码SNAIL(转录因子)的信使RNA稳定性的下降,转录因子SNAIL能够调节与EMT相关的基因的表达,当研究者对癌细胞进行工程化改造使得SNAIL产生时,他们发现,即便UGDH被剔除了,细胞仍然会发生迁移,相关研究结果表明,UGDH或许会通过影响SNAIL的产生,在细胞迁移过程中发挥一定的作用(上图)。
图片来源:npr.org
那么诸如UGDH这样的代谢酶是如何影响mRNA的稳定性的呢?随后研究者重点对蛋白质HuR进行了研究,HuR能结合并稳定mRNA靶点,包括编码SNAIL转录子,研究者发现,UDP-Glc能直接与HuR结合,从而抑制蛋白质与编码SNAIL的mRNA相互作用,随后他们对HuR的一种形式进行工程化改造使其携带氨基酸残基突变,从而就能预测其与UDP-Glc的结合,相比拥有野生型HuR的细胞而言,携带HuR突变体的细胞更易于在小鼠机体中形成转移特性并发生迁移。
UDP-Glc与HuR之间的相互作用能够抑制HuR发挥作用从而诱导促进癌症转移的细胞程序,当研究者将肿瘤细胞注入小鼠机体中并给予其UDP-Glc时,他们发现,接受UDP-Glc的小鼠相比未接受UDP-Glc的小鼠而言癌症转移的发生明显减少了。相关的研究结果或许对于研究人类癌症具有一定意义,在肺癌中,受体EGFR通常会被突变所激活,研究者发现,通过受体所介导的信号增加或许与人类肺癌细胞中编码SNAIL的mRNA稳定性增加有关,而且EGFR的激活也会诱发UGDH中氨基酸残基酪氨酸473位点(Y473)的磷酸化,从而就会诱导HuR和UGDH之间发生物理性的相互作用。
研究者Wang及同事推测,磷酸化的UGDH能够绑定到HuR中促进UDP-Glc向UDP-GlcUA的局部转化,从而减缓UDP-Glc对HuR和编码SNAIL的mRNA之间相互作用的抑制,同事还能促进SNAIL的积累(图1)。当研究者对人类肺癌细胞工程化改造使其表达缺少酪氨酸残基(473位点)的UGDH时,他们发现,相比携带野生型UGDH的细胞而言,这类细胞的转移水平在小鼠中明显下降了,研究者Wang说道,在肺癌患者机体中,UGDH的Y473的磷酸化在转移性癌细胞中往往更为常见(相比原发性肿瘤),而且这种磷酸化作用常常与患者较差的临床预后直接相关。
图片来源:thoughtco.com
如今,越来越多的研究证据表明,代谢产物会影响基因表达的程序,而最好的例子就是代谢产物能为代谢酶提供基质来调节基因的表达,而这是通过修饰吸附在DNA上的化学基团或与DNA相结合的组蛋白来实现的;然而,UDP-Glc或能通过物理性地抑制蛋白质和mRNA之间的相互作用来影响基因的表达。那么UDP-Glc如何特异性地影响HuR与编码SNAIL的mRNA之间的相互作用(并不会损伤其与其它mRNAs之间的相互作用)依然是一个需要深入探讨的问题。考虑到SNAIL表达、EMT和细胞外基质之间的练习,研究人员推测,将SNAIL的产生与产生透明质酸的代谢产物相连接或许能作为一种有效的手段来协调细胞代谢和蛋白质产生(促进癌细胞转移)之间的改变。
因此,与通过代谢酶中与癌症相关突变的积累并促进肿瘤进展的代谢产物相反,UDP-Glc或能抑制癌症不断进展,这一研究发现或能扩展我们对代谢产物如何影响癌症的认知,尽管目前研究人员发现癌细胞的代谢特性不同于正常细胞,但我们仅仅刚开始认识到肿瘤生长过程中代谢改变的复杂特性。(生物谷Bioon.com)
参考资料:
【1】Dongre A, Weinberg RA. New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer. Nat Rev Mol Cell Biol. 2019 Feb;20(2):69-84. doi: 10.1038/s41580-018-0080-4.
【2】Xiongjun Wang, Ruilong Liu, Wencheng Zhu, et al. UDP-glucose accelerates SNAI1 mRNA decay and impairs lung cancer metastasis, Nature (2019) doi:10.1038/s41586-019-1340-y
【3】DeBerardinis RJ, Chandel NS. Fundamentals of cancer metabolism. Sci Adv. 2016 May 27;2(5):e1600200. doi: 10.1126/sciadv.1600200. eCollection 2016 May.
【4】Piskounova E, Agathocleous M, Murphy MM, et al. Oxidative stress inhibits distant metastasis by human melanoma cells. Nature. 2015 Nov 12;527(7577):186-91. doi: 10.1038/nature15726
【5】Theerawut Chanmee, Pawared Ontong,Naoki Itano. Hyaluronan: A modulator of the tumor microenvironment, Cancer Letters Volume 375, Issue 1, 28 May 2016, Pages 20-30 doi:10.1016/j.canlet.2016.02.031
【6】Pereira B, Billaud M, Almeida R. RNA-Binding Proteins in Cancer: Old Players and New Actors. Trends Cancer. 2017 Jul;3(7):506-528. doi: 10.1016/j.trecan.2017.05.003
【7】Rotow J, Bivona TG. Understanding and targeting resistance mechanisms in NSCLC. Nat Rev Cancer. 2017 Oct 25;17(11):637-658. doi:10.1038/nrc.2017.84.
【8】Andrew M. Intlekofer,Lydia W. S. Finley. Metabolic signatures of cancer cells and stem cells, Nature Metabolism volume 1, pages177–188 (2019) doi:10.1038/s42255-019-0032-0
【9】Lydia W. S. Finley. Metabolic signal curbs cancer-cell migration, Nature 571, 39-40 (2019) doi: 10.1038/d41586-019-01934-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。