银屑病新药!优时比IL-17A/17F双重抑制剂bimekizumab III期项目成功:疗效击败强生Stelara(喜达诺)
来源:本站原创 2020-06-15 17:52
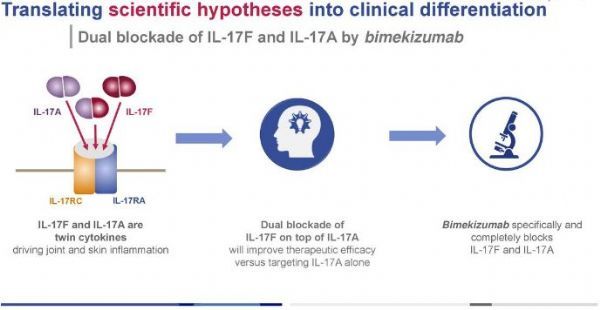
bimekizumab是一种具有双重作用机制的独特分子,能同时强效、选择性地中和IL-17A和IL-17。

2020年06月15日讯 /生物谷BIOON/ --优时比(UCB)近日在美国皮肤病学会(AAD)2020年年会虚拟会议上首次公布了新型抗炎药bimekizumab治疗中度至重度慢性斑块型银屑病III期临床开发项目的数据。
bimekizumab是一种具有双重作用机制的独特分子,这是一种新型人源化单克隆IgG1抗体,能强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。IL-17A和IL-17F具有相似的促炎功能,并独立地与其他炎症介质合作,在多个组织中驱动慢性炎症和损害。
bimekizumab独特的IL-17A/IL-17F双重抑制可能为治疗免疫介导的炎症性疾病提供一种新的靶向疗法。在疾病相关细胞中的临床前研究显示,在抑制IL-17A的同时抑制IL-17F能够减少皮肤和关节炎症以及病理性骨形成,其程度大于单独抑制IL-17A的程度。
目前,bimekizumab正处于III期临床开发,用于治疗多种炎症性疾病,包括斑块型银屑病、银屑病关节炎、中轴型脊柱关节炎、化脓性汗腺炎,该药尚未被任何监管机构批准。
AAD 2020会上公布的2项III期临床研究BE VIVID和BE READY中,与接受安慰剂或强生IL-12/IL-23抑制剂Stelara(中文商品名:喜达诺®,通用名:ustekinumab,乌司奴单抗)治疗的患者相比,接受bimekizumab治疗的患者在治疗第16周显示出更优的皮损清除。
根据银屑病面积和严重程度指数(PASI)皮损100%清除(PASI 100)和研究者总体评估(IGA)评分为皮损完全清除(IGA 0)或几乎完全清除(IGA 1)评价,在这2项研究中,接受bimekizumab治疗并在第16周达到皮损完全清除的患者中,大多数患者将这一缓解维持了一年。
这2项研究均评估了bimekizumab治疗中度至重度斑块型银屑病成人患者的疗效和安全性,均达到了研究的共同优越性终点,即:在治疗第16周,与安慰剂相比,银屑病面积和严重程度指数(PASI)改善至少90%(PASI 90)和IGA 0/1(皮损完全清除或几乎完全清除)。
优时比免疫解决方案执行副总裁、美国负责人Emmanuel Caeymaex表示:“我们很高兴分享2项bimekizumab III期研究(BE VIVID,BE READY)的详细结果。在这些研究中,大多数患者都能获得快速持久的皮损完全清除。这些阳性结果支持除了抑制IL-17A之外针对IL-17F的选择性抑制作用,比仅抑制IL-17A更能抑制炎症。随着bimekizumab项目的推进,优时比很自豪能够在联系科学与患者未满足需求方面走在前列。我们的雄心壮志是为银屑病患者提供一种变革性的治疗体验。”
BE VIVID研究的详细结果:疗效优于Stelara(喜达诺)
BE VIVID是一项关键III期研究,以Stelara作为阳性对照药物,bimekizumab每4周一次(Q4W)给药320mg。数据显示,在治疗第16周,采用PASI 90和IGA 0/1评价,与安慰剂组或Stelara组相比,bimekizumab组获得了显著更优的皮损清除。具体数据为:在治疗第16周,bimekizumab组有58.6%的患者实现PASI 100,Stelara组仅为20.9%。bimekizumab组与Stelara组合安慰剂组相比,有显著更高比例的患者达到PASI 90缓解(比例:85.0% vs 49.7% vs 4.8%,所有比较p<0.001)和IGA 0/1缓解(84.1% vs 53.4% vs 4.8%,所有比较p<0.001)。在接受一剂bimekizumab治疗的患者中,有76.9%的患者在第4周达到PASI 75缓解,而接受Stelara治疗的患者和接受安慰剂的患者中分别为15.3%和2.4%。
第52周结果显示,bimekizumab维持皮损清除比Stelara更具优势:bimekizumab组有64.2%的患者实现PASI 100缓解、Stelara组为38%(名义p<0.001)。在第52周,bimekizumab组与Stelara组相比有更高比例的患者也达到了IGA 0/1缓解(77.9% vs 60.7%,p<0.001)和PASI 90缓解(81.6% vs 55.8%,p<0.001)。bimekizumab组有38.9%的患者、Stelara组有38.7%的患者先前接受过抗TNF、抗IL-17、抗IL-23生物疗法。
该研究中,bimekizumab在52周内最常报告的不良事件是鼻咽炎(21.8%)、口腔念珠菌病(15.2%)、上呼吸道感染(9.1%)。大多数不良事件在强度上为轻到中度。绝大多数患者(94.7%)没有停止治疗。在第52周,bimekizumab的严重治疗紧急不良事件(TEAE)发生率为6.1%,而Stelara为7.4%。
BE VIVID研究的调查员、德国汉堡大学艾本多夫医学中心皮肤病学与护理健康服务研究所炎症性皮肤病转化研究Kristian Reich教授表示:“在AAD会议上展示的BE VIVID关键研究结果,显示了bimekizumab令人印象深刻的缓解速度和持久性。采用PASI 100评价,在第16周时的完全皮损清除结果,进一步加强了我们对bimekizumab提高银屑病患者获得持久清洁皮肤门槛的信心。”
BE READY研究的详细结果:疗效显著优于安慰剂
BE READY研究是一项关键III期研究,所有患者在前16周被随机分配接受bimekizumab 320mg Q4W或安慰剂。数据显示,在治疗第16周,bimekizumab组与安慰剂组相比有更高比例的患者达到PASI 90和IGA 0/1。bimekizumab组超过90%的患者达到PASI 90或IGA 0/1、有68.2%的患者实现皮损完全清除(PASI 100):PASI 90(bimekizumab组 vs 安慰剂组:90.8% vs 1.2%)、IGA 0/1(bimekizumab组 vs 安慰剂组:92.6% vs 1.2%)、PASI 100(bimekizumab组 vs 安慰剂组:68.2% vs 1.2%)。
在研究的第二阶段,治疗第16周获得至少PASI 90缓解的患者被重新随机分配至bimekizumab 2种不同的给药方案(每4周一次320mg或每8周一次320mg)连续治疗,或退出治疗(安慰剂Q4W)。该阶段评估了2种不同给药方案下(Q4W和Q8W)bimekizumab连续治疗与随机停药的效果对比。数据显示,2种bimekizumab给药方案组缓解维持相似:接受持续bimekizumab 320mg Q4W方案治疗的患者中,有86.8%的患者在第56周维持PASI 90,而转向bimekizumab 320mg Q8W方案的患者中为91%、停药患者中为16.2%。
该研究中,在第16周至第56周期间,最常报告的bimekizumab不良事件是鼻咽炎(Q4W组为10.4%;Q8W组为23%)、口腔念珠菌病(Q4W组为11.3%;Q8W组为9.0%)和上呼吸道感染(Q4W组为11.3%;Q8W组为8.0%),强度从轻度到中度。绝大多数患者(100%Q4W;98%Q8W)没有停止治疗。Q4W组和Q8W组在第56周的严重TEAE发生率分别为4.7%和3.0%,而安慰剂组为3.8%。
美国威斯康辛医学院皮肤病学教授Kenneth Gordon博士表示:“作为一种需要长期管理的慢性疾病,银屑病会给治疗带来复杂的挑战。今天的研究结果表明,bimekizumab可能在12个月内提供快速、一致的皮损清除结果,这对许多银屑病患者来说代表着一个深刻而有意义的进步。”
来自BE ALBE 2银屑病研究的结果也在AAD 2020会议上公布。这些结果显示,bimekizumab从第12周至第60周的持久缓解,进一步支持了bimekizumab III期临床项目中的结果。(生物谷Bioon.com)
原文出处:First Presentations of Bimekizumab Phase 3 Data Demonstrate Superior Skin Clearance Over Placebo and Stelara[®] at Week 16 in Adults with Moderate-to-Severe Plaque Psoriasis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->