国产激酶抑制剂!和黄医药索凡替尼治疗神经内分泌瘤:年底中国上市,2020-21年提交美欧申请!
来源:本站原创 2020-08-11 15:08
索凡替尼是一种新型口服酪氨酸激酶抑制剂(TKI),具有抗血管生成和免疫调节双重活性。

2020年08月11日讯 /生物谷BIOON/ --和黄中国医药科技有限公司(简称“和黄医药”或“Chi-Med”)近日宣布,已收到欧洲药品管理局(EMA)人用医药产品委员会(CHMP)关于索凡替尼(surufatinib,亦称HMPL-012或sulfatinib)治疗晚期神经内分泌肿瘤(NET)的科学建议。
根据CHMP的建议,和黄医药已得出结论:已完成的SANET-ep(非胰腺NET)和SANET-p(胰腺NET)研究,以及索凡替尼在美国非胰腺和胰腺NET患者中的现有数据,可以构成支持索凡替尼在欧洲上市许可申请(MAA)的基础。鉴于没有发现任何备案问题,在向美国食品和药物管理局(FDA)提交新药申请(NDA)之后,计划在2021年在欧盟提交MAA。
索凡替尼是由和黄医药自主研发的一种新型的口服酪氨酸激酶抑制剂(TKI),具有抗血管生成和免疫调节双重活性。索凡替尼可通过抑制血管内皮生长因子受体(VEGFR)和成纤维细胞生长因子受体(FGFR)以阻断肿瘤血管生成,并可抑制集落刺激因子-1受体(CSF-1R),通过调节肿瘤相关巨噬细胞,促进机体对肿瘤细胞的免疫应答。因为具有抗肿瘤血管生成和免疫调节的独特双重作用机制,索凡替尼可能非常适合与其他免疫疗法联合使用。和黄医药目前拥有索凡替尼在全球范围内的所有权利。
在中国,索凡替尼已提交2项新药上市申请,并计划于2020年底于中国首次上市用于治疗神经内分泌瘤(NET):(1)非胰腺NET新药上市申请取得进展——基于SANET-ep III期临床试验的积极结果,已于2019年末提交申请,目前国家药监局(NMPA)对新药上市申请的审评正在进行中,和黄医药仍计划于2020年底上市。(2)胰腺NET新药上市申请已提交——继SANET-p III期临床试验于中期分析中获得积极结果并提前终止后,和黄医药已提交了治疗胰腺NET的中国新药上市申请,并预计于短期内获受理。
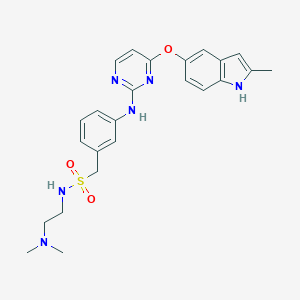
surufatinib化学结构式(图片来源:pubchem)
和黄医药已建立自有的肿瘤商业化团队,已为即将到来的新肿瘤药上市做好准备。2020年上半年,和黄医药确定了索凡替尼的全球注册策略。在美国,该药的新药上市申请正在筹备中,计划在2020年底到2021年初采用滚动递交的方式递交,并且正在为2021年底于美国推出新药做好准备。在欧洲,和黄医药计划于2021年提交NET的上市许可申请(MAA)。
7月30日,和黄医药公布《2020中期业绩及关键临床项目最新进展》(点击查看),其中还包括了索凡替尼临床合作的相关进展:
——与拓益®联合疗法进入II期临床试验:一项索凡替尼联合拓益®(君实生物已于中国获批的PD-1单克隆抗体)治疗8种实体瘤的II期临床试验于2020年初启动。美国癌症研究协会(“AACR”)上公布的数据表明,该联合疗法的耐受性良好,并展现出了令人鼓舞的疗效,接受II期临床试验推荐剂量(“RP2D”)的疗效可评估患者的ORR为64%、DCR为100%。
——与达伯舒®PD-1联合疗法研究启动:2020年7月,信达生物启动了索凡替尼与达伯舒®(信达生物已于中国获批的PD-1单克隆抗体)联合疗法的I期临床试验。
——与百济神州有限公司(“百济神州”)全球PD-1合作:2020年5月在美国开始开展临床开发合作,探索索凡替尼与替雷利珠单抗(百济神州的PD-1抗体)的联合疗法。(生物谷Bioon.com)
原文出处:Chi-Med Plans to Submit Marketing Authorization application for Surufatinib Following Scientific Advice from EMA’s CHMP
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


