癌症为什么这么致命?这些蛋白“功不可没”!
来源:本站原创 2019-06-11 07:45
2019年6月11日讯 /生物谷BIOON /——本期为大家盘点了关于癌症相关蛋白质的最新研究进展,帮助大家了解癌症相关蛋白质在癌症发生、发展、转移和复发过程中的重要作用,以及关于癌症相关蛋白质的新发现如何帮助我们改善癌症治疗和诊断策略。【1】Science子刊:发现经常突变的癌蛋白的空间染色体组织的新作用DOI: 10.1126/sciadv.aaw5294威斯达研究所的一项新研究揭示了蛋白质A
2019年6月11日讯 /生物谷BIOON /——本期为大家盘点了关于癌症相关蛋白质的最新研究进展,帮助大家了解癌症相关蛋白质在癌症发生、发展、转移和复发过程中的重要作用,以及关于癌症相关蛋白质的新发现如何帮助我们改善癌症治疗和诊断策略。
威斯达研究所的一项新研究揭示了蛋白质ARID1A的功能,该蛋白由一种基因编码,这种基因是人类癌症中最常见的突变之一。根据发表在《Science Advances》上的这项研究,ARID1A在基因组的空间组织中发挥着作用;因此,它的缺失对整体的基因表达具有广泛的影响。这一发现为破译与几种癌症特别是卵巢癌相关的分子变化提供了重要信息。

图片来源:Science Advances
基因组的三维结构决定了DNA分子如何在一个微观空间中堆积,同时也允许每个基因在适当的时间进行转录和表达。研究小组发现,ARID1A与凝素II复合物的一个组分相互作用,后者通过组织染色体结构来调控基因表达。
结果表明ARID1A决定了凝血酶II在某些称为增强子的DNA调控元件上的基因组定位。因此,当ARID1A功能因基因突变而丧失时,凝缩素II的分布发生改变,大量基因的表达也随之改变。Zhang和他的同事还发现,通过与凝缩素II的相互作用,ARID1A控制着染色体的不同部分如何在空间上组织在一起,这些区域被称为染色体区域,有助于某些基因的协调表达。
波士顿大学医学院(BUSM)的研究人员发现,阻断特定蛋白质可能具有预防恶性前列腺癌(CRPC)恶化的效果。研究人员长期研究了三个密切相关的蛋白家族,称为BET溴结构域蛋白,由调节基因表达的BRD2,BRD3和BRD4组成。 这些研究人员现已发现抑制蛋白质BRD4具有调节前列腺癌细胞的迁移和侵袭的能力。
"我们的研究结果非常重要,因为CRPC目前的治疗选择有限,主要集中在抑制依赖AR信号传导的前列腺肿瘤细胞,"第一作者,BUSM博士研究生Jordan Shafran解释道。
CRPC是一种复杂的异质性疾病,在各个肿瘤细胞中具有不同的AR状态和表达模式。随着疾病的发展,前列腺肿瘤细胞可以减少对AR信号的依赖,并使用替代的信号传导机制来维持生长和传播。 "因此,必须确定调节前列腺癌细胞迁移和入侵的'可药物'靶点,这些细胞依赖于或独立于雄激素受体信号传导,"他补充道。
在一项新的研究中,来自美国芝加哥大学等研究结构的研究人员通过对肿瘤及其周围组织---特别是周围组织中的称为成纤维细胞的正常细胞---的系统性调查,揭示出一种新的治疗靶标可能潜在地阻止与HGSC相关的快速传播和预后。相关研究结果发表在Nature期刊上。
在这项新的研究中,这些研究人员发现基质对癌细胞有重要影响。Lengyel说,"在这种情况下,它让它们变得更为恶性、更具侵略性和更具浸润性。基质通常比癌症本身更大。"这些研究人员分析了来自少量患者生物样本库材料的正常组织和癌变组织中的5000多种蛋白的表达。他们首次能够在疾病进展中将癌细胞和周围基质中的分子变化区分开来。当他们获得他们的数据时,他们发现与癌细胞相反,转移性基质(metastatic stroma)具有高度保守的蛋白特征。这些转移性变化在所有分析的患者中都观察到。他们如今正在试图了解它们在癌症转移期间的功能性作用,以便发现新的治疗靶点。
在这个过程中,他们发现了一种代谢酶,即烟酰胺N-甲基转移酶(nicotinamide N-methyltransferase, NNMT),在转移性癌细胞周围的基质中高度表达。他们发现NNMT在肿瘤基质中引起广泛的基因表达变化,从而将正常的成纤维细胞转化为支持和加快肿瘤生长的癌症相关成纤维细胞。基质NNMT表达促进卵巢癌进展和转移。这与非常差的患者治疗结果有关。
这些研究人员如今正在使用高通量筛选来寻找抑制这种酶的新方法。论文共同第一作者、芝加哥大学妇产科研究助理教授Mark Eckert,"一种方法看起来很有希望。我们有几个候选抑制剂的骨架。我们知道我们的靶标,我们知道结构,我们治疗如何应用它,我们有方向感。我们开始了解解正常的成纤维细胞如何被这种代谢酶转化为与癌症相关的成纤维细胞。"
目前的证据表明,靶向RUVBL1-RUVBL2具有治疗癌症的潜力。RUVBL1-RUVBL2是伴随R2TP的能量引擎。这使得西班牙国家癌症研究中心(CNIO) DNA损伤反应研究小组的研究人员使用强大的冷冻电子显微镜工具来确定调控RUVBL1和RUVBL2的机制,这项研究发表在《Science Advances》杂志上。

图片来源:Science Advances
如前所述,DNA损伤反应中的大分子复合物研究小组采用低温电子显微镜测定了R2TP的高分辨率结构。在这项研究中,CNIO的研究人员观察了细胞是如何设计R2TP使伴侣蛋白HSP90与它所作用的蛋白接触的。R2TP复合物有一个能量引擎,一个由ATP酶RUVBL1和RUVBL2组成的环,可以利用ATP水解释放的能量生成ADP。在这个能量产生机制中,ATP酶捕获细胞内的ATP,并不断释放ADP作为废物和能量。
科学家们发现,在RUVBL1和RUVBL2形成的环中,ATP结合位点的通路被完全阻断,ATP或ADP滞留在环内,从而阻碍了能量的交换和电机的工作。问题是,如何利用组装蛋白质复合物所需的能量?
通过在低温电子显微镜下观察R2TP系统,研究人员找到了答案:"我们在RUVBL2中发现了一个区域,它作为一个控制ATP和ADP进入蛋白质的通道;这个过程需要使用ATP提供的能量。调节这个门的开启的关键是ATPase RUVBL2和mTOR组装所需的R2TP组件之间的相互作用。"
蛋白质是人体的主要工作物质,它几乎参与细胞的每一个过程。不同类型的分子,如糖,可以添加到蛋白质上改变其作用或位置,但这一过程也可能在癌症中发挥作用。事实上,含有特定糖修饰的肿瘤细胞更有可能在体内扩散。但是到目前为止研究人员并不清楚T抗原是促进了这个过程还是只是单纯的出现在这些细胞上面。
为了回答这个问题,来自奥地利科学技术研究所的Daria Siekhaus等人用遗传和生物化学的工具来研究了发育阶段的果蝇胚胎,这些胚胎中的某些免疫细胞携带T抗原蛋白。和侵入的癌细胞一样,这些免疫细胞在发育过程中也能进入组织。
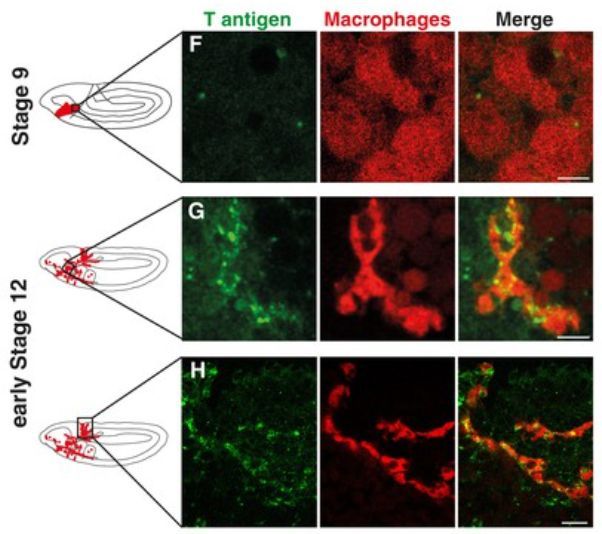
图片来源:eLife
实验表明,一种名为Minerva的蛋白质可以帮助T抗原附着在蛋白质上。当研究人员对胚胎进行基因工程化设计使之含有更少的Minerva时,免疫细胞中的T抗原数量下降,且细胞无法轻易地进入组织。当小鼠来源的Minerva再次被添加到胚胎中时,果蝇的免疫细胞的含有更多的T抗原,可以再次侵入组织。
目前已知Minerva靶向的一些蛋白质与癌症有关,但并非全部都与癌症相关。未来的实验将研究人源的Minerva在进入新组织的癌细胞中扮演的角色,以及它能否帮助我们预测癌症是否可能扩散。
众所周知,转移性卵巢癌,前列腺癌和乳腺癌难以治疗并且是致命的。现在,Salk研究所的研究人员揭示了CDK12蛋白在癌症恶化过程中的新作用。该研究结果发表于在《Genes&Development》杂志上。"大约3-5%的前列腺癌,卵巢癌和乳腺癌包含CDK12基因的突变,最近的研究表明,这一亚群细胞对免疫治疗药物有独特的反应,而大多数这些癌症都没有反应,"作者说道:"这表明,对于大多数缺乏CDK12突变的癌症,CDK12的化学抑制剂可用于使癌症更容易被化疗药物杀死,并且对免疫疗法治疗也可能更敏感。"
通过分析CDK12在保护细胞免于化疗中的作用,该小组发现了一组由CDK12控制的新基因,包括许多受另一种叫做mTORC1的蛋白质调控的基因,这种蛋白质可控制癌细胞的新陈代谢。尽管CDK12主要位于细胞核中,但它与mTORC1一起控制翻译过程 - 这是在细胞内产生新蛋白质的重要步骤。
在与Salk教授Alan Saghatelian教授的合作中,该团队能够在翻译水平上识别受CDK12调控的特定基因。发现有数百个基因以这种新方式受CDK12控制,其中许多基因与癌细胞生长有关。令研究人员惊讶的是,许多其他新发现的CDK12调控基因对细胞分裂(有丝分裂)至关重要。 Salk的博士后研究员Seunjae Kim进行的显微镜成像研究显示,CDK12帮助染色体凝聚,然后分离成两个不同的细胞。 CDK12在有丝分裂所必需的整个基因网络表达中的作用是完全未知的。
构成我们身体的细胞差异很大,每个细胞都有独特的功能。然而,每种蛋白质的蓝图都保存在基因中,我们的遗传信息在我们身体的每个细胞中都是相同的。对于具有相同遗传物质的细胞能够产生不同的蛋白质,某些"辅助"蛋白是必需的。负责这种帮助的分子被称为转录因子 - 这些确保只读取和转录特定的基因以产生更多所需的蛋白质。最近,研究人员做了一个令人惊讶的发现,他们的研究结果现在发表在《Molecular Cell》杂志上。
Wolf博士的博士生Apoorva Baluapuri用类比解释了这一观察结果:"人们可以想象基因的读取就像乘坐火车一样。读取遗传信息的细胞机器就像基因开始时的火车一样。只有当火车成功到达最终目的地时,基因的终点才会产生相应的蛋白质。
直到最近,科学家才认为转录因子可以控制从一个基因开始出发的"列车"数量,从而起到交通信号的作用。研究人员最近观察到,转录因子不仅仅会增加离开车站的列车数量,而是确保所有列车都到达最终目的地并且不会在那里中途停留。进一步,作者研究了转录因子如何做到这一点。作者证明转录因子确保只有实际拥有旅行所需物品的火车才能离开火车站。"人们可以说转录因子起到了加油泵服务员的作用。"
为什么转录因子更多地作为气泵伴随而不是交通信号呢? "一方面,这种基本的分子机制知识对于了解不同细胞类型如何在人体中产生非常重要,"作者解释说。 "另一方面,正常的细胞,如肝脏和肌肉细胞,需要转录因子才能存活。癌细胞也利用转录因子产生支持其生长和分裂所需的蛋白质。"
任何研究过乳腺癌分子基础的人都可能听说过BRCA1,这是一种阻止乳腺组织中的细胞发生癌变的蛋白。令人吃惊的是,在一项新的研究中,来自德国维尔茨堡大学、哥廷根大学、荷兰王妃马克西玛儿科肿瘤中心和阿姆斯特丹大学的研究人员发现这种蛋白也可能起着相反的效果:在另一种类型的癌症---神经母细胞瘤---中,它有助于保持肿瘤稳定。相关研究结果发表在Nature期刊上。
论文第一作者、Eilers研究团队研究员Steffi Herold说,"在侵袭性神经母细胞瘤中,肿瘤蛋白MYCN必须与BRCA1相互作用才能让这种肿瘤存活下来。"Eilers团队在细胞培养实验中发现了这一点。 这一结果也在患者的组织材料中得到证实:儿童患者中含有MYCN的肿瘤总是具有高浓度的BRCA1。在这项研究中,这些研究人员描述了BRCA1蛋白让神经母细胞瘤细胞保持存活的机制。鉴于癌细胞生长得太快而且分裂太频繁,它们必须以非常高的速率进行代谢。这意味着这些癌细胞遭受应激,这也正是BRCA1的用武之地:"简而言之,它确保这些癌细胞能够应对这种应激",维尔茨堡大学博士后研究员Gabriele Büchel博士解释道。
在神经母细胞瘤细胞中,蛋白MYCN控制着转录,即细胞核中遗传信息的读取。Eilers教授将这个对于细胞生存至关重要的过程比作为在轨道上运行的火车。"如果轨道受到损坏,火车将停止运转。肿瘤细胞的生长一旦停止,它们就可能死亡。"在这种情况下,蛋白BRCA1确保切换到侧轨上的开关打开着。在那里,火车可以等到肿瘤细胞修复了这条主要轨道受到的损坏。因此,蛋白MYCN和BRCA1携手合作,从而确保肿瘤细胞的代谢能够继续全速运转。这些研究人员在寻找神经母细胞瘤细胞中之前未知的靶标用于抑制肿瘤生长时就意识到了这一点。尽管神经母细胞瘤患者不会立即从这些新发现中获益,但是这些研究人员将继续探究这个主题。他们希望这些发现将有助于开发针对这种疾病的新疗法。他们还希望查明蛋白MYCN和BRCA1是否仅在神经母细胞瘤中发挥协同作用,或者是否存在一种影响其他类型癌症的通用机制。比如,Herold博士将分析前列腺癌细胞,这是因为MYCN蛋白也与这种肿瘤的高度侵袭性形式存在关联。
所有的肿瘤都和细胞生长失控有关,但是细胞最初生长失控的方式却有成千上万种。肿瘤中存在大量突变的蛋白质,其中一类叫做组蛋白,这种蛋白质的正常功能是包装DNA帮助调节基因表达。但是根据一项由洛克菲勒的科学家完成、发表在《Nature》上的最新研究,肿瘤中所谓的肿瘤组蛋白远比我们过去认为的更常见。
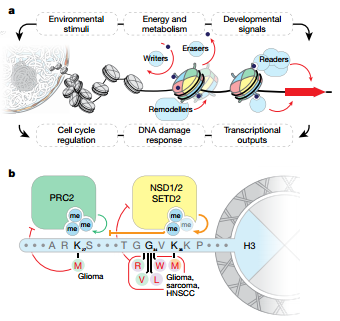
图片来源:Nature
过去十年里,C. David Allis和其他人已经研究了和不同肿瘤相关的突变组蛋白,比如一些脑癌和骨癌。基于这些研究,Allis(Joy and Jack Fishman教授)与访问学者Benjamin Nacev及其他同事一起决定研究其他种类的肿瘤中是否也存在肿瘤组蛋白。Nacev是纪念斯隆凯特琳癌症中心的医学肿瘤学研究员,他利用医院的肿瘤测序数据库和其他可获得的公共数据去确定不同肿瘤中的组蛋白突变的频率。他和他的同事发现他们分析的样品中有4%的样品出现了肿瘤组蛋白--这远远高于过去的报道。研究人员还发现这些突变影响着过去未发现的组蛋白。
"这些结果确认了一个逐渐兴起的观点:许多组蛋白突变之后也许会以一种我们目前未知的方式促进肿瘤生长。"Allis说道。Nacev补充道:"这项研究帮助我们明白了组蛋白生物学最基础的部分,这是我们正对这些突变开发新药帮助病人的第一步。"
丝苏氨酸激酶17A(serine threonine kinase 17A,STK17A)在不同的肿瘤中发挥着不同的作用,可能抑制癌症,也可能促进癌症,这依赖于癌症类型。但是到现在为止研究人员还不清楚它在结直肠癌中的作用。Christopher Williams博士、Sarah Short博士及其同事发现原发结直肠癌及远端转移灶中的STK17A表达都会下调。结直肠癌细胞系中STK17A的下调会导致细胞发生上皮间质转化相关的变化,而这个过程会使得原来紧密连接的癌细胞变为具有迁移能力和侵袭能力的癌细胞,从而增强了癌症转移的能力。
研究人员发现病人来源的肿瘤类器官中也会出现相似的STK17A下调的情况。这项研究发表在《Molecular Cancer Research》上,题为"Serine Threonine Kinase 17A maintains the epithelial state in colorectal cancer cells",该研究揭示了STK17A在调节上皮细胞类型中扮演的新角色,表明STK17A的缺失可能导致了结直肠癌的侵袭和转移。由于大多数结直肠癌相关的死亡都是由于转移导致,因此找出导致结直肠癌转移的相关信号通路具有重要的临床意义。因此该研究为预防和治疗结直肠癌的转移带来了新突破。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


