研究发现人源甲状旁腺激素受体2复合物三维结构
来源:上海药物所 2021-08-10 07:39
中国科学院上海药物研究所王明伟/杨德华团队、徐华强/赵丽华团队携手蒋华良/程曦团队,在PNAS上在线发表了研究成果Molecular insights into differentiated ligand recognition of the human parathyroid hormone receptor 2。这篇由诺贝尔化学奖得主Robert J.
中国科学院上海药物研究所王明伟/杨德华团队、徐华强/赵丽华团队携手蒋华良/程曦团队,在PNAS上在线发表了研究成果Molecular insights into differentiated ligand recognition of the human parathyroid hormone receptor 2。这篇由诺贝尔化学奖得主Robert J. Lefkowitz主审的直投(PNAS Direct Submission)论文首次报道了人源甲状旁腺激素受体2(Parathyroid hormone receptor 2,PTH2R)与其内源性配体和Gs蛋白复合物的冷冻电镜结构,揭示了PTH2R的配体选择性、拮抗作用及疾病发生的分子机制,为相关新药的研发奠定了基础。
PTH2R是B1类G蛋白偶联受体家族成员,由550个氨基酸组成,主要分布在脑部,参与疼痛传导、伤口愈合和机械感知。PTH2R也可调控钙离子转运,改善角质细胞分化,是Darier病和Hailey-Hailey病的潜在治疗靶点。PTH2R和甲状旁腺激素受体1(Parathyroid hormone receptor 1,PTH1R)的天然配体包括甲状旁腺激素(Parathyroid hormone,PTH)、肺漏斗肽39(Tuberoinfundibular peptide 39,TIP39)和甲状旁腺激素类似肽(Parathyroid hormone-related peptide,PTHrP)。PTH2R可被TIP39和PTH识别,而PTH1R只能被PTHrP和PTH激活。
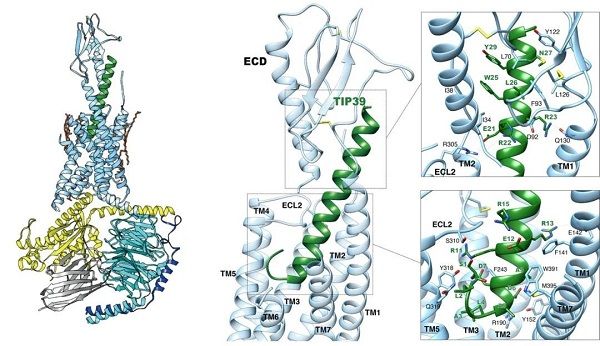
该团队此前解析了PTH1R与长效甲状旁腺激素(Long-acting parathyroid hormone,LA-PTH)复合物的三维结构,发现了PTH1R胞外侧结构域极具灵活性,但PTH2R和PTH1R特异性识别内源配体的分子机制尚不明了。科研人员经过前期载体筛选和应用NanoBiT系连技术,获得了颗粒均一且性状稳定的高质量蛋白复合物。研究人员借助上海药物所300 kV冷冻电镜拍摄的清晰图像和后继单颗粒三维重构,获得了分辨率为2.8埃的TIP39-PTH2R-Gs三元复合物的立体结构(图1)。
研究揭示,PTH2R内源配体TIP39呈现两亲性α螺旋,羧基端与胞外结构域作用,氨基端则插入受体跨膜结构域。与以往已解析的B1类GPCR结构不同,TIP39末端氨基与自身氨基酸残基以氢键方式形成闭合环状结构,较深地插入至跨膜结构域(图1)。与PTH1R相比,PTH2R的第一跨膜螺旋更长,向受体中心弯折,且第一跨膜螺旋与TIP39相互作用(图2),这或是PTH2R选择性识别配体的结构基础。分子动力学模拟和点突变实验证明,PTH2R的Y3185.39b、K1972.67b和R305ECL2参与配体的特异性识别(图2)。截短TIP39的氨基端则使之成为PTH2R的拮抗剂即TIP(7-39)。分子动力学模拟结果表明,TIP(7-39)与PTH2R相互作用导致第六跨膜螺旋弯折的角度相比全长TIP39所引起的弯折角度为小,从而解释了TIP(7-39)拮抗作用的分子机制。基于TIP39-PTH2R-Gs复合物结构,引入导致生长发育迟缓的G258D突变,分子动力学模拟发现该变异受体胞内侧疏水作用被破坏,与G蛋白结合能力减弱,点突变实验也佐证了这一结论。(生物谷 bioon)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


