bioRxiv:首次在全球对奥密克戎突变毒株的刺突蛋白进行分子水平分析
来源:本站原创 2021-12-29 22:49
来自英属哥伦比亚大学等机构的科学家们通过研究在全球首次对奥密克戎突变毒株的刺突蛋白进行了分子水平上的结构学分析。
2021年12月29日 讯 /生物谷BIOON/ --最新报告的新冠病毒奥密克戎变异毒株或将取代德尔塔变异毒株,成为在全球传播速度最快的SARS-CoV-2突变毒株。近日,一篇发表在预印版网站bioRxiv上题为“SARS-CoV-2 Omicron Variant: ACE2 Binding, Cryo-EM Structure of Spike Protein-ACE2 Complex and Antibody Evasion”的研究报告中,来自英属哥伦比亚大学等机构的科学家们通过研究在全球首次对奥密克戎突变毒株的刺突蛋白进行了分子水平上的结构学分析。
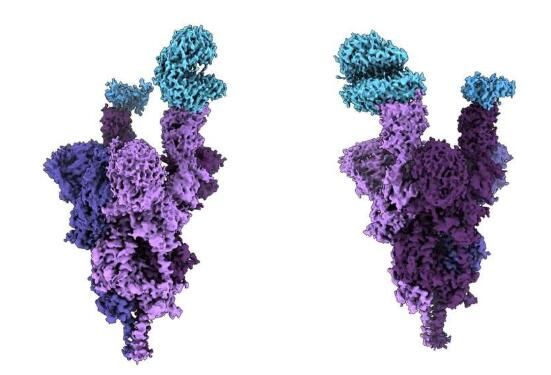
与人类ACE2受体(蓝色)结合的Omicron变异毒株的刺突蛋白(紫色)的原子结构。
图片来源:Dr. Sriram Subramaniam
文章中,研究人员利用低温电镜技术以接近原子分辨率的水平揭示了这种严重的变异毒株是如何感染人类细胞并能高度躲避宿主机体的免疫力,相关研究结果或能帮助解释为何奥密克戎变异毒株具有较高的传播性,同时还有望帮助研究人员开发更为有效的治疗性策略。研究者表示,奥密克戎变异毒株拥有37个刺突蛋白,这一数量或许是前所未有的,而且要比研究人员看到的其它突变毒株多3-5倍。
这一点就非常重要,首先因为刺突蛋白是病毒吸附并感染人类细胞的方式,其次,抗体会吸附到刺突蛋白上来中和病毒。因此,刺突蛋白上的小突变往往会对病毒的传播方式、机体如何去抵御突变毒株以及疗法的有效性产生重大的影响。研究人员利用低温电镜和其它手段揭示了突变如何在分子水平下影响奥秘克隆突变毒株的行为。研究者表示,我们看到,包括R493, S496和R498在内的多个突变会在刺突蛋白和人类细胞受体ACE2之间产生新的盐桥和氢键,这似乎就会增加病毒的亲和力(病毒吸附到人类细胞上的强度),而其它突变(K417N)则会降低这种结合的强度。
总体而言,研究结果表明,相比原始的SARS-CoV-2病毒而言,奥密克戎突变毒株有着更强的亲和力,其水平与我们所看到的德尔塔突变毒株相似;但重要的是,尽管发生了如此广泛的变异,但奥密克戎突变毒株仍能保持与人类细胞有效结合的能力。本文研究证实了科学家们在现实世界中看到的情况,即奥密克戎突变毒株在躲避通常用用作治疗的单克隆抗体以及躲避疫苗和自然感染所产生的免疫力上或许远远优于其它突变毒株。
图片来源:https://www.biorxiv.org/content/10.1101/2021.12.19.473380v1
值得注意的是,相比未接种疫苗的COVID-19患者的自然感染所产生的免疫力相比,奥密克戎对疫苗所产生的免疫力的躲避水平较低,这就表明,接种疫苗依然是有效抵御奥密克戎突变毒株的最佳防御性手段。研究人员所观察到的刺突蛋白突变(能与人体细胞强烈结合并增加抗体的逃避)的两个特征都可能会导致奥密克戎突变毒株传播性增加的因素,这些或许都是促进突变体快速扩散的基本截至,这也就是为何奥密克戎为何能很快成为SARS-CoV-2的主要突变体了。
好消息是,揭示奥密克戎突变毒株刺突蛋白的分子结构或能帮助研究者开发抵御奥密克戎即其相关突变体的新型有效性疗法,理解病毒吸附并感染人类细胞的机制意味着我们需要开发出能干扰这一过程并中和病毒的治疗性手段。目前研究人员的重点就是更好地理解中和性抗体的结合,以及在整个突变体范围内有效的治疗方法,同时研究人员还有望用来帮助开发抵御突变体的新型疗法。
综上,本文研究结果表明,ACE2层面上相互作用的保留以及抗体规避的增加或许是导致奥密克戎突变毒株传播性增加的分子因素。(生物谷Bioon.com)
原始出处:
Dhiraj Mannar, James W. Saville, Xing Zhu, et al.SARS-CoV-2 Omicron Variant: ACE2 Binding, Cryo-EM Structure of Spike Protein-ACE2 Complex and Antibody Evasion,bioRxiv (2021). DOI:10.1101/2021.12.19.473380
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



