一种创新的NRF2纳米调节剂诱导肺癌铁死亡并诱导免疫刺激的肿瘤微环境
来源:本站原创 2021-06-15 09:59
一种纳米药物同时靶向肿瘤微环境和癌细胞的研究到目前为止还没有报道。在此,作者报道了零价铁纳米颗粒(ZVI-NP)诱导肿瘤特异性细胞毒和抗癌免疫的双重特性。这种双功能纳米药物建立了协同诱导铁链癌细胞死亡和重新编程免疫抑制微环境的有效策略,这突显了ZVI-NP作为一种先进的综合抗癌策略的潜力。图片来源:doi:10.7150/thno.57803零价铁纳米颗粒(
一种纳米药物同时靶向肿瘤微环境和癌细胞的研究到目前为止还没有报道。在此,作者报道了零价铁纳米颗粒(ZVI-NP)诱导肿瘤特异性细胞毒和抗癌免疫的双重特性。这种双功能纳米药物建立了协同诱导铁链癌细胞死亡和重新编程免疫抑制微环境的有效策略,这突显了ZVI-NP作为一种先进的综合抗癌策略的潜力。
零价铁纳米颗粒(Zvi)因其还原能力强、可利用性广等优点,被广泛应用于地下水或含多种有机、无机污染物的废水处理。ZVI-NP可以通过Fenton反应和其他化学过程产生大量的活性氧(ROS)。尽管环境修复备受关注,但对肿瘤细胞本身的抗肿瘤作用和肿瘤微环境(TME)免疫调节的体内外研究较少。以前,作者发现银包被的ZVI-NP(ZVI@Ag)可以通过增强癌细胞的溶酶体功能而迅速转化为铁离子。ZVI-NP在癌细胞的溶酶体中优先转化为铁离子,而在正常细胞中不转化为铁离子,这是因为它们在癌变状态下的细胞器内更酸性。铁离子的突然释放进一步诱导癌细胞内ROS激增,损伤亚细胞器,导致铁死亡。此外,具有生物相容性有机外壳的羧甲基纤维素包裹的ZVI-NP(ZVI@CMC)可诱导癌细胞脂质过氧化和引发铁死亡。然而,ZVI-NP诱导的铁死亡的潜在分子机制以及ZVI-NP对肿瘤相关免疫细胞的影响仍不清楚。
铁死亡是近年来发现的一种新的细胞程序性死亡。它的特点是在细胞死亡过程中细胞内铁积累和脂质过氧化。铁死亡细胞的形态特征是线粒体小,膜破裂,嵴消失,这与坏死、凋亡和自噬有明显的区别。越来越多的证据表明,引发铁死亡作为一种有效的抗癌疗法在根除恶性肿瘤方面具有巨大的潜力。例如,FDA批准的抗癌药物索拉非尼通过阻断谷胱甘肽(GSH)的合成而被确定为铁死亡诱导剂。然而,索拉非尼可能会引起严重的临床不良反应,包括危及生命的心血管事件。因此,在提高安全性的同时,通过诱导铁死亡来开发抗癌策略是非常重要的。
癌症免疫疗法通过增强患者自身的免疫系统来清除癌细胞,在过去的十年里彻底改变了癌症治疗的格局。然而,免疫疗法只对一小部分癌症患者有实质性的益处。近年来,已有几种NPs被报道可诱导肿瘤微环境的调节,如二氧化锰NPs或磁性NPs对巨噬细胞的重编程,颗粒酶B NPs促进抗肿瘤细胞毒T细胞的功能,抗体靶向NPs增强肿瘤部位的细胞毒T细胞募集等。此外,作为“吃我”信号的前吞噬细胞钙网织蛋白的表达可以通过锰基纳米颗粒在癌细胞上被放大。然而,生物相容性和规模化生产仍然是抗癌纳米药物开发的主要挑战。因此,ZVI-NP能有效地将大量的铁输送到癌细胞,可能是一种很有前途的诱导肿瘤铁死亡的策略。此外,ZVI-NP如何调节免疫应答也值得进一步探讨。
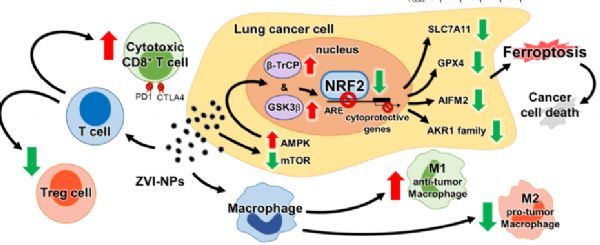
ZVI-NPs的双重协同抗癌作用模型
图片来源:doi: 10.7150/thno.57803
总之,本研究确定了ZVI-NP对非恶性细胞的双重抗癌作用机制。第一种机制是通过激活AMPK/mTOR信号通路,增强β/β-TrCP依赖的NRF2的降解,从而选择性地触发肺癌细胞中的铁死亡。第二种机制是通过激活抗肿瘤免疫反应。它既涉及巨噬细胞极化向抗肿瘤M1表型的调节,又涉及增强CD8+淋巴细胞的杀伤活性以及降低Treg细胞的比例。通过对分子机制的了解,作者提出NRF2或相关蛋白可能作为肺癌或NRF2成瘾癌症患者的生物标志物,并可能受益于ZVI-NP治疗。此外,ZVI@CMC具有生物相容性涂层和可批量生产的特点,可能在新的先进癌症治疗方面发挥潜力。这些结果为开发协同作用于癌细胞和肿瘤微环境的新型抗癌精密纳米药物提供了一个新的视角。(生物谷 Bioon.com)
参考资料
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。