全球早衰症药物!首创法尼基转移酶抑制剂Zokinvy在美国上市:寿命平均延长2.5年!
来源:本站原创 2021-01-28 15:56
Zokinvy是一种首创药物,可阻断早衰蛋白的法尼基化。

2021年01月28日/生物谷BIOON/--Eiger是一家致力于开发和商业化靶向疗法治疗严重罕见和超罕见疾病的生物制药公司。近日,该公司宣布,已在美国市场推出Zokinvy(lonafarnib),该药于2020年11月获得美国FDA批准,用于治疗早衰症(Progeria,又称:哈金森-吉尔福德早衰综合征,HGPS)和早衰样核纤层蛋白病(Progeroid Laminopathies,PL)患者,降低死亡风险。在临床试验中,Zokinvy治疗将死亡率降低了60%(p=0.0064),平均寿命延长2.5年。许多患者使用该药物已超过10年。
值得一提的是,Zokinvy是全球第一个获批治疗早衰症和早衰样核纤层蛋白病(PL)的药物。在批准的同时,FDA颁发给Eiger一张罕见儿科疾病优先审查凭证(PRV),以奖励该公司在早衰症领域做出的突出贡献。在11月23日,Eiger宣布,已将这张PRV以9500万美元出售,根据早衰症研究基金会(PRF)的合作和供应协议,Eiger保留了50%的收益,即4750万美元。
Eiger首席商务官Eldon Mayer表示:“Zokinvy是为已被证明能降低早衰症患者死亡风险的药物。为了履行对患者的承诺,我们建立了Eiger OneCare, 这一综合性计划,包括由专业护理经理、报销专家提供的个性化支持、为符合条件的患者提供的共同付费援助以及旨在帮助寻求Zokinvy治疗的患者的其他患者支持服务。”
在美国,大多数已确定的Zokinvy合格患者已通过Eiger的全球扩大准入计划接受了Zokinvy治疗,目前已加入到Eiger OneCare,这将有助于顺利过渡到Zokinvy商业供应。
在美国,Zokinvy通过优先审查程序获得批准,该药目前也在接受欧洲药品管理局(EMA)的加速评估。此前,Zokinvy已被美国FDA和欧盟EMA授予治疗早衰症和早衰样核纤层蛋白病的孤儿药资格(ODD)、被FDA授予突破性药物资格(BTD)和罕见儿科疾病资格(RPDD)。
早衰症和早衰样核纤层蛋白病(PL)是一独特的、超罕见、遗传性早衰性疾病,可导致儿童过早衰老,加速年轻患者的死亡。若未经治疗,早衰症儿童将死于心脏病,平均死亡年龄14.5岁。据估计,全球约有400例早衰症儿童、200例PL儿童,其中大约180例儿童和年轻成人已被早衰症研究基金会(The Progeria Research Foundation)确认,其中大约20人在美国、23人在欧洲。
Zokinvy是一种首创的、口服法尼基转移酶抑制剂(FTI),可阻断早衰蛋白的法尼基化。该药是一种疾病修正疗法,在早衰症儿童和年轻成人中具有显著的生存益处。在早衰症患者中,Zokinvy将死亡率降低了60%(p=0.0064),平均生存时间增加了2.5年。最常见的不良反应是胃肠道反应(呕吐、腹泻、恶心),大多数为轻度或中度(1级或2级)。许多早衰症患者已接受了持续10年以上的Zokinvy治疗。
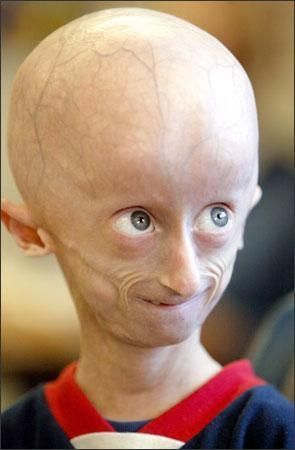
早衰症男孩——berns,17岁时去世
早衰症(HGPS)是一种罕见的、致命的儿童加速衰老的遗传性疾病。该病是由编码核纤层蛋白A(lamin A)的LMNA基因中的一个点突变引起的,产生法尼基化异常的、有毒性的早衰蛋白(progerin)。核纤层蛋白A是细胞核结构支架的一部分,在细胞核结构和功能方面发挥重要作用。早衰症儿童会死于影响数百万正常衰老成人的相同疾病——动脉硬化,但患儿死亡的平均年龄为14.5岁。早衰症疾病表现包括严重发育不全、硬皮病样皮肤、全身脂肪营养不良、脱发、关节挛缩、骨骼发育不良、全身动脉粥样硬化加速、心血管功能下降和中风。据估计,在全球范围内,约有400例早衰症儿童患者。
早衰样核纤层蛋白病(progeroid laminopathies)是由核纤层蛋白A(lamin A)和/或Zmpste24基因的一系列突变引起的加速衰老的遗传,这些突变产生不同于早衰蛋白的法尼基化蛋白。虽然不产生早衰蛋白,但这些基因突变会导致与早衰蛋白有重叠但有区别的疾病表现。总的来说,在全球范围内,早衰样核纤层蛋白病的发病率可能高于早衰症。
lonafarnib是Eiger公司从默沙东授权获得,该药是一种特性鲜明的、处于后期开发阶段的、以法尼基转移酶为靶点的口服活性抑制剂,法尼基转移酶是通过名为异戊二烯化的过程参与蛋白质的修饰。早衰蛋白是一种法尼基化的异常蛋白,被认为不能被切割,导致与核膜紧密结合,从而导致核膜形态的改变和随后的细胞损伤。lonafarnib可阻断早衰蛋白的法尼基化,已被证实可显著降低早衰症儿童的死亡风险。
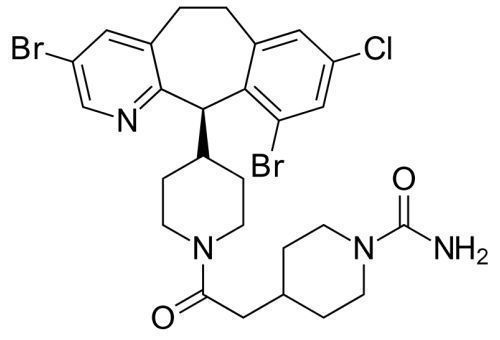
lonafarnib分子结构式(图片来源:Wikipedia)
除了治疗早衰症和早衰样核纤层蛋白病之外,Eiger公司也正在开发lonafarnib治疗丁型肝炎病毒(HDV)感染。2018年12月底,FDA和EMA分别授予了lonafarnib治疗丁型肝炎病毒感染(HDV)的突破性药物资格(BTD)和优先药物资格(PRIME)。lonafarnib可抑制肝细胞内HDV复制的异戊二烯化步骤,在病毒组装阶段阻断病毒生命周期。
来自多项II期临床研究的数据证实了基于lonafarnib的方案治疗HDV感染者的疗效和安全性,数据显示,在先前未接受治疗(初治)的HDV感染者中,基于lonafarnib的方案达到了使HDV RNA水平降低≥2log10以及丙氨酸氨基转移酶(ALT)正常化的联合主要终点,这反映了肝脏状况和病毒学应答的改善。目前,该药正处于一项关键性的HDV III期临床研究中。
丁型肝炎是由HDV感染引起,是最严重的一种人类病毒性肝炎类型。丁型肝炎仅在携带乙型肝炎病毒(HBV)的个体中作为共感染而发生,引发比乙型肝炎更严重的肝脏疾病,并且会加快肝纤维化、肝癌和肝功能衰竭。丁型肝炎是一种严重影响全球人类健康的疾病,该病可能影响全球大约1500万-2000万人。丁型肝炎在全球不同地区的流行情况各不相同。据报道,在全球范围内,大约4.3%-5.7%的慢性乙型肝炎病毒携带者存在HDV感染。在某些地区,包括外蒙古、中国、俄罗斯、中亚、巴基斯坦、土耳其、非洲、中东和南美等部分地区,慢性HBV感染者中HDV的患病率甚至更高,据报道,蒙古和巴基斯坦的HBV感染者中HDV的患病率高达60%(生物谷Bioon.com)
原文出处:Eiger BioPharmaceuticals Announces U.S. Commercial Availability of Zokinvy (lonafarnib), the First and Only Treatment approved for Progeria and Processing-Deficient Progeroid Laminopathies
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->