研究揭示LARP7介导U6修饰及其在生精细胞mRNA精准剪接和精子发生中的功能
来源:分子细胞科学卓越创新中心 2020-02-05 10:47
2月3日,国际学术期刊Molecular Cell 在线发表了中国科学院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所刘默芳研究组的最新研究成果“LARP7-Mediated U6 snRNA Modification Ensures Splicing Fidelity and Spermatogenesis in Mice”。该研究报道了LARP7蛋
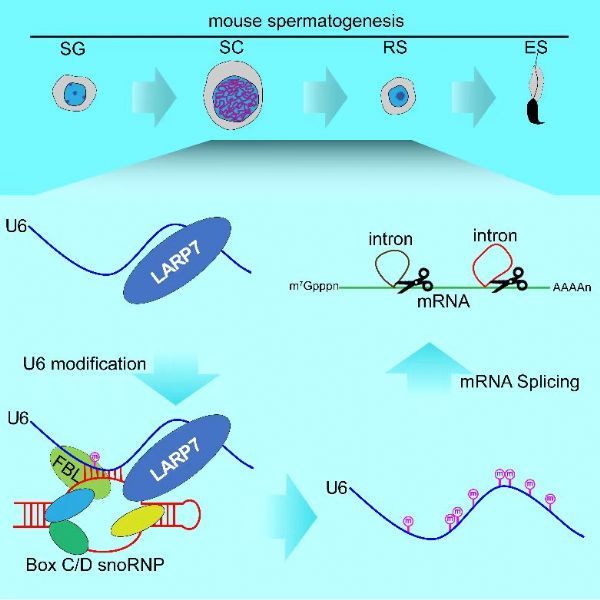
2月3日,国际学术期刊Molecular Cell 在线发表了中国科学院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所刘默芳研究组的最新研究成果“LARP7-Mediated U6 snRNA Modification Ensures Splicing Fidelity and Spermatogenesis in Mice”。该研究报道了LARP7蛋白通过促进U6 snRNA与具有RNA甲基化催化活性的box C/D snoRNP相互作用,介导了U6的2′-O-甲基化修饰,并进一步证明此过程为小鼠生精细胞中mRNA剪接保真性及精子发生必需。
在真核细胞中,绝大部分新转录mRNA转录本(Pre-mRNA)需经过剪接移除内含子,才能形成可翻译的成熟mRNA,此过程由包括五种snRNA(U1、U2、U4、U5、U6)及其相互作用蛋白组成的剪接体(spliceosome)催化完成。在5种剪接体snRNA中,U6的保守性最强,位于剪接体催化中心且为剪接体催化活性必需。U6存在多种修饰,其中2′-O-甲基化修饰最为丰富,多个U6修饰从酵母到人完全保守。然而,目前对这些修饰的调控机制及其与mRNA剪接之间的关系尚知之甚少。此外,哺乳动物的精子发生是一个复杂而精细的细胞分化过程,受到特定基因时空特异性的调控。与之一致的是,在哺乳动物成年个体中,相较于其他组织,睾丸组织的转录活性和可变间接频率都是最高的,但生精细胞中转录出来的大量mRNA是如何被快速而精确地剪接,领域中却鲜有报道。
刘默芳研究组与国内外多家实验室合作,以小鼠睾丸为研究系统,探索了U6 snRNA修饰的调控机制及其在mRNA剪接中的功能,发现一个在睾丸高表达的RNA结合蛋白LARP7,对生精细胞中U6的2′-O-甲基化修饰至关重要。已有研究发现,LARP7通过与7SK RNA结合,抑制RNA聚合酶II转录延伸,还有研究发现Larp7基因突变与人类Alazami综合征相关。进一步的机制研究揭示,LARP7同时结合U6和snoRNA,协助U6装载到box C/D snoRNP上,进而促使box C/D snoRNP中的甲基转移酶FBL对其进行2′-O-甲基化修饰。更重要的是,LARP7介导的U6 2′-O-甲基化修饰对小鼠生精细胞中的mRNA精确及精子发生至关重要,生殖细胞条件性敲除Larp7基因致小鼠雄性不育。此项研究揭示了U6 snRNA修饰的调控机制,并首次证明U6 2′-O-甲基化修饰对哺乳动物mRNA的精准剪接及精子发生至关重要。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->