2020年3月HIV研究亮点进展
来源:本站原创 2020-03-31 22:50
2020年3月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种
2020年3月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的3月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.bioRxiv:华人科学家开发出AIOD-CRISPR技术,可快速超灵敏地可视化检测SARS-CoV-2和HIV
doi:10.1101/2020.03.19.998724
随着近期导致2019年冠状病毒病(COVID-19)的病原体SARS-CoV-2疫情爆发,在一项新的研究中,康涅狄格大学健康中心生物医学工程系副教授Changchun Liu及其团队开发出一种称为“All-In-One-Dual CRISPR-Cas12a(AIOD-CRISPR)”的方法,以实现对SARS-CoV-2和HIV病毒的简单、快速、超灵敏的目视检测,旨在在家中或小型诊所中使用。相关研究结果于2020年3月21日发表在预印本服务器bioRxiv上,论文标题为“All-in-One Dual CRISPR-Cas12a (AIOD-CRISPR) Assay: A Case for Rapid, Ultrasensitive and Visual Detection of Novel Coronavirus SARS-CoV-2 and HIV virus”。
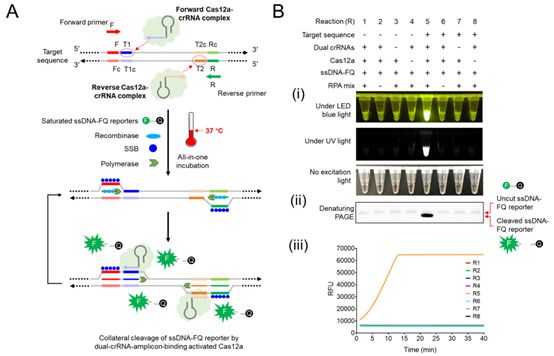
聚合酶链反应(PCR)方法目前被认为是疾病诊断的“金标准”。但是,PCR方法依赖于昂贵的设备和训练有素的人员。 Liu的方法与PCR不同,是等温的(?37°C),并且与其他等温扩增技术不同的是,它具有更好的灵敏度和特异性。
在Liu的实验室中,他的AIOD-CRISPR系统成功地检测出SARS-CoV-2和HIV的DNA和RNA。此外,通过检测从人血浆样品中提取的HIV-1 RNA,对这种方法进行了评估,它获得了与PCR方法相当的结果。
2.NEJM:Fostemsavir治疗多药耐药性HIV感染者
doi:10.1056/NEJMoa1902493
对已接受多种抗逆转录病毒治疗但效果不佳的HIV感染者,急需具有新作用机制的新型抗病毒药物。HIV融合抑制剂Fostemsavir是一种潜在选择。
在23个国家开展的III期临床研究中,多药耐药HIV-1感染患者分为两组。在第一组中,患者在接受1-2种获批的抗逆转录病毒药物(与先前疗法不同)基础上,随机接受Fostemsavir (每天2次,每次600mg)或安慰剂,为期8天, 随后接受Fostemsavir联合优化背景疗法(随机队列)。在第二个队列中,无可替换抗逆转录病毒药物选择的患者在第1天开始接受开放标签的Fostemsavir联合优化背景治疗(非随机队列)。研究的主要终点是随机队列中HIV-1RNA水平从第1天到第8天的平均变化。
共371名患者参与研究,其中随机队列272名,非随机队列99名。第8天,Fostemsavir组HIV-1RNA水平的平均下降0.79 log10拷贝/mL,安慰剂组为0.17 log10拷贝/mL。在第48周,随机队列中54%的患者和非随机队列中38%的患者出现了病毒应答(即HIV-1RNA水平<40个拷贝/毫升),CD4+T细胞计数的平均分别增加139个细胞/立方毫米和64个细胞/立方毫米。不良事件导致7%患者停用Fostemsavir。在随机队列中,47例病毒学失败患者中有20例(43%)出现糖蛋白120(gp120)替换。
研究认为,HIV融合抑制剂Fostemsavir可显著减少多药耐药HIV感染患者血液RNA水平。
3.Nat Med:免疫检查点抑制剂组合使用可显著缩小猴子中的HIV病毒库大小
doi:10.1038/s41591-020-0782-y
在一项新的研究中,研究人员得出结论,利用两种癌症免疫治疗药物组合使用刺激免疫细胞,可缩小感染了猿猴免疫病毒(SIV)并接受抗病毒药物治疗的非人灵长类动物中的病毒库大小。这种病毒库包括经过接受强效抗病毒药物治疗后仍携带SIV病毒的免疫细胞。相关研究结果近期发表在Nature Medicine期刊上,论文标题为“CTLA-4 and PD-1 dual blockade induces SIV reactivation without control of rebound after antiretroviral therapy interruption”。
在这篇论文中,这些研究人员使用了免疫检查点抑制剂伊匹单抗(ipilimumab)和纳武单抗(nivolumab)的猴子版本,它们分别阻断抑制性受体CTLA-4和PD-1(也是两种常见的免疫检查点)。他们观察到相比于仅接受纳武单抗的猴子,同时接受伊匹单抗和纳武单抗的猴子的T细胞具有更强的活化作用。对血液中的病毒DNA测序表明,与使用其中的一种免疫检查点抑制剂相比,两种免疫检查点抑制剂组合使用可重新激活更多的病毒。
Paiardini说,“我们观察到组合使用CTLA-4抑制剂和PD-1抑制剂可以有效地重新激活处于潜伏状态的HIV并使之对免疫系统可见。”
在以前的研究中,仅通过单一免疫检查点抑制剂或其他免疫刺激剂可以观察到HIV病毒库的有限缩小。在这项新的研究中,仅接受免疫检查点抑制剂组合治疗的猴子表现出这种病毒库大小的持续显著下降。这是通过“DNAscope”---一种可视化组织中受感染细胞的成像技术---和通过测量携带完整病毒DNA的CD4 T细胞(HIV和SIV的主要靶标)的频率进行测量的。尽管有这种效果,但一旦停用抗病毒药物,在接受免疫检查点抑制剂组合治疗的猴子中HIV病毒仍会恢复到先前的水平。
4.NEJM:临床试验表明HIV药物洛匹那韦-利托那韦不能有效治疗COVID-19
doi:10.1056/NEJMoa2001282; doi:10.1056/NEJMe2005477
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,中国研究人员发现有效治疗HIV感染者的药物对COVID-19无效。相关研究结果于2020年3月18日发表在NEJM期刊上,论文标题为“A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19”。在这篇论文中,他们描述了他们在中国武汉在COVID-19患者中开展的一项临床试验以及他们从中获得的发现。美国布莱根妇女医院的Lindsey Baden和Eric Rubin在同期NEJM期刊上发表了一篇标题为“Covid-19—The Search for Effective Therapy”的社论文章,讨论了这项在中国开展的临床研究。
最近,医学界注意到SARS-CoV-2和HIV都需要一种称为蛋白酶的酶才能具有传染性。先前的研究已发现蛋白酶抑制剂洛匹那韦(lopinavir)和利托那韦(ritonavir)对治疗HIV感染者有效,这使得许多人猜测它们是否也可能有效地抵抗SARS-CoV-2。为了确定这种情形是否可能发生,这些研究人员在中国武汉开启了一项临床试验。
这项临床试验将199例晚期COVID-19患者分为两组,其中的一组接受标准治疗(包括补充氧气),另一组接受标准治疗并给予洛匹那韦和利托那韦。最终,共有94例患者给予了这两种蛋白酶抑制剂。不幸的是,这些研究人员发现使用这两种药物没有益处。那些给予这两种药物的患者的表现并不好于那些没有给予它们的患者。
不过,这项临床试验存在一些局限。首先,所有患者均处于疾病晚期,这使得任何治疗都不太可能帮助他们。其次,这项临床试验规模很小。
5.一次注射,长期有效!美国开发新型HIV基因治疗技术
新闻来源:Drug-delivery technology leads to sustained HIV antibody production in NIH study
在美国国家卫生研究院(NIH)的一项临床试验中,一种引导人体产生一种针对艾滋病病毒的特定抗体的新方法让参与者持续产生了一年多的抗体。这种药物传递技术使用一种无害的病毒将一种抗体基因传递到人体细胞中,使人体能够在较长时间内产生抗体。据研究人员说,随着进一步的发展,这种策略可以应用于预防和治疗各种各样的传染病。美国国立卫生研究院国家过敏症和传染病研究所(NIAID)的研究人员于3月9日在2020年逆转录病毒和机会感染会议(CROI)的一次口头报告中报告了这一发现。
NIAID疫苗研究中心(VRC)的科学家开发的药物传递系统使用腺相关病毒 (AAV8)来传递抗体基因。AAV是一种不会引起人类疾病的小型病毒,已被证明是一种安全、耐受良好的基因治疗载体。在之前的动物模型研究中,VRC的研究人员发现,使用AAV8来传递猴免疫缺陷病毒(SIV)抗体的基因,可以使猴子安全产生高水平的抗SIV抗体,并保护它们不感染SIV。
在这项临床前工作的基础上,研究人员设计了一期临床试验,称为VRC 603。它的目的是评估携带抗艾滋病毒抗体基因的AAV8载体在控制良好的艾滋病毒携带者中的安全性和耐受性,并评估它是否会导致人类细胞产生抗体。该载体携带一种名为VRC07的抗艾滋病毒单克隆抗体的基因,这种抗体最初是从艾滋病毒感染者的血液中分离出来的。
VRC07是一种广泛中和抗体(bNAb),这意味着它可以在实验室中阻止多种艾滋病毒感染人类细胞。其他临床研究正在进行中,以确定回输bNAb是否可以保护人类不感染艾滋病毒。科学家们也在评估是否联合使用HIV bNAbs可以抑制HIV携带者体内的病毒。
由VRC 603的首席研究员Joseph P. Casazza博士所做的CROI报告描述了正在进行的试验的前八名参与者的初步结果,该试验正在马里兰州贝塞斯达的NIH临床中心进行。这些人的年龄在30到60岁之间,每一个人通过肌肉注射三种不同剂量的AAV8-VRC07中的一种,只接受一次注射。他们继续每天接受抗逆转录病毒治疗。
在注射AAV8-VRC07后,所有8名参与者产生的VRC07水平在血液中可检测到。VRC07的产量在注射后4-6周达到早期峰值,然后下降,在注射后16周左右开始缓慢回升。研究人员对五名接受低剂量或中等剂量AAV8-VRC07的参与者进行了一年半到两年的监测。在这五个人中,有三个人在注射一年后的抗体水平高于4至6周时的水平。到目前为止,接受最高剂量AAV8-VRC07的三名志愿者已经接受了5个月到1年的监测。其中两个人产生的VRC07浓度高于低、中剂量组。
注射AAV8-VRC07的研究参与者没有经历任何主要的副作用。一些志愿者在注射部位有短暂的轻微压痛或轻微的肌肉疼痛。
6.两篇NEJM指出HIV治疗新方法---每月肌肉注射长效卡博替韦和利匹韦林
doi:10.1056/NEJMoa1909512; doi:10.1056/NEJMoa1904398; doi:10.1056/NEJMe2002199
根据近期发表在NEJM期刊上的两项临床研究,对HIV-1受到抑制的患者而言,长效的卡博替韦 (cabotegravir,一种HIV整合酶抑制剂)和利匹韦林(rilpivirine)的组合使用(下称长效卡博替韦+利匹韦林)并不逊于口服度鲁特韦-阿巴卡韦-拉米夫定(dolutegravir-abacavir-lamivudine)和标准口服治疗。
英国伦敦女王玛丽大学的Chloe Orkin博士及其同事们进行了一项III期随机试验(称为FLAIR临床试验),该试验涉及遭受HIV-1感染的成年人,这些患者在20周内每天接受度鲁特韦-阿巴卡韦-拉米夫定口服诱导治疗。HIV-1 RNA水平低于50 copies/mL的参与者被随机分配继续进行现行口服治疗,或改用口服卡博替韦-利匹韦林治疗一个月,然后接受长效卡博替韦+利匹韦林治疗。这些研究人员发现,在48周时接受长效卡博替韦+利匹韦林和口服卡博替韦-利匹韦林治疗的HIV感染者中,分别有2.1%和2.5%的患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为-0.4%;置信区间为95%, -2.8至2.1),满足主要终点的非劣性标准(criterion for noninferiority)。
来自美国内布拉斯加大学医学中心的Susan Swindells博士及其同事们一项III期临床试验(称为ATLAS临床试验)中对血浆HIV-1 RNA水平低于50 copies/mL的患者在接受标准抗逆转录病毒药物(ART)口服治疗的至少6个月内随机分配继续进行ART治疗,或者改为每月肌肉注射长效卡博替韦和长效利匹韦林(每组308例患者)。这些研究人员发现,在接受长效卡博替韦+利匹韦林治疗和口服治疗的患者中,分别有1.6%和1.0%的患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为0.6%; 95%的置信区间为-1.2至2.5),满足主要终点的非劣性标准。
7.JVI:新研究有助揭示HIV进化之谜
doi:10.1128/JVI.01669-19
当查尔斯-达尔文理论化描述生存竞争如何推动自然选择时,他奠定了现代生物学的基石。如今,来自日本东京医科牙科大学的研究人员在人免疫缺陷病毒(HIV)感染的背景下研究了这种选择过程。他们展示了某些灵长类动物免疫缺陷病毒(primate immunodeficiency virus, PIV)如何获得在宿主保护措施起作用的恶劣环境中存活下来的能力。相关研究结果近期发表在Journal of Virology期刊上,论文标题为“Vpu of a Simian Immunodeficiency Virus Isolated from Greater Spot-Nosed Monkey Antagonizes Human BST-2 via Two AxxxxxxxW Motifs”。

病毒的目的是感染宿主细胞,并利用它们进行增殖和感染更多细胞。相反,包括免疫系统在内的动物防御系统则通过抑制诸如病毒之类的外来入侵者的增殖来保护宿主免受侵害。许多病毒通过寻找新方法来规避宿主的防御系统,以适应宿主不断施加的压力。这种防御系统中的重要角色之一是一种称为BST-2的蛋白,该蛋白可确保PIV不会从它们起源的细胞中释放出来。许多PIV产生一种称为病毒蛋白U(Vpu)的蛋白来拮抗宿主BST-2。
这些研究人员用表达来自猿猴免疫缺陷病毒(SIV)---可感染野生黑猩猩或多种猴子---的Vpu蛋白的病毒感染人细胞,并发现仅来自感染大白鼻猴(greater spot-nosed monkey)的SIV病毒(SIVgsn)的Vpu才具有中和人BST-2的能力,因此能够有效地将病毒从人细胞中释放出来。
这些研究人员随后研究了人BST-2与这种特定Vpu之间的分子相互作用,并专门研究了Vpu中某个称为基序(motif)的氨基酸序列:AxxxxxxxW,该基序先前已被发现对Vpu与BST-2之间的相互作用很重要。有趣的是,他们发现来自SIVgsn的Vpu具有两个这样的基序,并且只需要其中一个就可以让来自它的自然宿主---大白鼻猴---的BST-2失活,但让人BST-2失活则需要这两个基序。
8.Sci Trans Med:急性抗病毒疗法有助于缩小HIV病毒库
doi:10.1126/scitranslmed.aav3491
在抗逆转录病毒疗法(ART)期间,HIV会通过整合在宿主免疫细胞基因组中,形成“病毒库”,这是抗逆转录病毒疗法不能最终治愈患者的原因。研究团队多年来一直努力探究抗逆转录病毒治疗期间HIV病毒库是如何形成的。近日,一项新的研究表明,最早建立的“病毒库”在早期阶段仍然是“敏感的”,立即启动抗逆转录病毒治疗后可能会缩小约100倍。
在《Science Translational Medicine》上发表的这项研究中,研究人员提供了对早期HIV感染关键阶段中发生的事件的见解。“在早期阶段开始抗病毒治疗,通过清除肠道相关淋巴组织和淋巴结中大量的感染细胞池,从而大大减少了病毒库的大小。众所周知,淋巴结是感染过程中HIV优先建立病毒库的地方。
尽管这些早期接受治疗的患者的病毒库很小,但这种病毒仍然存在,因此,有人可能会怀疑这种疗法的临床益处。由于这些早期接受治疗的患者的病毒库比对照组小100倍,这些研究人员可以合理地认为,在接受抗逆转录病毒疗法的初始阶段,根除这些较小的病毒库相对更加容易。(生物谷 Bioon.com)
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的3月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.bioRxiv:华人科学家开发出AIOD-CRISPR技术,可快速超灵敏地可视化检测SARS-CoV-2和HIV
doi:10.1101/2020.03.19.998724
随着近期导致2019年冠状病毒病(COVID-19)的病原体SARS-CoV-2疫情爆发,在一项新的研究中,康涅狄格大学健康中心生物医学工程系副教授Changchun Liu及其团队开发出一种称为“All-In-One-Dual CRISPR-Cas12a(AIOD-CRISPR)”的方法,以实现对SARS-CoV-2和HIV病毒的简单、快速、超灵敏的目视检测,旨在在家中或小型诊所中使用。相关研究结果于2020年3月21日发表在预印本服务器bioRxiv上,论文标题为“All-in-One Dual CRISPR-Cas12a (AIOD-CRISPR) Assay: A Case for Rapid, Ultrasensitive and Visual Detection of Novel Coronavirus SARS-CoV-2 and HIV virus”。

AIOD-CRISPR的设计和工作原理,图片来自bioRxiv, 2020, doi:10.1101/2020.03.19.998724
聚合酶链反应(PCR)方法目前被认为是疾病诊断的“金标准”。但是,PCR方法依赖于昂贵的设备和训练有素的人员。 Liu的方法与PCR不同,是等温的(?37°C),并且与其他等温扩增技术不同的是,它具有更好的灵敏度和特异性。
在Liu的实验室中,他的AIOD-CRISPR系统成功地检测出SARS-CoV-2和HIV的DNA和RNA。此外,通过检测从人血浆样品中提取的HIV-1 RNA,对这种方法进行了评估,它获得了与PCR方法相当的结果。
2.NEJM:Fostemsavir治疗多药耐药性HIV感染者
doi:10.1056/NEJMoa1902493
对已接受多种抗逆转录病毒治疗但效果不佳的HIV感染者,急需具有新作用机制的新型抗病毒药物。HIV融合抑制剂Fostemsavir是一种潜在选择。
在23个国家开展的III期临床研究中,多药耐药HIV-1感染患者分为两组。在第一组中,患者在接受1-2种获批的抗逆转录病毒药物(与先前疗法不同)基础上,随机接受Fostemsavir (每天2次,每次600mg)或安慰剂,为期8天, 随后接受Fostemsavir联合优化背景疗法(随机队列)。在第二个队列中,无可替换抗逆转录病毒药物选择的患者在第1天开始接受开放标签的Fostemsavir联合优化背景治疗(非随机队列)。研究的主要终点是随机队列中HIV-1RNA水平从第1天到第8天的平均变化。
共371名患者参与研究,其中随机队列272名,非随机队列99名。第8天,Fostemsavir组HIV-1RNA水平的平均下降0.79 log10拷贝/mL,安慰剂组为0.17 log10拷贝/mL。在第48周,随机队列中54%的患者和非随机队列中38%的患者出现了病毒应答(即HIV-1RNA水平<40个拷贝/毫升),CD4+T细胞计数的平均分别增加139个细胞/立方毫米和64个细胞/立方毫米。不良事件导致7%患者停用Fostemsavir。在随机队列中,47例病毒学失败患者中有20例(43%)出现糖蛋白120(gp120)替换。
研究认为,HIV融合抑制剂Fostemsavir可显著减少多药耐药HIV感染患者血液RNA水平。
3.Nat Med:免疫检查点抑制剂组合使用可显著缩小猴子中的HIV病毒库大小
doi:10.1038/s41591-020-0782-y
在一项新的研究中,研究人员得出结论,利用两种癌症免疫治疗药物组合使用刺激免疫细胞,可缩小感染了猿猴免疫病毒(SIV)并接受抗病毒药物治疗的非人灵长类动物中的病毒库大小。这种病毒库包括经过接受强效抗病毒药物治疗后仍携带SIV病毒的免疫细胞。相关研究结果近期发表在Nature Medicine期刊上,论文标题为“CTLA-4 and PD-1 dual blockade induces SIV reactivation without control of rebound after antiretroviral therapy interruption”。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
在这篇论文中,这些研究人员使用了免疫检查点抑制剂伊匹单抗(ipilimumab)和纳武单抗(nivolumab)的猴子版本,它们分别阻断抑制性受体CTLA-4和PD-1(也是两种常见的免疫检查点)。他们观察到相比于仅接受纳武单抗的猴子,同时接受伊匹单抗和纳武单抗的猴子的T细胞具有更强的活化作用。对血液中的病毒DNA测序表明,与使用其中的一种免疫检查点抑制剂相比,两种免疫检查点抑制剂组合使用可重新激活更多的病毒。
Paiardini说,“我们观察到组合使用CTLA-4抑制剂和PD-1抑制剂可以有效地重新激活处于潜伏状态的HIV并使之对免疫系统可见。”
在以前的研究中,仅通过单一免疫检查点抑制剂或其他免疫刺激剂可以观察到HIV病毒库的有限缩小。在这项新的研究中,仅接受免疫检查点抑制剂组合治疗的猴子表现出这种病毒库大小的持续显著下降。这是通过“DNAscope”---一种可视化组织中受感染细胞的成像技术---和通过测量携带完整病毒DNA的CD4 T细胞(HIV和SIV的主要靶标)的频率进行测量的。尽管有这种效果,但一旦停用抗病毒药物,在接受免疫检查点抑制剂组合治疗的猴子中HIV病毒仍会恢复到先前的水平。
4.NEJM:临床试验表明HIV药物洛匹那韦-利托那韦不能有效治疗COVID-19
doi:10.1056/NEJMoa2001282; doi:10.1056/NEJMe2005477
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,中国研究人员发现有效治疗HIV感染者的药物对COVID-19无效。相关研究结果于2020年3月18日发表在NEJM期刊上,论文标题为“A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19”。在这篇论文中,他们描述了他们在中国武汉在COVID-19患者中开展的一项临床试验以及他们从中获得的发现。美国布莱根妇女医院的Lindsey Baden和Eric Rubin在同期NEJM期刊上发表了一篇标题为“Covid-19—The Search for Effective Therapy”的社论文章,讨论了这项在中国开展的临床研究。
最近,医学界注意到SARS-CoV-2和HIV都需要一种称为蛋白酶的酶才能具有传染性。先前的研究已发现蛋白酶抑制剂洛匹那韦(lopinavir)和利托那韦(ritonavir)对治疗HIV感染者有效,这使得许多人猜测它们是否也可能有效地抵抗SARS-CoV-2。为了确定这种情形是否可能发生,这些研究人员在中国武汉开启了一项临床试验。
这项临床试验将199例晚期COVID-19患者分为两组,其中的一组接受标准治疗(包括补充氧气),另一组接受标准治疗并给予洛匹那韦和利托那韦。最终,共有94例患者给予了这两种蛋白酶抑制剂。不幸的是,这些研究人员发现使用这两种药物没有益处。那些给予这两种药物的患者的表现并不好于那些没有给予它们的患者。
不过,这项临床试验存在一些局限。首先,所有患者均处于疾病晚期,这使得任何治疗都不太可能帮助他们。其次,这项临床试验规模很小。
5.一次注射,长期有效!美国开发新型HIV基因治疗技术
新闻来源:Drug-delivery technology leads to sustained HIV antibody production in NIH study
在美国国家卫生研究院(NIH)的一项临床试验中,一种引导人体产生一种针对艾滋病病毒的特定抗体的新方法让参与者持续产生了一年多的抗体。这种药物传递技术使用一种无害的病毒将一种抗体基因传递到人体细胞中,使人体能够在较长时间内产生抗体。据研究人员说,随着进一步的发展,这种策略可以应用于预防和治疗各种各样的传染病。美国国立卫生研究院国家过敏症和传染病研究所(NIAID)的研究人员于3月9日在2020年逆转录病毒和机会感染会议(CROI)的一次口头报告中报告了这一发现。
NIAID疫苗研究中心(VRC)的科学家开发的药物传递系统使用腺相关病毒 (AAV8)来传递抗体基因。AAV是一种不会引起人类疾病的小型病毒,已被证明是一种安全、耐受良好的基因治疗载体。在之前的动物模型研究中,VRC的研究人员发现,使用AAV8来传递猴免疫缺陷病毒(SIV)抗体的基因,可以使猴子安全产生高水平的抗SIV抗体,并保护它们不感染SIV。
在这项临床前工作的基础上,研究人员设计了一期临床试验,称为VRC 603。它的目的是评估携带抗艾滋病毒抗体基因的AAV8载体在控制良好的艾滋病毒携带者中的安全性和耐受性,并评估它是否会导致人类细胞产生抗体。该载体携带一种名为VRC07的抗艾滋病毒单克隆抗体的基因,这种抗体最初是从艾滋病毒感染者的血液中分离出来的。
VRC07是一种广泛中和抗体(bNAb),这意味着它可以在实验室中阻止多种艾滋病毒感染人类细胞。其他临床研究正在进行中,以确定回输bNAb是否可以保护人类不感染艾滋病毒。科学家们也在评估是否联合使用HIV bNAbs可以抑制HIV携带者体内的病毒。
由VRC 603的首席研究员Joseph P. Casazza博士所做的CROI报告描述了正在进行的试验的前八名参与者的初步结果,该试验正在马里兰州贝塞斯达的NIH临床中心进行。这些人的年龄在30到60岁之间,每一个人通过肌肉注射三种不同剂量的AAV8-VRC07中的一种,只接受一次注射。他们继续每天接受抗逆转录病毒治疗。
在注射AAV8-VRC07后,所有8名参与者产生的VRC07水平在血液中可检测到。VRC07的产量在注射后4-6周达到早期峰值,然后下降,在注射后16周左右开始缓慢回升。研究人员对五名接受低剂量或中等剂量AAV8-VRC07的参与者进行了一年半到两年的监测。在这五个人中,有三个人在注射一年后的抗体水平高于4至6周时的水平。到目前为止,接受最高剂量AAV8-VRC07的三名志愿者已经接受了5个月到1年的监测。其中两个人产生的VRC07浓度高于低、中剂量组。
注射AAV8-VRC07的研究参与者没有经历任何主要的副作用。一些志愿者在注射部位有短暂的轻微压痛或轻微的肌肉疼痛。
6.两篇NEJM指出HIV治疗新方法---每月肌肉注射长效卡博替韦和利匹韦林
doi:10.1056/NEJMoa1909512; doi:10.1056/NEJMoa1904398; doi:10.1056/NEJMe2002199
根据近期发表在NEJM期刊上的两项临床研究,对HIV-1受到抑制的患者而言,长效的卡博替韦 (cabotegravir,一种HIV整合酶抑制剂)和利匹韦林(rilpivirine)的组合使用(下称长效卡博替韦+利匹韦林)并不逊于口服度鲁特韦-阿巴卡韦-拉米夫定(dolutegravir-abacavir-lamivudine)和标准口服治疗。

图片来源:NIAID。
英国伦敦女王玛丽大学的Chloe Orkin博士及其同事们进行了一项III期随机试验(称为FLAIR临床试验),该试验涉及遭受HIV-1感染的成年人,这些患者在20周内每天接受度鲁特韦-阿巴卡韦-拉米夫定口服诱导治疗。HIV-1 RNA水平低于50 copies/mL的参与者被随机分配继续进行现行口服治疗,或改用口服卡博替韦-利匹韦林治疗一个月,然后接受长效卡博替韦+利匹韦林治疗。这些研究人员发现,在48周时接受长效卡博替韦+利匹韦林和口服卡博替韦-利匹韦林治疗的HIV感染者中,分别有2.1%和2.5%的患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为-0.4%;置信区间为95%, -2.8至2.1),满足主要终点的非劣性标准(criterion for noninferiority)。
来自美国内布拉斯加大学医学中心的Susan Swindells博士及其同事们一项III期临床试验(称为ATLAS临床试验)中对血浆HIV-1 RNA水平低于50 copies/mL的患者在接受标准抗逆转录病毒药物(ART)口服治疗的至少6个月内随机分配继续进行ART治疗,或者改为每月肌肉注射长效卡博替韦和长效利匹韦林(每组308例患者)。这些研究人员发现,在接受长效卡博替韦+利匹韦林治疗和口服治疗的患者中,分别有1.6%和1.0%的患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为0.6%; 95%的置信区间为-1.2至2.5),满足主要终点的非劣性标准。
7.JVI:新研究有助揭示HIV进化之谜
doi:10.1128/JVI.01669-19
当查尔斯-达尔文理论化描述生存竞争如何推动自然选择时,他奠定了现代生物学的基石。如今,来自日本东京医科牙科大学的研究人员在人免疫缺陷病毒(HIV)感染的背景下研究了这种选择过程。他们展示了某些灵长类动物免疫缺陷病毒(primate immunodeficiency virus, PIV)如何获得在宿主保护措施起作用的恶劣环境中存活下来的能力。相关研究结果近期发表在Journal of Virology期刊上,论文标题为“Vpu of a Simian Immunodeficiency Virus Isolated from Greater Spot-Nosed Monkey Antagonizes Human BST-2 via Two AxxxxxxxW Motifs”。

图片来自Journal of Virology, 2019, doi:10.1128/JVI.01669-19。
病毒的目的是感染宿主细胞,并利用它们进行增殖和感染更多细胞。相反,包括免疫系统在内的动物防御系统则通过抑制诸如病毒之类的外来入侵者的增殖来保护宿主免受侵害。许多病毒通过寻找新方法来规避宿主的防御系统,以适应宿主不断施加的压力。这种防御系统中的重要角色之一是一种称为BST-2的蛋白,该蛋白可确保PIV不会从它们起源的细胞中释放出来。许多PIV产生一种称为病毒蛋白U(Vpu)的蛋白来拮抗宿主BST-2。
这些研究人员用表达来自猿猴免疫缺陷病毒(SIV)---可感染野生黑猩猩或多种猴子---的Vpu蛋白的病毒感染人细胞,并发现仅来自感染大白鼻猴(greater spot-nosed monkey)的SIV病毒(SIVgsn)的Vpu才具有中和人BST-2的能力,因此能够有效地将病毒从人细胞中释放出来。
这些研究人员随后研究了人BST-2与这种特定Vpu之间的分子相互作用,并专门研究了Vpu中某个称为基序(motif)的氨基酸序列:AxxxxxxxW,该基序先前已被发现对Vpu与BST-2之间的相互作用很重要。有趣的是,他们发现来自SIVgsn的Vpu具有两个这样的基序,并且只需要其中一个就可以让来自它的自然宿主---大白鼻猴---的BST-2失活,但让人BST-2失活则需要这两个基序。
8.Sci Trans Med:急性抗病毒疗法有助于缩小HIV病毒库
doi:10.1126/scitranslmed.aav3491
在抗逆转录病毒疗法(ART)期间,HIV会通过整合在宿主免疫细胞基因组中,形成“病毒库”,这是抗逆转录病毒疗法不能最终治愈患者的原因。研究团队多年来一直努力探究抗逆转录病毒治疗期间HIV病毒库是如何形成的。近日,一项新的研究表明,最早建立的“病毒库”在早期阶段仍然是“敏感的”,立即启动抗逆转录病毒治疗后可能会缩小约100倍。
在《Science Translational Medicine》上发表的这项研究中,研究人员提供了对早期HIV感染关键阶段中发生的事件的见解。“在早期阶段开始抗病毒治疗,通过清除肠道相关淋巴组织和淋巴结中大量的感染细胞池,从而大大减少了病毒库的大小。众所周知,淋巴结是感染过程中HIV优先建立病毒库的地方。
尽管这些早期接受治疗的患者的病毒库很小,但这种病毒仍然存在,因此,有人可能会怀疑这种疗法的临床益处。由于这些早期接受治疗的患者的病毒库比对照组小100倍,这些研究人员可以合理地认为,在接受抗逆转录病毒疗法的初始阶段,根除这些较小的病毒库相对更加容易。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


