2022年2月细胞外囊泡研究领域新进展
来源:本站原创 2022-02-28 19:10
2022年2月份细胞外囊泡相关发表了很多重磅级的研究成果,本文中,小编就对本月科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
2022年2月份细胞外囊泡相关发表了很多重磅级的研究成果,本文中,小编就对本月科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
图片来源:CC0 Public Domain
【1】
外泌体介导的SNHG7转移增强肺腺癌中的多西他赛耐药
doi:10.1016/j.canlet.2021.10.029
长链非编码RNA (Long noncoding RNA, lncRNA)小核仁RNA宿主基因7 (small nucleolar RNA host gene 7,
SNHG7)在包括肺腺癌(lung adenocarcinoma, LUAD)在内的多种癌症中被广泛报道。然而,SNHG7是否与LUAD多西他赛耐药有关尚不清楚。在目前的研究中,研究者发现SNHG7在多西他赛耐药细胞中高表达。通过功能分析,研究者确定了SNHG7的消声降低了LUAD细胞对docetaxel的IC值,抑制了LUAD细胞的增殖和自噬,并在巨噬细胞中逆转了M2的极化。在机制上,研究者发现SNHG7通过招募人抗原R (HuR)来稳定自噬相关基因自噬相关5 (ATG5)和自噬相关12 (ATG12)来促进自噬。此外,外泌体SNHG7从多西他赛耐药的LUAD细胞传递到亲本LUAD细胞,从而促进了多西他赛耐药。此外,外泌体SNHG7通过招募cullin 4A (CUL4A)诱导磷酸酶和张力素同源物(PTEN)泛素化和降解,激活磷脂酰肌醇3-激酶(PI3K)/AKT通路,促进巨噬细胞M2极化。综上所述,研究者认为外泌体SNHG7通过诱导自噬和巨噬细胞M2极化增强了LUAD细胞对多西他赛的耐药性。所有研究结果表明,SNHG7可能是缓解LUAD多西他赛耐药的一个有希望的靶点。
【2】
通过VCAM-1+内皮细胞外囊泡快速动员中性粒细胞
doi:10.1093/cvr/cvac012
急性心肌梗死2小时后血液中性粒细胞迅速增加。由于趋化因子升高,骨髓释放被认为是其来源,但趋化因子水平在损伤后24小时和中性粒细胞升高后达到峰值。这表明可能涉及其他非趋化因子依赖过程。内皮细胞(EC)激活促进细胞外囊泡(EVs)的快速释放,这已经成为细胞-细胞信号的重要手段,因此是一个潜在的与远端组织通信的机制。在这里,研究者发现心肌损伤会迅速动员中性粒细胞从脾脏到外周血,并在其到达损伤组织之前诱导其转录激活。等离子体EV成分的时间过程分析显示,VCAM-1轴承的EV成分有快速和选择性的增加。这些也富含miRNA-126的ev,在脾脏中优先积累,诱导局部炎症基因和趋化因子蛋白的表达,并将脾中性粒细胞动员到外周血中。利用CRISPR/Cas9基因组编辑,研究者生成了vcam -1缺失的ec - ev,并显示其缺失消除了ec - ev激发中性粒细胞动员的能力。此外,在体内抑制miRNA-126可以减少小鼠模型中心肌梗死的大小。该研究结果显示了一种新的ev依赖机制,可以将中性粒细胞从脾储备快速动员到外周血,并通过亲本细胞的遗传改变,建立了ev -通讯功能操纵的概念证明。
通过VCAM-1+内皮细胞外囊泡快速动员中性粒细胞
图片来源:
doi:10.1093/cvr/cvac012
【3】K-29链接的ardc4泛素化调节其在细胞外囊泡生物发生中的功能
doi:10.1002/jev2.12188
细胞外囊泡(ev)是细胞间通讯的重要媒介。然而,EV的生物发生机制仍然知之甚少。研究者们之前定义了Nedd4家族泛素连接酶的适配器Arrdc4 (Arrestin domain containing protein 4)在ev生物发生中的作用。在这里,研究者报道了Arrdc4的泛素化对其在EV分泌中的作用至关重要。研究者利用质谱技术鉴定了ardc4中5个潜在的泛素化赖氨酸残基。通过分析Arrdc4赖氨酸突变体,研究者发现赖氨酸270 (K270)对Arrdc4在EV生物发生中的功能至关重要。与Arrdc4相比,Arrdc4突变导致细胞释放的EV数量减少,二价金属转运体(DMT1)进入EV的数量减少。此外,研究者还观察到,在Arrdc4存在的情况下,DMT1活性降低,细胞内降解增加。K270被发现通过泛素连接酶nedd2 -2与K-29泛素链泛素化。因此,研究者研究结果揭示了K-29多聚泛素链在ardc4介导的EV生物发生和蛋白转运中的新作用。
【4】细胞外TIMP-1是结直肠肝转移的非侵入性独立预后标志物和潜在治疗靶点。
doi:10.1038/s41388-022-02218-9
肿瘤来源的细胞外囊泡(ev)对间质微结构的分子重新编程有助于转移前生态位的形成。研究者阐明了基质金属蛋白酶-1 (TIMP1)泡外组织抑制剂在肝微环境侵袭性细胞外基质(ECM)重构中帮助结直肠癌(CRC)肿瘤进展的作用。免疫组化分析显示,侵袭前沿基质TIMP1的高表达与结直肠肝转移患者的无进展生存期较差相关。分子分析表明,CRC - EV中TIMP1的富集是诱导受体成纤维细胞中TIMP1上调的主要因素。在机制上,研究者证明了ev介导的TIMP1上调在受体成纤维细胞诱导的ECM重构中。人类血清来源的ev重申了这一效应,为CRC释放活跃的ev进入患者血液循环,将恶性特征水平转移到受体细胞提供了强有力的证据。此外,ev相关的TIMP1与热休克蛋白HSP90AA结合,HSP90AA对人源血清ev的抑制减弱了TIMP1介导的ECM重构,使ev相关的TIMP1成为一个潜在的治疗靶点。最终,根据REMARK指南,研究者在三个独立的队列中证明,ev结合的TIMP1是结直肠肝转移患者非侵入性术前风险分层的一个强大的循环生物标志物。
【5】肿瘤来源的外泌体诱导免疫抑制巨噬细胞促进肝内胆管癌进展
doi:10.1002/hep.32387
巨噬细胞是实体肿瘤的重要组成部分,在不同的肿瘤微环境中具有不同的功能。外泌体是肿瘤细胞和微环境相互作用的必要介质。然而,在肝内胆管癌(ICC)疾病进展过程中,外泌体参与肿瘤细胞和巨噬细胞相互交谈的潜在机制尚未完全了解。研究者发现ICC肿瘤组织的巨噬细胞上调了免疫抑制分子程序性死亡配体1 (PD-L1)的表达水平。肿瘤组织中PD-L1巨噬细胞的增加有效抑制了T细胞免疫,与ICC患者的低生存率相关。高通量RNA测序分析鉴定了来自ICC细胞和人类原发性肝内胆道上皮细胞(HIBEpiC)的外泌体之间的miRNAs水平差异,结果显示miR-183-5p在ICC细胞来源的外泌体中升高。外泌体miR-183-5p抑制了巨噬细胞中磷酸酶和紧张素同源物(PTEN)的表达,进而影响磷酸化AKT (p-AKT)和PD-L1表达的升高。此外,使用ICC细胞来源的外泌体治疗的巨噬细胞在体外显著抑制T细胞免疫,并促进了体内ICC的生长和进展,这是通过阻断这些巨噬细胞的PD-L1可逆的。最后,临床资料显示血浆外泌体miR-183-5p水平上调与ICC患者根治性切除后预后不良相关。肿瘤来源的外泌体miR-183-5p通过miR-183-5p/PTEN/AKT/PD-L1通路上调表达PD-L1的巨噬细胞,促进ICC的免疫抑制和疾病进展。外泌体miR-183-5p是ICC进展的潜在预测性生物标志物,也是开发针对ICC免疫耐受特征的新治疗策略的潜在靶点。
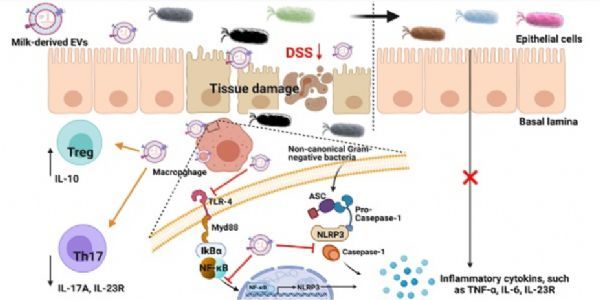
【6】牛奶来源的细胞外囊泡通过调节肠道免疫和重塑肠道微生物群来缓解溃疡性结肠炎
牛奶是人类饮食的重要组成部分,特别是对儿童来说,因为它丰富了各种营养。研究者最近开发了一种从牛奶中分离细胞外囊泡(mev)的有效方法,发现mev含有大量的免疫活性蛋白,并调节健康小鼠的肠道免疫和微生物群。在此,研究者旨在探讨mev对炎症性肠病的治疗作用。分别通过RNA测序和蛋白质组学分析mev中的microRNA和蛋白质含量,然后进行功能注释。用葡聚糖硫酸钠诱导小鼠溃疡性结肠炎(UC)。采用流式细胞术对肠道免疫细胞进行表型分析,16S rRNA测序分析肠道菌群。在小鼠UC模型中,研究者发现mev中丰富的蛋白质和microRNAs参与了免疫和炎症途径的调节,口服mev可以防止结肠缩短,减少肠道上皮破坏,抑制炎症细胞的浸润和组织纤维化。在机制上,mev通过抑制TLR4-NF-κB信号通路和NLRP3炎症小体激活来减轻炎症反应。此外,mev能够纠正炎症结肠中T辅助性17 (T helper type 17, Th17)细胞和白细胞介素- 10foxp3调节性T (Treg)细胞之间的平衡。UC患者紊乱的肠道菌群在mev治疗后也部分恢复。肠道微生物群与细胞因子的相关性表明,mev可能通过调节肠道免疫而影响肠道微生物群。这些结果表明,mev通过调节肠道免疫稳态,抑制TLR4-NF-κB和NLRP3信号通路,恢复Treg/Th17细胞平衡,重塑肠道菌群,缓解结肠炎。
牛奶来源的细胞外囊泡通过调节肠道免疫和重塑肠道微生物群来缓解溃疡性结肠炎
图片来源:
doi:10.7150/thno.62046
【7】液体活检:外泌体
microRNA 作为癌症的新型诊断和预后生物标志物
doi:10.1186/s12943-022-01525-9.
在临床表现前及早发现癌症可能是降低癌症死亡率的有效策略。因此,识别高效的液体活检生物标志物可能是一种有前途的非侵入性癌症诊断方法。液体活组织检查越来越多地被用作活组织检查的补充,因为它能在临床和放射学确诊前几个月检测到疾病进展。许多体液含有外泌体microRNAs (miRNAs),由于外泌体中miRNAs的稳定性,可为早期和微创癌症诊断提供一类新的生物标志物。在这篇综述中,研究者主要关注外泌体miRNAs(液体活检)作为各种癌症诊断和预后的生物标志物。外泌体miRNAs可作为诊断和预后的生物标志物,为各种恶性肿瘤的进展和治疗反应提供独特的见解和更动态的视角。因此,开发利用外泌体miRNAs的新技术和更敏感的技术应该是癌症管理的优先事项。
【8】阿尔茨海默病外泌体microRNA和mRNA的鉴定
doi:10.1016/j.arr.2021.101497
阿尔茨海默病(AD)是一种以记忆和认知功能减退为特征的进行性神经退行性疾病。外泌体携带多种重要信息,如母细胞的蛋白质、脂质、DNA和RNA。据报道,外泌体在神经系统生理和神经退行性疾病中发挥着重要作用。然而,外泌体在AD进展中的作用尚未完全阐明。在本研究中,研究者检测了AD小鼠和健康小鼠的外泌体中mRNA和miRNAs的表达模式。两组间共1320个mRNA和29个miRNA在外泌体中有差异表达。随后,通过qRT-PCR验证了AD小鼠中Chi3l1的下调和Rhog的上调。同时,采用qRT-PCR检测AD组miR-148a-5p表达下调和miR-27a-5p表达上调。通过GO和KEGG分析确定差异表达mRNA和miRNA潜在靶基因的功能。根据ceRNA假说,研究者建立了一个完整的circRNA-lncRNA-miRNA-mRNA的ceRNA网络。综上所述,外泌体lncRNAs、mrna、circRNAs和miRNAs参与了AD的进展,这些可能是AD可能的生物标志物和治疗靶点。
【9】外泌体 circLPAR1通过METTL3-eIF3h相互作用抑制BRD4,从而在结直肠癌诊断和肿瘤发生中发挥作用
doi:10.1016/j.arr.2021.101497
外泌体已成为多种癌症的重要生物标志物,并含有丰富的环状RNA (circRNAs)。然而,外泌体环状RNA用于诊断的潜力及其在结直肠癌(CRC)中的分子作用机制仍不清楚。CRC特异性外泌体环状RNA通过RNA测序、exoRBase数据库和组织芯片鉴定。在无癌对照组、癌前个体、CRC患者和其他类型癌症患者中评估血浆外泌体环状RNA的诊断性能。相应的生物学功能主要通过circRNA下拉、蛋白质组学分析和RNA免疫沉淀等方法进行评估。CircLPAR1包裹在外泌体中,具有很高的稳定性和可检测性,其在血浆外泌体中的表达在CRC发展过程中显著降低,但在术后恢复。外泌体circLPAR1结合常见的临床生物标志物CEA和CA19-9分析其表现,在CRC诊断中表现出癌特异性,并将其诊断效能提高到受试者工作特征曲线下的面积0.875。此外,circLPAR1在CRC组织中下调,并与总生存率相关。机制上,外泌体circLPAR1被CRC细胞内化,并抑制肿瘤生长,这可能是因为直接与eIF3h结合的外泌体circLPAR1特异性抑制了METTL3-eIF3h的相互作用,减少了癌基因BRD4的翻译。这项全面的研究强调血浆外泌体circLPAR1在CRC诊断中是一个有前途的预测因子,并描述了其在结直肠肿瘤发生中的生物学调节。本研究为临床早期诊断和疾病发展的发病机制提供了新的视角。
doi:10.1016/j.jid.2022.01.030
糖尿病足溃疡是一个主要的糖尿病并发症与未满足的需求。研究者研究了表皮干细胞(ESCs)和ESCs衍生的外泌体(ESCs- exo)在改善受损的糖尿病创面愈合中的作用及其机制。体外实验表明,ESCs-Exo能促进糖尿病成纤维细胞和巨噬细胞(Mφ)的增殖和迁移,促进替代性或M2 Mφ极化。在db/db小鼠的伤口中,与成纤维细胞外泌体(fibroblast exosomes, FB-Exo)和PBS对照相比,ESCs和ESCs- exo治疗可通过减少炎症、增加伤口细胞增殖、刺激血管生成和诱导M2 Mφ极化来加速伤口愈合。硅功能分析表明,ESCs-Exo-miRNAs靶基因主要参与稳态过程和细胞分化,并强调PI3K/AKT和TGFβ信号通路的调控。这在体外也得到了验证。总的来说,研究者的研究结果表明,ESCs和ESCs- exo在促进受损的糖尿病创面愈合方面同样有效,ESCs- exo治疗可能是一种有前途的、技术上具有优势的替代干细胞治疗方法。
生物谷2022年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。