Nature子刊:热量可控的CAR-T细胞可破坏实体瘤并阻止癌症复发
来源:本站原创 2021-08-23 13:53
在一项新的研究中,Kwong和他的合作者改变肿瘤微环境,并对他们自己的细胞进行一些修改,以加强CAR-T细胞对抗癌症的方式。他们在CAR-T细胞中加入了一个基因开关,并开发了一个遥控系统,将这些经过基因改造的T细胞精确地送入肿瘤微环境中,在那里它们杀死肿瘤并防止复发。
2021年8月23日讯/生物谷BIOON/---一种称为CAR-T细胞疗法的革命性免疫疗法已在引发肿瘤治疗变革。科学家们正在不断扩大CAR-T细胞疗法的精确度和能力。CAR-T细胞疗法已被患者、临床研究人员、投资者和媒体誉为治疗某些癌症的可行方法。
这是一个新的、蓬勃发展的免疫疗法领域,目前全世界有500多项临床试验正在分析CAR-T细胞的癌症治疗。CAR-T细胞疗法涉及在实验室里对从患者体内提取的T细胞进行基因改造,使之表达特异性识别癌细胞的嵌合抗原受体(CAR),然后将这些定制的CAR-T细胞输注回相同患者体内,在那里它们寻找并摧毁癌细胞。这就是它的作用机制。
美国佐治亚理工学院生物医学工程系副教授Gabe Kwong说,“这类免疫疗法已被证明对液体肿瘤---即在血液中循环的肿瘤,如白血病---的患者非常有效。不幸的是,对于实体瘤---肉瘤、癌瘤---它们的效果并不理想。有许多不同的原因。一个巨大的问题是,CAR-T细胞受到肿瘤微环境的免疫抑制。”
在一项新的研究中,Kwong和他的合作者改变肿瘤微环境,并对他们自己的细胞进行一些修改,以加强CAR-T细胞对抗癌症的方式。他们在CAR-T细胞中加入了一个基因开关,并开发了一个遥控系统,将这些经过基因改造的T细胞精确地送入肿瘤微环境中,在那里它们杀死肿瘤并防止复发。相关研究结果于2021年8月12日在线发表在Nature Biomedical Engineering期刊上,论文标题为“Enhanced intratumoural activity of CAR T cells engineered to produce immunomodulators under photothermal control”。

这项新的研究建立在Kwong实验室探索远程控制细胞疗法的工作基础上,在之前的这些工作中,他们通过局部的热量沉积可以精确地靶向肿瘤,无论它们在身体的什么地方。Kwong说,“这种热量基本上激活了肿瘤内的CAR-T细胞,克服了免疫抑制的问题。”
在早期的研究中,这些作者没有对肿瘤进行临床治疗,但是他们如今正在通过这项新的研究针对这一点进行研究。为了在小鼠的肿瘤中产生热量,他们从这些动物的身体外将激光脉冲照射到肿瘤所在的位置。递送到肿瘤上的金纳米棒将光波转化为局部的温和热量,将温度提高到40~42摄氏度(104~107.6华氏度),刚好足以激活CAR-T细胞的这个基因开关,但不会热到损害健康组织和这些经过基因改造的T细胞。一旦开启,CAR-T细胞就开始工作,增加抗癌蛋白质的表达。
Kwong说,真正的创新之处在于对临床级别的CAR-T细胞进行基因改造,这也是该团队在过去三年里所做的事情。如今,除了对热量作出反应的开关外,他们还对CAR-T细胞进行了一些升级,将它们重新连接起来,以产生刺激免疫系统的分子。这些强效的、经过设计的蛋白分子(细胞因子和双特异性T细胞衔接蛋白)的局部产生必须得到精确控制。
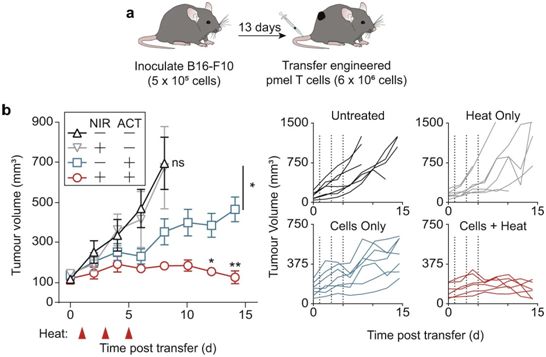
经过基因改造的Pmel-1 T细胞在高肿瘤负荷环境下增强过继性细胞治疗。图片来自Nature Biomedical
Engineering, 2021, doi:10.1038/s41551-021-00781-2。
Kwong说,“这些抗癌蛋白在刺激CAR-T细胞方面确实很好,但它们的毒性太大,无法在肿瘤外使用。它们的毒性太大,无法进行全身性递送。但是,通过我们的方法,我们可以安全地对这些蛋白质进行定位。我们得到了所有的好处,而没有缺点。”
这项新的研究显示,该系统治愈了小鼠所患的癌症,而且该团队的方法不仅缩小了肿瘤,而且防止了复发,这对长期生存至关重要。进一步的研究将深入研究对T细胞的额外定制,以及如何将热量沉积在肿瘤部位。温和的激光被用来加热肿瘤部位。当该技术进入人体研究时,情况就不会是这样了。
Kwong说,“我们将使用聚焦超声波,它是完全非侵入性的,可以针对身体的任何部位。激光的局限性之一是它不能在体内穿透很远。因此,如果你患有位于身体深处的恶性肿瘤,这将是一个问题。我们希望消除这个问题。”(生物谷 Bioon.com)
参考资料:
Ian C. Miller et al. Enhanced intratumoural activity of CAR T cells engineered to produce immunomodulators under photothermal control. Nature Biomedical Engineering, 2021, doi:10.1038/s41551-021-00781-2.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


