2023年1月Science期刊精华
来源:生物谷原创 2023-01-31 17:21
2023年1月份即将结束,1月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年1月份即将结束,1月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:揭示生发中心内的超竞争导致侵袭性B细胞淋巴瘤
doi:10.1126/science.abj7412
据威尔康奈尔医学院研究人员领导的一项多机构临床前新研究显示,了解最具侵袭性的淋巴瘤如何产生并抵抗当前疗法的关键可能在于破坏产生抗体的B细胞之间的一个关键自然选择过程的突变。相关研究结果发表在2023年1月20日的Science期刊上,论文标题为“BTG1 mutation yields supercompetitive B cells primed for malignant transformation”。

生发中心内的超竞争导致侵袭性B细胞淋巴瘤。图片来自Science, 2023, doi:10.1126/science.abj7412。
弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤类型,至少有40%的病例对治疗没有反应。携带主要在B细胞淋巴瘤中发现的BTG1(B-cell translocation gene 1)基因突变的患者具有极其较差的预后。
为了产生强大的抗体来对抗新的感染性病原体(比如SARS-CoV-2),B细胞经历了一个生长、抗体基因突变和极速细胞分裂的循环过程。数以千计的这些发送突变的B细胞激烈地竞争,以接触免疫系统中数量少得多的T细胞。这些T细胞只选择少数B细胞存货,这是基于它们结合抗原---病毒和其他微生物上引发免疫反应的外来颗粒---的能力。
2.Science:利用CRISPR-Cas9对CaMKIIδ进行碱基编辑可保护哺乳动物心脏免受缺血-再灌注
doi:10.1126/science.ade1105
在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员发现,利用CRISPR-Cas9基因编辑系统有可能在小鼠身上保护心脏免受缺血-再灌注(ischemia-reperfusion)。相关研究结果发表在2023年1月13日的Science期刊上,论文标题为“Ablation of CaMKIIδ oxidation by CRISPR-Cas9 base editing as a therapy for cardiac disease”。在这篇论文中,他们描述了使用这种基因编辑系统修改小鼠基因组中的两个碱基,以防止一种可导致心脏病的蛋白过度激活。

CaMKIIδ编辑在缺血-再灌注后保持人iPS细胞衍生的心肌细胞中的钙离子稳态。图片来自Science, 2023, doi:10.1126/science.ade1105。
先前的研究表明,一些人携带一种基因变体,使他们在生命的后期更容易受到一种叫做CaMKII delta(CaMKIIδ)的蛋白的过度激活(一种叫做缺血-再灌注的事件)的影响。这种过度激活可导致不规则的心跳,有时还会导致心力衰竭。在此类情况下,心肌和心脏组织可能被损坏,导致患者死亡或留下一个不太有效的心脏。在这项新的研究中,这些作者使用基因编辑来替换掉这种过度激活背后的基因成分,并用来自没有携带基因这种变体的捐赠者的基因成分---基因中的碱基---来取代它们。
这些作者选择使用CRISPR-Cas9基因编辑系统来交换基因碱基,利用他们所描述的“细尖消融笔(fine-tipped ablation pen)”对小鼠模型进行编辑。在他们的研究中,他们进行了两项实验。在第一项实验中,他们在CaMKIIδ过度激活事件发生前将小鼠体内的基因变体进行交换,以观察它是否会防止此类事件的发生。在第二项实验中,他们在CaMKIIδ过度激活事件发生后进行了交换,看看这样做是否能帮助心脏康复。他们发现,第一项实验将这种过度激活事件的几率降低到几乎为零,而第二项实验则改善了愈合和更好的心脏康复,导致了更少的永久性损伤。
3.Science:震惊!肠道微生物组在哺乳动物的大脑健康中起着关键作用
doi:10.1126/science.add1236
越来越多的证据表明,通常生活在我们肠道中的数万亿个微生物---所谓的肠道微生物组---对我们身体的功能有着深远的影响。这个微生物群落的成员产生维生素,帮助我们消化食物,防止有害细菌的过度生长,调节免疫系统,以及其他好处。如今,在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员发现肠道微生物组在我们的大脑健康中也起着关键作用。相关研究结果发表在2023年1月13日的Science期刊上,论文标题为“ApoE isoform– and microbiota-dependent progression of neurodegeneration in a mouse model of tauopathy”。
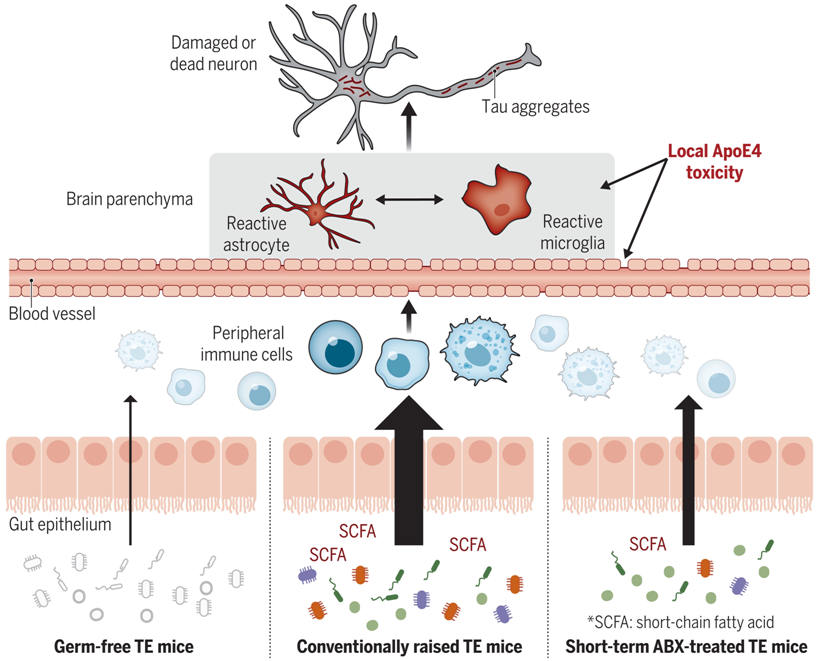
表达人APOE的P301S tau转基因小鼠。图片来自Science, 2023, doi:10.1126/science.add1236。
这项新的研究在小鼠身上发现,肠道细菌---部分是通过产生短链脂肪酸等化合物---影响整个身体的免疫细胞的行为,包括大脑中的免疫细胞,这些免疫细胞可以损害脑组织并加剧阿尔茨海默病等疾病中的神经退化。这一发现为重塑肠道微生物组作为预防或治疗神经变性的一种方式提供了可能性。
论文通讯作者、华盛顿大学圣路易斯医学院神经学教授David M. Holtzman博士说,“我们给年轻的小鼠服用抗生素仅一周,我们观察到它们的肠道微生物组、它们的免疫反应以及与一种叫做tau的蛋白有关的神经变性的程度随着年龄的增长而发生了永久性变化。令人激动的是,操纵肠道微生物组可能是对大脑产生影响的一种方式,而不需要将任何东西直接放入大脑。”
4.两篇Science论文揭示在动物胚胎发育过程中纤毛在身体建立左右是否对称方面起着重要作用
doi:10.1126/science.abq7317; doi:10.1126/science.abq8148
虽然人体在外部是左右轴对称的,但在包括心脏、肺部、肝脏、胃部和大脑在内的大多数内部器官的形状和位置上存在明显的左右不对称。已知在早期胚胎发育过程中,左右不对称性是由一小群称为左右组织者(left-right organizer)的细胞建立的。在左右组织者中,运动的纤毛(位于细胞表面上的毛发状结构)快速跳动,形成细胞外液的左向流动,这是左右差异的第一个外在表现。这种早期流动已被证明是区分左右的关键;然而,这种流动如何被感知并转化为左右不对称性,一直是未知的。
在一项新的研究中,来自美国哈佛医学院、麻省总医院、南加州大学和耶鲁大学的研究人员揭示了左右组织者中的纤毛起到了流动的创造者的作用,它们也作为流动施加的生物机械力的传感器来塑造发育中的胚胎的左-右身体构造(left-right body plan)。相关研究结果发表在2023年1月6日的Science期刊上,论文标题为“Cilia function as calcium-mediated mechanosensors that instruct left-right asymmetry”。

图片来自Science, 2023, doi:10.1126/science.abq7317。
他们发现纤毛是细胞表面的机械感应器,对发育中的身体和器官(比如心脏)的左右不对称性很重要。通过使用光学镊子对斑马鱼左右组织者中的纤毛施加机械力,他们发现左右组织者种的一部分纤毛能感知流动力并将流动力转化为控制斑马鱼左右发育的钙信号。
在另一项新的研究中,日本研究人员揭示了位于小鼠胚胎腹侧节点的不运动纤毛沿着背腹侧轴发生不对称的变形以应对这种流动。通过光学镊子对不运动纤毛施加机械刺激,诱发了靶细胞中的钙离子瞬态变化和Dand5信使RNA(mRNA)的降解。Pkd2通道蛋白优先定位于不运动纤毛的背侧,而钙离子瞬态变化主要是由指向腹侧的机械刺激引起的。这些研究结果揭示了位于胚胎腹侧节点的不运动纤毛感知液体流动方向的生物物理机制。
5.Science:重大进展!发现大脑中的一个新的膜层保护和监测大脑
doi:10.1126/science.adc8810
从神经网络的复杂性到基本的生物功能和结构,人类大脑只是不情愿地揭示了它的秘密。直到最近,神经成像和分子生物学的进步才使科学家能够在以前无法达到的细节水平上研究大脑,解开了它的许多奥秘。
在一项新的研究中,来自罗切斯特大学和哥本哈根大学转化神经医学中心联合主任Maiken Nedergaard以及哥本哈根大学神经解剖学教授Kjeld Møllgård医学博士及其团队描述了大脑解剖学的一个以前未知的组成部分,它既是一个保护屏障,也是免疫细胞监测大脑感染和炎症的平台。相关研究结果发表在2023年1月6日的Science期刊上,论文标题为“A mesothelium divides the subarachnoid space into functional compartments”。
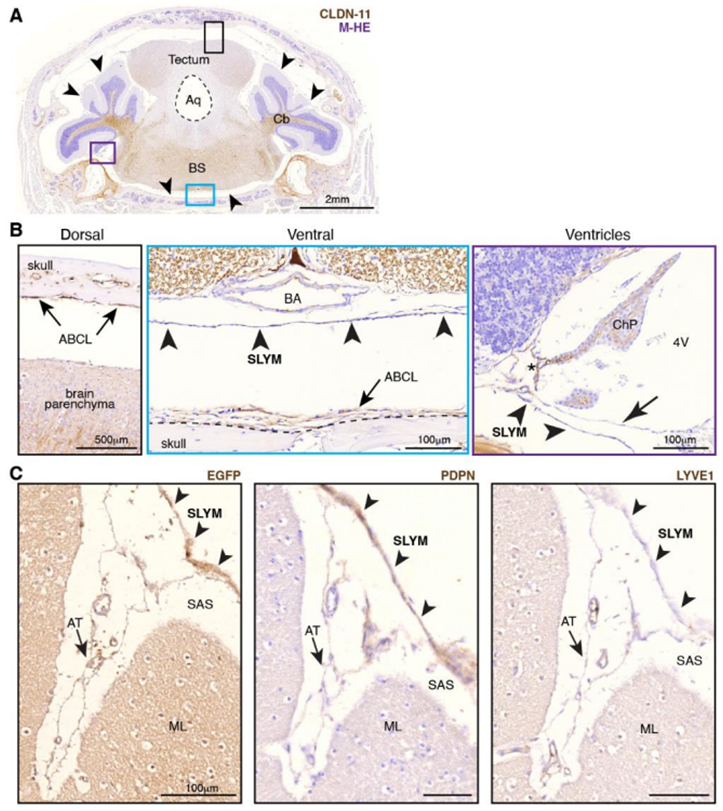
SLYM与蛛网膜结构不相对应。图片来自Science, 2023, doi:10.1126/science.adc8810。
这些作者改变了我们对人类大脑基本机制的理解,并在神经科学领域取得了重大发现,包括详细描述了以前被忽视的大脑神经胶质细胞的许多关键功能,以及大脑独特的废物清除过程,他们将这种废物清除过程命名为胶状淋巴系统(glymphatic system,也译为类淋巴系统)。
Nedergaard说,“如今发现了一个新的解剖结构,它隔离并帮助控制脑脊液(CSF)在大脑内部和周围的流动,使我们对CSF不仅在运输和清除大脑中的废物,而且在支持它的免疫防御方面发挥的复杂作用有了更多的了解。”
doi:10.1126/science.abj4784
迄今为止,癌症遗传学重点关注上皮恶性肿瘤,并能确定癌症易感性背后的多种组织类型特异性途径,肉瘤(sarcomas)是一种主要由胚胎中胚层衍生的罕见恶性肿瘤。近日,一篇发表在国际杂志Science上题为“Heritable defects in telomere and mitotic function selectively predispose to sarcomas”的研究报告中,来自新南威尔士大学等机构的科学家们通过对肉瘤进行全面的遗传图谱绘制,识别出了多种引起肉瘤的特殊基因,相关研究结果对于肉瘤患者及其家庭有着非常广泛的意义,有望尽可能早地帮助发现癌症并潜在改善患者的生存率。
肉瘤是一种主要产生于骨骼、肌肉、脂肪或软骨的罕见癌症,其通常好发于儿童和年轻群体,在20岁以下被诊断为癌症的患者中,肉瘤患者占到了大约20%的比例。到目前为止,科学家对肉瘤发生的遗传学背景知之甚少,这项研究中,研究人员绘制出了一张完整的图谱来揭示基因的遗传性如何影响遭受肉瘤折磨的患者和家庭。
研究者表示,每14个被诊断为肉瘤的个体中就有1人会携带临床重要的基因,这或许就能揭示为何其机体癌症会发生了。此外,研究人员还识别出了一种针对肉瘤特殊的此前未知的遗传学通路。Mandy Ballinger博士说道,本文研究结果非常重要,因为通过理解个体机体出现肉瘤的分子机制或能帮助尽可能早地检测癌症并开发出更好的疗法。26岁时被诊断为肉瘤的Jonathan Granek表示,这些研究结果对于肉瘤患者非常重要,接受肉瘤诊断可能是毁灭性的,相关研究结果或能为肉瘤患者提供希望,因为其会增加患者在早期和治愈阶段诊断的机会。
7.Science:揭示机体肺部发生致死侵袭性真菌感染背后的分子机制
doi:10.1126/scitranslmed.abq6682
诸如曲霉菌等真菌在我们周围非常常见,我们每天都会吸入成百上千个孢子,在健康人群中,真菌并不会对其健康构成威胁,但在免疫系统受损的人群中其却会引发致死性的感染;然而,如今人们越来越意识到,诸如SARS-CoV-2或流感等病毒性感染即使在健康人群中也会增加曲霉菌感染的风险。
WHO指出,侵袭性真菌感染对人类健康的威胁越来越大,因此WHO重申科学家们或许需要对其进行更多深入的研究;截止到目前为止,研究人员并不清楚曲霉菌是如何扎根以及人们应该如何摆脱其感染。近日,一篇发表在国际杂志Science Translational Medicine上题为“A B1a–natural IgG–neutrophil axis is impaired in viral- and steroid-associated aspergillosis”的研究报告中,来自卡尔加里大学等机构的科学家们通过研究揭示了致死性真菌侵袭机体肺部背后的分子机制。
研究者Nicole Sarden博士表示,我们发现,流感和COVID-19会破坏机体中此前未知的天然免疫,而我们需要这种天然免疫力来抵御侵袭性真菌感染。相关研究结果表明,名为中性粒细胞和特殊B细胞的两种类型白细胞能一起协同发挥作用来抵御真菌感染,然而,诸如SARS-CoV-2和流感病毒等病毒会阻碍特殊B细胞来发挥其作用。通过对小鼠和人类血液以及组织样本进行研究,研究人员表示,当发生病毒感染后,中性粒细胞会感知真菌感染并聚集在附近,但其并不会像预期一样来采取行动破坏入侵者;科学家们进一步研究发现,病毒分子会让这些B细胞变得麻木,从而使其不能像正常情况下那样与中性粒细胞合作,进而就能保护机体免遭真菌感染,而理解这一过程或有望帮助科学家们进行下一步的研究。
此外,研究人员还发现,当前的疗法或能被重新定向使用,从而取代被病毒破坏的B细胞无法产生天然的抗体,并重新建立中性粒细胞抵御这些感染的能力。医学博士Bryan Yipp说道,这项研究是由我们团队在重症监护室内进行护理的一个年轻患者发现的,其死于流感相关的曲霉病,而我们尝试的所有疗法最终都宣告失败;鉴于包括流感在内的多种呼吸道病毒会影响大量患者的健康,我们的研究发现非常及时。如今本文研究结果为后期科学家们开发新型诊断策略奠定了一定的基础,其是根据天然抗体的水平来预测哪些患者会出现高风险的侵袭性真菌感染,而且目前在临床试验中可用的抗体替代疗法已经被用来治疗人类的曲霉菌感染了。
8.Science:一种跨物种信号通路的发现解开了蜱虫免疫和发育的谜团
doi:10.1126/science.abl3837
在一项新的研究中,来自美国马里兰大学等研究机构的研究人员发现了节肢动物寄生虫和宿主之间的第一种物种间信号通路,在这种信号通路中,宿主动物血液中的分子触发了寄生虫的免疫和发育。这项新研究表明,当蜱虫摄入感染了导致莱姆病(Lyme disease)的细菌伯氏疏螺旋体(Borrelia burgdorferi)的小鼠血液时,来自小鼠免疫系统的一种蛋白与蜱虫细胞表面上的受体结合,并发出信号使器官更迅速地发育,在这种细菌本身开始感染蜱虫之前很长时间就产生了免疫反应。相关研究结果发表在2023年1月13日的Science期刊上,论文标题为“Dome1–JAK–STAT signaling between parasite and host integrates vector immunity and development”。
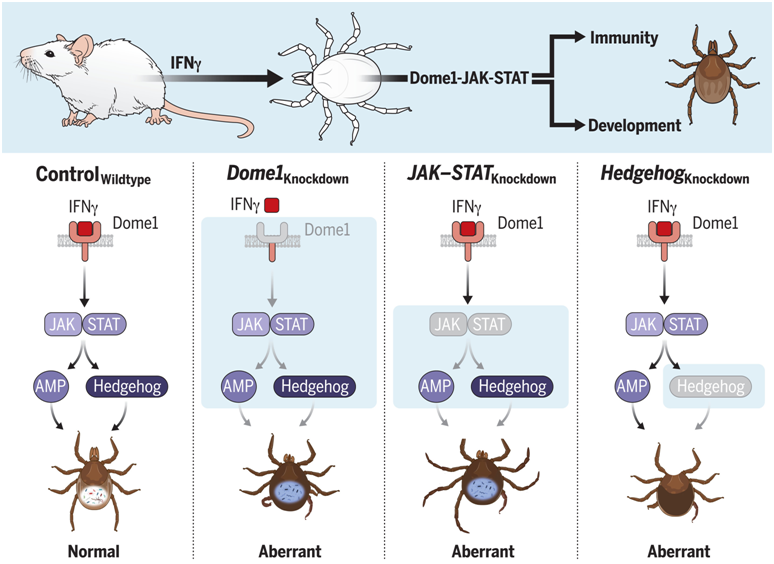
哺乳动物和节肢动物的交谈将病媒免疫和发育整合在一起。图片来自Science, 2023, doi:10.1126/science.abl3837。
这项新研究确定了开发抗蜱虫疫苗或治疗方法的一个潜在靶标,以防止像莱姆病这样的感染的传播。这些发现还为物种间生物分子相互依存关系的进化提供了重要的新见解,并首次强调了免疫和动物发育的一体化,以及所有植物和动物细胞用于感知和应对环境的古老细胞信号系统或途径的适应性。
论文通讯作者、马里兰大学动物医学系教授Utpal Pal说“一种保守的细胞信号通路的这种适应的灵活性令人惊讶。从海绵到人类都存在的这种通路是如此灵活,它可以适应接受来自另一种亲缘关系较远的物种的配体[结合分子],这很了不起。这种每个人都有的通路正在以一种我们没有想象到的方式被使用。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


