Science:重大进展!RNA疫苗让claudin-CAR-T细胞更有效地抵抗实体瘤
来源:本站原创 2020-01-21 12:46
利用经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)进行过继性T细胞治疗已在B细胞恶性肿瘤中取得了临床成功。然而,在实体瘤患者中,CAR-T细胞疗法遭遇调整,并不那么有效。一个关键的障碍是允许高效根除肿瘤的癌症特异性高表达和较低脱靶毒性(off-tumor/on-target toxicity )风险的细胞表面靶标在数量上的有限性。科学家们近期
2020年1月21日讯/生物谷BIOON/---利用经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)进行过继性T细胞治疗已在B细胞恶性肿瘤中取得了临床成功。然而,在实体瘤患者中,CAR-T细胞疗法遭遇挑战,并不那么有效。一个关键的障碍是允许高效根除肿瘤的癌症特异性高表达和较低脱靶毒性(off-tumor/on-target toxicity )风险的细胞表面靶标在数量上的有限性。
科学家们近期已报道了紧密连接蛋白6(claudin 6, CLDN6)的癌症相关表达。CLDN6是一种参与紧密连接(tight junction)形成的四跨膜蛋白。 在一项新的研究中,为了评估CLDN6是否可作为CAR-T细胞疗法的靶标,来自德国生物制药新技术公司(Biopharmaceutical New Technologies Corporation, BioNTech)的研究人员在一套完整的人类和小鼠组织中分析了它的表达。分析结果表明在人类中,CLDN6转录本水平在胎儿胃部、肺部和肾脏组织中较高,但在正常的成年人组织样本中检测不到。此外,与之前相一致的是,CLDN6转录本水平在诸如睾丸癌、卵巢癌、宫颈腺癌和肺腺癌之类的多种人类癌症中通常较高。而在小鼠中,CLDN6在胎儿器官中广泛表达,但在产前发生下调,从而导致它在成年小鼠的大多数器官中缺乏表达。这就表明CLDN6是一种严格意义上的癌胚细胞表面抗原,具有适合于CAR-T细胞靶向的理想表达谱。相关研究结果近期发表在Science期刊上,论文标题为“An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors”。
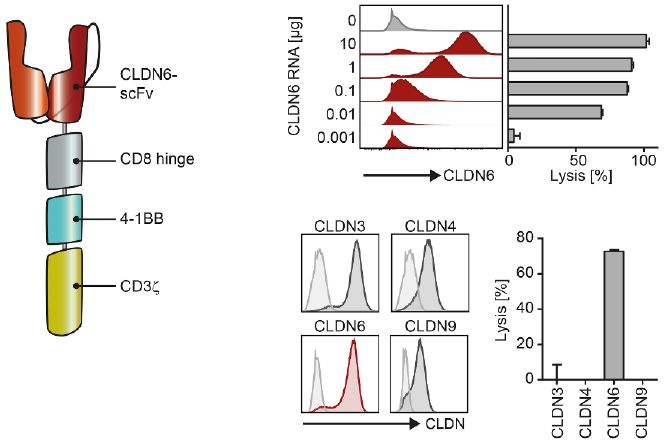
图片来自Science, 2020, doi:10.1126/science.aay5967。
这些研究人员设计出具有4-1BB共刺激结构域的CLDN6-CAR(即识别并结合CLDN6的CAR)。针对这种受体结构域,他们设计出一种单链可变区片段(scFv),这种scFv在纳米摩尔范围内对CLDN6具有高度的特异性和结合亲和力。他们发现经过基因改造后表达CLDN6-CAR的T细胞(CLDN6-CAR-T细胞)可高度灵敏地识别和杀死经过CLDN6 RNA转染的CLDN6阴性人肺癌细胞系COLO699N。此外,CLDN6-CAR-T细胞仅能杀死经过CLDN6 RNA转染的COLO699N细胞,但不能杀死与CLDN6存在较高氨基酸同源关系的CLDN3、CLDN4或CLDN9 RNA转染的COLO699N细胞。
当CLDN6-CAR-T细胞与CLDN6阳性人肿瘤细胞系共同培养时,他们观察到干扰素γ(IFNγ)分泌和T细胞活化标志物上调,但是当与CLDN6阴性肿瘤细胞共同培养时,这种情形不会发生。CLDN6-CAR-T细胞也能够高效地清除CLDN6阳性PA-1卵巢癌球状体。通过CRISPR/Cas9敲除CLDN6可完全废除CLDN6-CAR-T细胞对PA-1卵巢癌球状体的识别,这进一步证实了CLDN6-CAR-T细胞的高效力和靶标特异性。
接下来,这些研究人员研究了CLDN6-CAR-T细胞在皮下异种移植人肿瘤细胞系的NSG小鼠体内的抗肿瘤活性。这些小鼠接受单剂量人CLDN6-CAR-T细胞或对照细胞移植。相比于疾病快速进展的对照组小鼠,所有接受CLDN6-CAR-T细胞治疗的小鼠在2周内经历肿瘤完全消退。在注射后25天内,循环CLDN6-CAR-T细胞仍然能够在接受治疗的小鼠体内检测到。
为了评估这种方法是否具有更广泛的适用性,这些研究人员选择了与CLDN6具有较远的亲缘关系的CLDN18.2。CLDN18.2在多种具有较高医疗需求的肿瘤(比如胃食管癌和胰腺癌)中表达。在人类和小鼠中,它在正常组织中的表达局限于胃粘膜分化细胞的紧密连接处。他们通过用CLDN18.2特异性的scFv替换CLDN6特异性的scFv,构建出CLDN18.2-CAR和表达CLDN18.2-CAR的CAR-T细胞(简称为CLDN18.2-CAR-T)。CLDN18.2-CAR-T细胞表现出与CLDN6-CAR-T细胞相类似的功能特征。
移植的CAR-T细胞在体内的定植和持续存在是它们发挥临床疗效的关键。然而,就实体瘤而言,CAR-T细胞很难接触到它的肿瘤细胞,而且在免疫抑制肿瘤微环境中,CAR-T细胞接触靶细胞时缺乏增殖信号,因此CAR-T细胞所占的比例下降较快。
近年来,这些研究人员通过静脉注射携带抗原编码RNA的脂质体(liposomal antigen-encoding RNA, RNA-LPX)来刺激癌症患者的天然细胞库中的肿瘤相关T细胞。这种纳米颗粒疫苗将抗原递送到脾脏、淋巴结和骨髓中的抗原呈递细胞(APC),同时启动依赖于Toll样受体(TLR)的I型IFN驱动的免疫激活程序,从而促进抗原特异性T细胞的活化和强劲增殖。
为了验证这种方法经改进后是否可作为CAR-T细胞增强性RNA疫苗(CAR-T cell Amplifying RNA Vaccine, 简称CARVac)发挥作用,这些研究人员开展了一系列实验。首先,他们测试了CLDN6 是否在树突细胞表面上展示以便在体外刺激CLDN6-CAR-T细胞。他们检测到经过不同剂量的编码CLDN6 的RNA-LPX(简称CLDN6-LPX)处理的树突细胞表面上CLDN6的剂量依赖性表达。由此导致的树突细胞表面上的CLDN6表达以一种剂量依赖性的方式诱导了与树突细胞共同培养的CLDN6-CAR-T细胞的激活、细胞因子分泌和增殖。在给BALB/c小鼠静脉注射CLDN6-LPX后,CLDN6表达可在脾脏树突细胞和巨噬细胞表面上检测到,但在淋巴细胞表面上并未检测到,这就证实CLDN6在体内唯一地递送给抗原呈递细胞(比如树突细胞和巨噬细胞)。抗原呈递细胞经历成熟,而且在静脉注射CLDN6-LPX的小鼠的脾脏和淋巴结中检测到自然杀伤细胞(NK细胞)、B细胞和T细胞受到较强的激活。
接着,C57BL/6小鼠接受经过细胞增殖染料标记的CLDN6-CAR-T细胞移植,并接种CLDN6-LPX或对照RNA-LPX。相比于接种对照RNA-LPX的小鼠,来自接种CLDN6-LPX的小鼠的所有主要身体部位的脾脏和淋巴结显示增殖的CLDN6-CAR-T细胞比例显著增加,这表明CLDN6抗原在淋巴区室中发生广泛的功能性表达。
为了评估CARVac策略在体内的表现,这些研究人员让事先接受全身照射的小鼠接受CLDN6-CAR-T细胞移植。他们发现静脉注射单剂量CLDN6-LPX可导致循环CLDN6-CAR-T细胞显著增殖。这种增殖与CLDN6-LPX剂量水平相关。CLDN6-CAR-T细胞比例在接种CLDN6-LPX的3到4天后达到最高峰,随后发生下降。
在另一项实验中,多组小鼠接受不同剂量水平的CLDN6-CAR-T细胞注射,开始时低到每只小鼠注射1000个CLDN6-CAR-T细胞,随后在CLDN6-CAR-T细胞移植后不久接种或者不接种CLDN6-LPX。在不接种CLDN6-LPX的小鼠中,主要的CLDN6-CAR-T细胞定植与注射的细胞数量呈线性相关,而且随着时间的推移保持稳定,或者缓慢下降。值得注意的是,在接种CLDN6-LPX的小鼠中,CLDN6-CAR-T细胞发生增殖,这种增殖与初始注射的细胞剂量无关。CLDN6-LPX介导的1000个CLDN6-CAR-T细胞的增殖导致外周血中存在可检测到的CLDN6-CAR-T细胞水平。几乎全部移植的CLDN6-CAR-T细胞群体经历CLDN6-LPX介导的激活和增殖。相比于来自未接种CLDN6-LPX的小鼠的CLDN6-CAR-T细胞,来自接种CLDN6-LPX的小鼠的CLDN6-CAR-T细胞一旦与CLDN6阳性的肿瘤细胞共同培养时就会产生更高水平的IFNγ和表现出显著更高的抗原依赖性的溶细胞活性。此外,接受低剂量CLDN6-CAR-T细胞移植的小鼠受益于重复接种CLDN6-LPX。在接受高剂量CLDN6-CAR-T细胞移植的小鼠中,CLDN6-CAR-T细胞在体内的增殖在达到较高水平后保持稳定。
为了评估CLDN6-LPX重复接种对CLDN6-CAR-T细胞长期持续存在的影响,接受CLDN6-CAR-T细胞移植的小鼠接种三次周剂量的CLDN6-LPX,随后再进行两次具有更长无治疗间隔(treatment-free interval)---4周和4.5周---的CLDN6-LPX接种。首次CLDN6-LPX接种导致CLDN6-CAR-T细胞快速增殖超过了两个数量级,随后的每周接种维持较高水平的CLDN6-CAR-T细胞,从而导致它们在总外周血淋巴细胞中的比例超过了15%。
鉴于CAR-T细胞疗法的最突出的严重不良事件是细胞因子释放综合征(CRS),这些研究人员探索了CLDN6-CAR-T细胞与CARVac策略联合使用时全身性细胞因子释放发生增加的可能性。他们分析了在接受CLDN6-CAR-T细胞移植的小鼠在接种CLDN6-LPX后的血清IFNγ、IL6和NFα水平。除了IFNγ在早期发生轻度的短暂升高之外,并未观察到受测的促炎性细胞因子经历较大的上升。此外,单次接种或重复接种CLDN6-LPX的小鼠的脾脏在结构上并未显示出任何明显的病理变化;在小鼠接受CLDN6-LPX重复接种后的不同时间点上,它们的脾脏的细胞组成在CD11c+树突细胞和F4/80+巨噬细胞群体方面发生轻度的暂时性下降,而在T细胞、B细胞和NK细胞群体方面并未发生数量变化。
最后,在荷瘤小鼠中,它们在接受小鼠CLDN6-CAR-T细胞移植后,接受单次CLDN6-LPX或对照RNA-LPX接种。在未接种CLDN6-LPX的情形下,CLDN6-CAR-T细胞对肿瘤的控制是不完全的,而且肿瘤生长仅是受到延缓。相比之下,在10只接受CLDN6-CAR-T细胞和CLDN6-LPX联合治疗的小鼠中,有6只表现出对较大肿瘤的完全排斥,而且具有显著更高的中位生存期。当对荷瘤小鼠进行CLDN18.2-CAR-T细胞和CLDN18.2-LPX联合治疗时,它们也实现了类似的治疗结果。
接着,在携带CLDN6阳性OV90异种移植肿瘤的小鼠模型中,他们证实重复接种CLDN6-LPX可导致移植到这些小鼠体内的人CLDN6-CAR-T细胞发生特异性增殖。有效的肿瘤控制与CLDN6-CAR-T细胞在外周血中的较高比例相关联,从而证实接种CLDN6-LPX可导致CLDN6-CAR-T细胞在体内发生高效增殖和更好地持续存在。在小鼠的异种移植肿瘤模型中,进行CLDN18.2-CAR-T细胞和CLDN18.2-LPX联合治疗也可实现类似的治疗结果。
这些发现表明CARVac可用于改善CAR-T细胞的抗肿瘤作用。这就为利用CAR-T细胞治疗难以治疗的实体瘤提供了一种新的策略。然而,这些结果是在临床前模型中实现的,它们是否在人体中也是如此,还有待开展进一步的研究加以验证。(生物谷 Bioon.com)
参考资料:
K. Reinhard et al. An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors. Science, 2020, doi:10.1126/science.aay5967.
科学家们近期已报道了紧密连接蛋白6(claudin 6, CLDN6)的癌症相关表达。CLDN6是一种参与紧密连接(tight junction)形成的四跨膜蛋白。 在一项新的研究中,为了评估CLDN6是否可作为CAR-T细胞疗法的靶标,来自德国生物制药新技术公司(Biopharmaceutical New Technologies Corporation, BioNTech)的研究人员在一套完整的人类和小鼠组织中分析了它的表达。分析结果表明在人类中,CLDN6转录本水平在胎儿胃部、肺部和肾脏组织中较高,但在正常的成年人组织样本中检测不到。此外,与之前相一致的是,CLDN6转录本水平在诸如睾丸癌、卵巢癌、宫颈腺癌和肺腺癌之类的多种人类癌症中通常较高。而在小鼠中,CLDN6在胎儿器官中广泛表达,但在产前发生下调,从而导致它在成年小鼠的大多数器官中缺乏表达。这就表明CLDN6是一种严格意义上的癌胚细胞表面抗原,具有适合于CAR-T细胞靶向的理想表达谱。相关研究结果近期发表在Science期刊上,论文标题为“An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors”。

图片来自Science, 2020, doi:10.1126/science.aay5967。
这些研究人员设计出具有4-1BB共刺激结构域的CLDN6-CAR(即识别并结合CLDN6的CAR)。针对这种受体结构域,他们设计出一种单链可变区片段(scFv),这种scFv在纳米摩尔范围内对CLDN6具有高度的特异性和结合亲和力。他们发现经过基因改造后表达CLDN6-CAR的T细胞(CLDN6-CAR-T细胞)可高度灵敏地识别和杀死经过CLDN6 RNA转染的CLDN6阴性人肺癌细胞系COLO699N。此外,CLDN6-CAR-T细胞仅能杀死经过CLDN6 RNA转染的COLO699N细胞,但不能杀死与CLDN6存在较高氨基酸同源关系的CLDN3、CLDN4或CLDN9 RNA转染的COLO699N细胞。
当CLDN6-CAR-T细胞与CLDN6阳性人肿瘤细胞系共同培养时,他们观察到干扰素γ(IFNγ)分泌和T细胞活化标志物上调,但是当与CLDN6阴性肿瘤细胞共同培养时,这种情形不会发生。CLDN6-CAR-T细胞也能够高效地清除CLDN6阳性PA-1卵巢癌球状体。通过CRISPR/Cas9敲除CLDN6可完全废除CLDN6-CAR-T细胞对PA-1卵巢癌球状体的识别,这进一步证实了CLDN6-CAR-T细胞的高效力和靶标特异性。
接下来,这些研究人员研究了CLDN6-CAR-T细胞在皮下异种移植人肿瘤细胞系的NSG小鼠体内的抗肿瘤活性。这些小鼠接受单剂量人CLDN6-CAR-T细胞或对照细胞移植。相比于疾病快速进展的对照组小鼠,所有接受CLDN6-CAR-T细胞治疗的小鼠在2周内经历肿瘤完全消退。在注射后25天内,循环CLDN6-CAR-T细胞仍然能够在接受治疗的小鼠体内检测到。
为了评估这种方法是否具有更广泛的适用性,这些研究人员选择了与CLDN6具有较远的亲缘关系的CLDN18.2。CLDN18.2在多种具有较高医疗需求的肿瘤(比如胃食管癌和胰腺癌)中表达。在人类和小鼠中,它在正常组织中的表达局限于胃粘膜分化细胞的紧密连接处。他们通过用CLDN18.2特异性的scFv替换CLDN6特异性的scFv,构建出CLDN18.2-CAR和表达CLDN18.2-CAR的CAR-T细胞(简称为CLDN18.2-CAR-T)。CLDN18.2-CAR-T细胞表现出与CLDN6-CAR-T细胞相类似的功能特征。
移植的CAR-T细胞在体内的定植和持续存在是它们发挥临床疗效的关键。然而,就实体瘤而言,CAR-T细胞很难接触到它的肿瘤细胞,而且在免疫抑制肿瘤微环境中,CAR-T细胞接触靶细胞时缺乏增殖信号,因此CAR-T细胞所占的比例下降较快。
近年来,这些研究人员通过静脉注射携带抗原编码RNA的脂质体(liposomal antigen-encoding RNA, RNA-LPX)来刺激癌症患者的天然细胞库中的肿瘤相关T细胞。这种纳米颗粒疫苗将抗原递送到脾脏、淋巴结和骨髓中的抗原呈递细胞(APC),同时启动依赖于Toll样受体(TLR)的I型IFN驱动的免疫激活程序,从而促进抗原特异性T细胞的活化和强劲增殖。
为了验证这种方法经改进后是否可作为CAR-T细胞增强性RNA疫苗(CAR-T cell Amplifying RNA Vaccine, 简称CARVac)发挥作用,这些研究人员开展了一系列实验。首先,他们测试了CLDN6 是否在树突细胞表面上展示以便在体外刺激CLDN6-CAR-T细胞。他们检测到经过不同剂量的编码CLDN6 的RNA-LPX(简称CLDN6-LPX)处理的树突细胞表面上CLDN6的剂量依赖性表达。由此导致的树突细胞表面上的CLDN6表达以一种剂量依赖性的方式诱导了与树突细胞共同培养的CLDN6-CAR-T细胞的激活、细胞因子分泌和增殖。在给BALB/c小鼠静脉注射CLDN6-LPX后,CLDN6表达可在脾脏树突细胞和巨噬细胞表面上检测到,但在淋巴细胞表面上并未检测到,这就证实CLDN6在体内唯一地递送给抗原呈递细胞(比如树突细胞和巨噬细胞)。抗原呈递细胞经历成熟,而且在静脉注射CLDN6-LPX的小鼠的脾脏和淋巴结中检测到自然杀伤细胞(NK细胞)、B细胞和T细胞受到较强的激活。
接着,C57BL/6小鼠接受经过细胞增殖染料标记的CLDN6-CAR-T细胞移植,并接种CLDN6-LPX或对照RNA-LPX。相比于接种对照RNA-LPX的小鼠,来自接种CLDN6-LPX的小鼠的所有主要身体部位的脾脏和淋巴结显示增殖的CLDN6-CAR-T细胞比例显著增加,这表明CLDN6抗原在淋巴区室中发生广泛的功能性表达。
为了评估CARVac策略在体内的表现,这些研究人员让事先接受全身照射的小鼠接受CLDN6-CAR-T细胞移植。他们发现静脉注射单剂量CLDN6-LPX可导致循环CLDN6-CAR-T细胞显著增殖。这种增殖与CLDN6-LPX剂量水平相关。CLDN6-CAR-T细胞比例在接种CLDN6-LPX的3到4天后达到最高峰,随后发生下降。
在另一项实验中,多组小鼠接受不同剂量水平的CLDN6-CAR-T细胞注射,开始时低到每只小鼠注射1000个CLDN6-CAR-T细胞,随后在CLDN6-CAR-T细胞移植后不久接种或者不接种CLDN6-LPX。在不接种CLDN6-LPX的小鼠中,主要的CLDN6-CAR-T细胞定植与注射的细胞数量呈线性相关,而且随着时间的推移保持稳定,或者缓慢下降。值得注意的是,在接种CLDN6-LPX的小鼠中,CLDN6-CAR-T细胞发生增殖,这种增殖与初始注射的细胞剂量无关。CLDN6-LPX介导的1000个CLDN6-CAR-T细胞的增殖导致外周血中存在可检测到的CLDN6-CAR-T细胞水平。几乎全部移植的CLDN6-CAR-T细胞群体经历CLDN6-LPX介导的激活和增殖。相比于来自未接种CLDN6-LPX的小鼠的CLDN6-CAR-T细胞,来自接种CLDN6-LPX的小鼠的CLDN6-CAR-T细胞一旦与CLDN6阳性的肿瘤细胞共同培养时就会产生更高水平的IFNγ和表现出显著更高的抗原依赖性的溶细胞活性。此外,接受低剂量CLDN6-CAR-T细胞移植的小鼠受益于重复接种CLDN6-LPX。在接受高剂量CLDN6-CAR-T细胞移植的小鼠中,CLDN6-CAR-T细胞在体内的增殖在达到较高水平后保持稳定。
为了评估CLDN6-LPX重复接种对CLDN6-CAR-T细胞长期持续存在的影响,接受CLDN6-CAR-T细胞移植的小鼠接种三次周剂量的CLDN6-LPX,随后再进行两次具有更长无治疗间隔(treatment-free interval)---4周和4.5周---的CLDN6-LPX接种。首次CLDN6-LPX接种导致CLDN6-CAR-T细胞快速增殖超过了两个数量级,随后的每周接种维持较高水平的CLDN6-CAR-T细胞,从而导致它们在总外周血淋巴细胞中的比例超过了15%。
鉴于CAR-T细胞疗法的最突出的严重不良事件是细胞因子释放综合征(CRS),这些研究人员探索了CLDN6-CAR-T细胞与CARVac策略联合使用时全身性细胞因子释放发生增加的可能性。他们分析了在接受CLDN6-CAR-T细胞移植的小鼠在接种CLDN6-LPX后的血清IFNγ、IL6和NFα水平。除了IFNγ在早期发生轻度的短暂升高之外,并未观察到受测的促炎性细胞因子经历较大的上升。此外,单次接种或重复接种CLDN6-LPX的小鼠的脾脏在结构上并未显示出任何明显的病理变化;在小鼠接受CLDN6-LPX重复接种后的不同时间点上,它们的脾脏的细胞组成在CD11c+树突细胞和F4/80+巨噬细胞群体方面发生轻度的暂时性下降,而在T细胞、B细胞和NK细胞群体方面并未发生数量变化。
最后,在荷瘤小鼠中,它们在接受小鼠CLDN6-CAR-T细胞移植后,接受单次CLDN6-LPX或对照RNA-LPX接种。在未接种CLDN6-LPX的情形下,CLDN6-CAR-T细胞对肿瘤的控制是不完全的,而且肿瘤生长仅是受到延缓。相比之下,在10只接受CLDN6-CAR-T细胞和CLDN6-LPX联合治疗的小鼠中,有6只表现出对较大肿瘤的完全排斥,而且具有显著更高的中位生存期。当对荷瘤小鼠进行CLDN18.2-CAR-T细胞和CLDN18.2-LPX联合治疗时,它们也实现了类似的治疗结果。
接着,在携带CLDN6阳性OV90异种移植肿瘤的小鼠模型中,他们证实重复接种CLDN6-LPX可导致移植到这些小鼠体内的人CLDN6-CAR-T细胞发生特异性增殖。有效的肿瘤控制与CLDN6-CAR-T细胞在外周血中的较高比例相关联,从而证实接种CLDN6-LPX可导致CLDN6-CAR-T细胞在体内发生高效增殖和更好地持续存在。在小鼠的异种移植肿瘤模型中,进行CLDN18.2-CAR-T细胞和CLDN18.2-LPX联合治疗也可实现类似的治疗结果。
这些发现表明CARVac可用于改善CAR-T细胞的抗肿瘤作用。这就为利用CAR-T细胞治疗难以治疗的实体瘤提供了一种新的策略。然而,这些结果是在临床前模型中实现的,它们是否在人体中也是如此,还有待开展进一步的研究加以验证。(生物谷 Bioon.com)
参考资料:
K. Reinhard et al. An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors. Science, 2020, doi:10.1126/science.aay5967.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


