2022年11月Cell期刊精华
来源:生物谷原创 2022-11-30 10:48
2022年11月份即将结束,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2022年11月份即将结束,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:在数千种病毒中发现CRISPR-Cas系统,有望改善细胞基因组编辑
doi:10.1016/j.cell.2022.10.020
对病毒基因组的系统性扫描揭示了大量潜在的基于CRISPR的基因组编辑工具。CRISPR-Cas系统在细菌和古生菌的微生物世界中很常见,它们经常帮助它们的宿主细胞抵御病毒。但是,在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员发现在公开的可感染这些微生物的病毒(称为噬菌体)的基因组序列中,CRISPR-Cas系统占0.4%。他们认为,这些病毒利用CRISPR-Cas彼此竞争---而且有可能也是为了操纵宿主的基因活性,使之对自己有利。相关研究结果发表在2022年11月23日的Cell期刊上,论文标题为“Diverse virus-encoded CRISPR-Cas systems include streamlined genome editors”。
在这项新的研究中,加州大学伯克利分校的分子生物学家Jennifer Doudna和微生物学家Jillian Banfield及其同事们决定在感染细菌和古生菌的病毒(即噬菌体)中更全面地寻找CRISPR-Cas系统。令他们吃惊的是,他们发现了大约6000种编码CRISPR-Cas系统的噬菌体,包括每一种已知类型的CRISPR-Cas系统的代表。Doudna说,“有证据表明,这些CRISPR-Cas系统是对噬菌体有用的系统。”
这些作者发现了在通常的CRISPR-Cas结构上存在着广泛的变异,一些CRISPR-Cas系统缺少组分,另一些CRISPR-Cas则异常紧凑。在法国国家科学研究中心研究噬菌体生态学和进化的Anne Chevallereau说,“即使噬菌体编码的CRISPR-Cas系统是罕见的,它们也是高度多样化和广泛分布的。大自然充满了惊喜。”
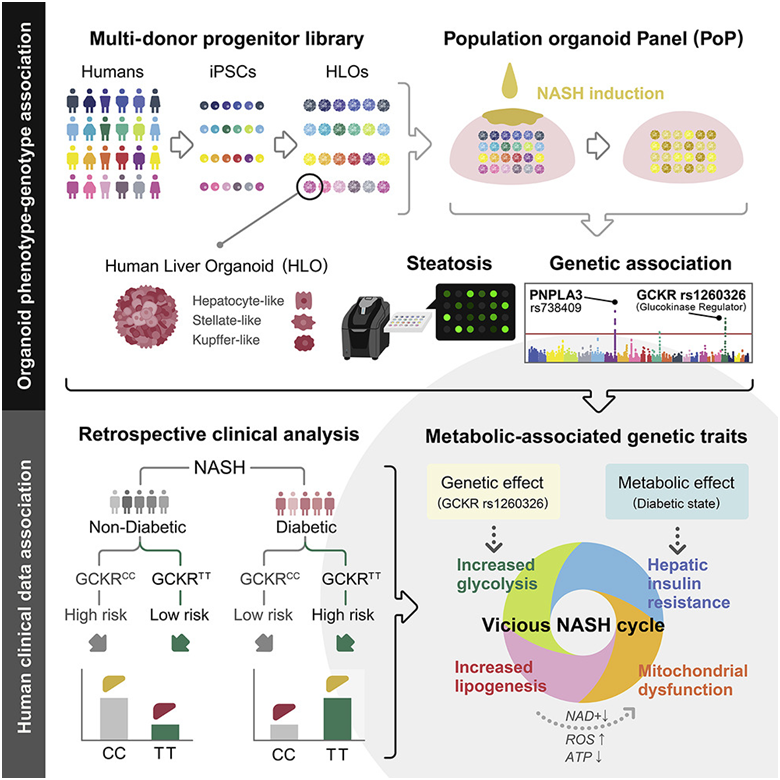
2.Cell:通过肝脏类器官揭示与GCKR-rs1260326突变有关的NAFLD/NASH风险非常高
doi:10.1016/j.cell.2022.09.031
众所周知,背景会影响许多领域。如今,在一项新的研究中,来自日本东京医科大学和美国辛辛那提儿童医院医疗中心的研究人员发现,患者的健康背景(health context)---患者的其他疾病--可以决定特定的基因突变是有益还是有害。他们揭示一种与肝脏疾病有争议关系的基因突变,根据患者是否患有糖尿病,给患者带来不同程度的风险。相关研究结果发表在2022年10月27日的Cell期刊上,论文标题为“En masse organoid phenotyping informs metabolic-associated genetic susceptibility to NASH”。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.031。
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是最常见的肝脏疾病,并可发展为涉及肝脏中脂肪堆积、损害和炎症的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)。已知的遗传变异仅解释了患有NAFLD/NASH风险的一小部分,而且科学家们对某些突变的重要性有不同意见。
为了更好地了解GCKR-rs1260326在NAFLD/NASH中的作用,这些作者从24名供者者身上提取细胞,并将它们培养成微小的肝脏样器官,即肝脏类器官(liver organoids)。他们给这些肝脏类器官提供额外的脂肪酸会导致脂肪堆积、炎症和胰岛素抵抗,这些特征在NASH患者的肝脏中都可以看到。他们然后密切分析了遗传变异和肝脏类器官特征之间的联系。
论文通讯作者Takanori Takebe说,“这些结果非常清楚。我们发现,在我们的肝脏类器官模型中,与GCKR-rs1260326突变有关的NAFLD/NASH风险非常高,尽管它很少被认为是有临床意义。”
携带两个GCKR-rs1260326突变拷贝的肝脏类器官比其他肝脏类器官更有效地从它们所在的环境中摄取脂肪,这解释了这种突变如何能患者患上脂肪肝。
出乎意料的是,对现实生活中患者数据的分析显示,伴有糖尿病的NASH患者的肝脏炎症水平根据这种突变的存在与否而有所不同:携带这个突变基因两个拷贝的糖尿病患者的肝脏炎症水平很高,而没有这个突变基因拷贝的糖尿病患者只表现出低水平的肝脏炎症。
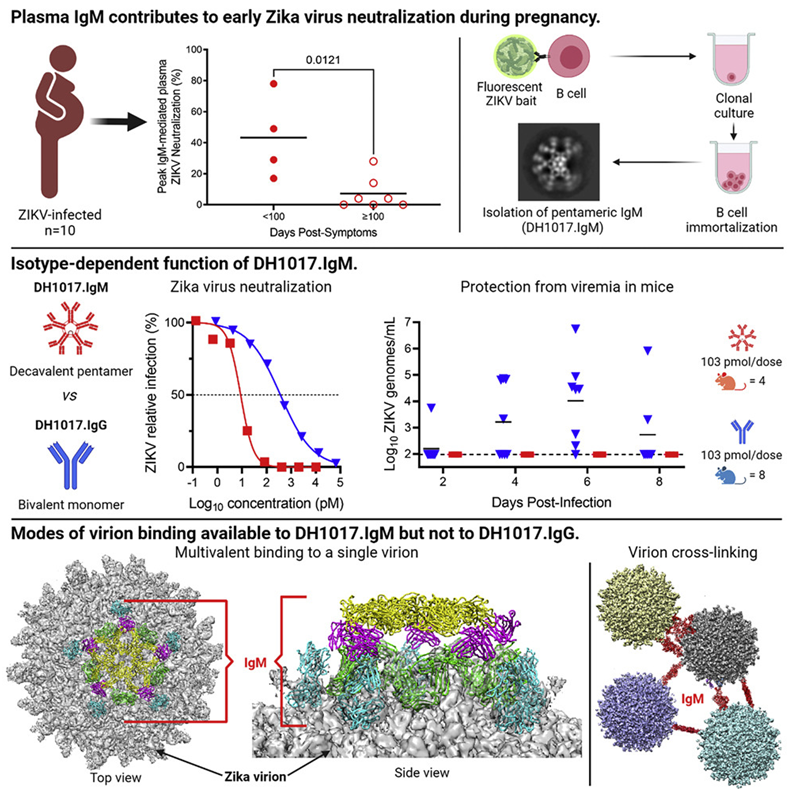
3.Cell:新研究发现一种强效抵抗寨卡病毒感染的人体IgM抗体
doi:10.1016/j.cell.2022.10.023
在一项新的研究中,来自美国威尔康奈尔医学院、纽约长老会和美国国立卫生研究院的研究人员发现了一种不寻常的抗体类型,即使在极小的水平上它也能中和寨卡病毒并使这种病毒感染在临床前模型中无法检测到。相关研究结果于2022年11月18日在线发表在Cell期刊上,论文标题为“A Zika virus-specific IgM elicited in pregnancy exhibits ultrapotent neutralization”。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.023。
在这项新的研究中,这些作者利用从感染寨卡病毒的孕妇身上提取的血细胞,分离出了一种超强的免疫球蛋白M(IgM)抗体---一种能抓住这种病毒的五臂免疫蛋白。在对小鼠的实验中,他们确定这种抗体不仅保护它们免受致命的感染,而且还抑制了这种病毒,使得它在血液中无法检测到。
就目前而言,医生没有批准的疫苗或治疗方法提供给患者。Permar博士说,随着进一步的研究,这种抗体有可能帮助填补这一空白。“它有两种潜在的使用方式:迅速降低已被感染的孕妇血液中的寨卡病毒水平,或者作为一种预防措施,提供给那些在疫情爆发期间有感染这种病毒风险的人。”
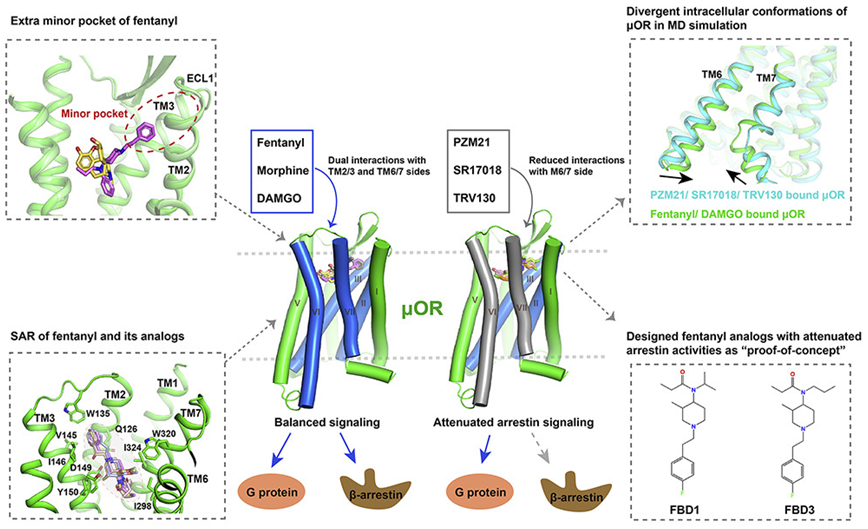
4.Cell:我国科学家揭示人类μ型阿片受体识别吗啡和芬太尼的分子机制
doi:10.1016/j.cell.2022.09.041
在一项新的研究中,来自中国科学院上海药物研究所的研究人员报告并分析了诸如芬太尼、吗啡和奥利替丁(oliceridine)之类的阿片类镇痛剂激活的人类μOR的高分辨率低温电镜(cryo-EM)结构,从而首次揭示了芬太尼和吗啡诱发μOR的识别和激活机制。相关研究结果发表在2022年11月10日的Cell期刊上,论文标题为“Molecular recognition of morphine and fentanyl by the human μ-opioid receptor”。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.041。
这些作者首先获得了人类μOR与平衡激动剂(比如芬太尼、吗啡)和拟肽Tyr-D-Ala-Gly-N-Me-Phe-Gly-ol(DAMGO)结合在一起时的三维结构。这些激动剂同时表现出G蛋白和arrestin的信号传导活性。他们还解析出μOR与G蛋白偏向性激动剂(比如TRV130、SR17018和PZM21)结合在一起时的三维结构。他们随后通过细胞水平的功能分析和分子动力学模拟分析了μOR在不同信号激动剂激活下的信号传导特性。他们的结果显示,与吗啡相比,芬太尼在μOR的细胞外侧TM2和TM3周围占据了一个额外的结合口袋。
此外,芬太尼的苯胺环侧链与氨基酸残基W295和Y328形成π-π疏水相互作用。芬太尼与μOR更广泛的相互作用导致芬太尼的效力比吗啡高50-100倍。基于芬太尼与μOR结合的结构,这些作者利用分子对接和诱变研究进一步探讨了芬太尼及其衍生物与μOR的结构-活性关系。他们发现,芬太尼和芬太尼类似物的效力与这些配体与μOR氨基酸残基(比如D149、Y150、W135和W320)的不同程度的相互作用高度相关。
doi:10.1016/j.cell.2022.10.017
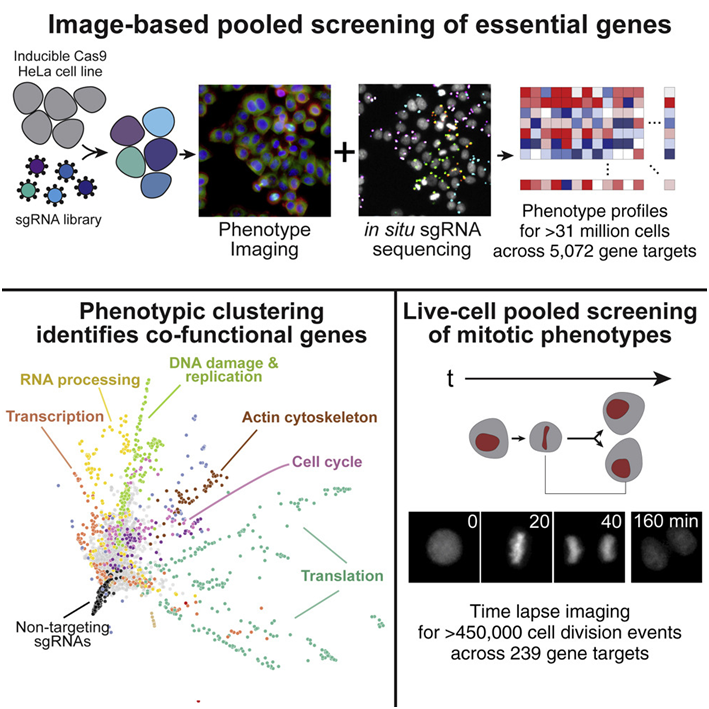
在一项新的研究中,来自美国怀特海德研究所和布罗德研究所的研究人员利用一种新颖的、集合的、基于成像的筛选方法系统性地评估了5000多个人类必需基因的功能。他们的分析利用CRISPR/Cas9来敲除基因活性,并形成了一种首创的资源,能够通过空间和时间分辨率了解和可视化观察基因在一系列细胞过程中的空间和时间分辨率。他们的研究涵盖了超过3100万个细胞,包括数百个不同参数的定量数据从而能够预测基因如何工作和共同运作。相关研究结果于2022年11月7日在线发表在Cell期刊上,论文标题为“The phenotypic landscape of essential human genes”。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.017。
论文共同通讯作者、怀特海德研究所成员Iain Cheeseman说,“在我的整个职业生涯中,我一直想看看当一个必需基因的功能被消除时,细胞中会发生什么。如今,我们可以做到这一点,不仅仅是针对一个基因,而是针对在培养皿中分裂的人类细胞中的每一个重要的基因,这是非常强大的。我们所创建的资源不仅会使我们自己的实验室受益,而且会使世界各地的实验室受益。”
这些作者评估了一种人类细胞系中5072个必需基因的功能。他们在这种筛选中分析了这些细胞中的四种标志物---DNA;DNA损伤反应,即一种检测和应对受损DNA的关键细胞途径;两种重要的结构蛋白:肌动蛋白和微管蛋白。
除了他们的初步筛选之外,这些作者还进行了较小的后续筛选,着重关注参与细胞分裂(也称为“有丝分裂”)的大约200个基因。这些基因在他们的初步筛选中被确定为在有丝分裂中发挥了明确的作用,但以前并没有与该过程相关。这些数据通过一个名为Vesuvius的配套网站提供,为其他科学家研究他们感兴趣的基因的功能提供了资源。
6.Cell:揭示幽门螺旋杆菌利用蛋白EgtUV摄取食物中的营养物麦角硫因来抵抗氧化应激
doi:10.1016/j.cell.2022.10.008
在一项新的额研究中,来自美国耶鲁大学的研究人员发现人类饮食中常见的一种营养物有助于一种致癌细菌的生存。这一发现可能揭示了一种重要靶标,用于开发治疗人类中许多传染性疾病的新药物。相关研究结果于2022年11月7日在线发表在Cell期刊上,论文标题为“A microbial transporter of the dietary antioxidant ergothioneine”。
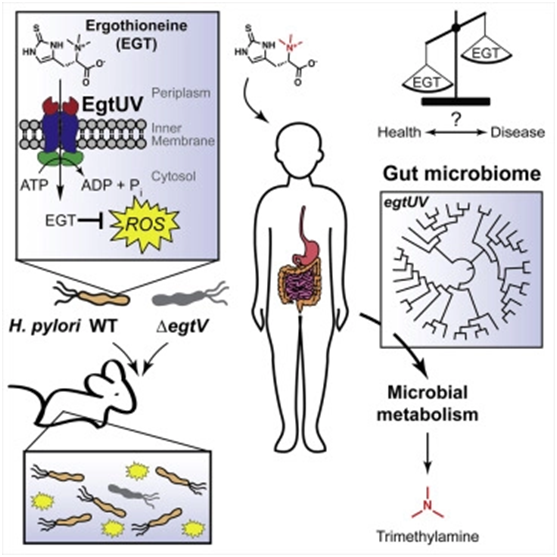
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.008。
这种称为麦角硫因(ergothioneine, EGT)的营养物是一种已知的抗氧化剂,被发现可以保护细菌免受氧化应激---体内活性氧(称为自由基)和抗氧化剂之间的不平衡,而氧化应激是许多致病感染的一种特征。
当免疫细胞产生含氧自由基来杀死有害细菌时,就会出现氧化应激。在这种情况下,细菌依靠可以对抗免疫系统产生的自由基的抗氧化剂分子来生存。尽管经过几十年的研究,某些细菌用来抵御我们体内的自由基的特定分子仍然是一个谜。
针对这一点,这项新的研究提供了重要的线索。这些作者发现细菌摄取在蘑菇、豆类和谷物等食物中含量丰富的EGT以帮助它们自身生存。就导致胃癌的病原菌幽门螺旋杆菌而言这种细菌利用这种营养物在宿主组织中成功地竞争生存。
doi:10.1016/j.cell.2022.10.001
吃了被污染的食物后有呕吐的冲动是身体摆脱细菌毒素的自然防御反应。然而,我们的大脑在检测到病菌后如何启动这一生物反应的过程仍然难以捉摸。在一项新的研究中,来自中国北京生命科学研究所、清华大学、广州医科大学、中国科学技术大学、首都医科大学和复旦大学的研究人员首次绘制了小鼠从肠道到大脑的防御反应的详细神经通路。这一发现可能有助于科学家们为接受化疗的癌症患者开发更好的抗恶心药物。相关研究结果发表在2022年11月10日的Cell期刊上,论文标题为“The gut-to-brain axis for toxin-induced defensive responses”。
论文共同通讯作者、北京生命科学研究所的Peng Cao博士和他的团队注意到,虽然小鼠不会呕吐,但它们会干呕---这意味着它们也会有呕吐的冲动,但不会吐出来。该团队发现,在接受了葡萄球菌肠毒素A(Staphylococcal enterotoxin A, SEA)后,小鼠出现了不正常的张嘴现象,其中SEA是一种由金黄色葡萄球菌产生的常见细菌毒素,也会在人类身上导致食源性疾病。
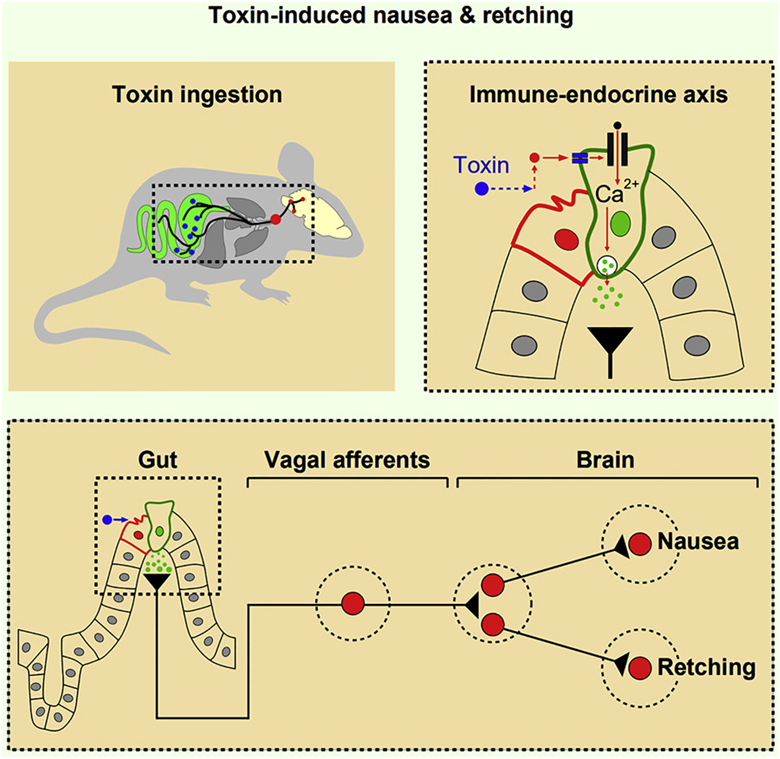
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.001。
接受SEA的小鼠张嘴的角度比在对照组小鼠观察到的要宽,因为对照组小鼠接受的是盐水。此外,在张嘴期间,接受SEA处理的小鼠的隔膜肌肉和腹部肌肉同时收缩,这是在狗呕吐时观察到的模式。在正常呼吸期间,动物的隔膜肌肉和腹部肌肉会交替收缩。
Cao说,“干呕的神经机制与呕吐的神经机制相似。在这个实验中,我们成功地建立了一种研究毒素引起的小鼠干呕的模式,通过这种模式,我们可以在分子和细胞水平上研究大脑对毒素的防御反应。”
在接受SEA处理的小鼠中,这些作者发现肠道中的SEA激活了肠腔内壁上的肠嗜铬细胞(enterochromaffin cell)释放神经递质血清素。释放的血清素与位于肠道的迷走神经感觉神经元上的受体结合,后者将这些信号沿着迷走神经从肠道传送到脑干的迷走神经背侧复合体中的特定类型的神经元----Tac1+DVC神经元。当Cao和他的团队使Tac1+DVC神经元失活时,与Tac1+DVC神经元活动正常的小鼠相比,经SEA处理的小鼠干呕的情况更少。
此外,该团队还研究了化疗药物是否会激活相同的神经通路,其中这些药物也会诱发患者出现恶心和呕吐等防御性反应。他们给小鼠注射了阿霉素(doxorubicin),即一种常见的化疗药物。这种药物使小鼠干呕,但当他们让它们的Tac1+ DVC神经元或它们的肠嗜铬细胞的血清素释放失活时,它们的干呕行为就明显减少。
8.Cell:新方法揭示了拷贝数变异对人类基因组和健康产生强大的影响
doi:10.1016/j.cell.2022.09.028
拷贝数变异(copy number variant, CNV)是基因组中在一些个体中重复或缺失的区域,是一种常见的让基因失去功能的突变。人类基因组包含数十万个CNV,但典型的基因组分析方法只检测到比较大的CNV,而且科学家们不确定它们中的大多数有什么作用。
如今,在一项新的研究中,来自美国布罗德研究所、布莱根妇女医院和哈佛医学院的研究人员开发出一种计算方法,在英国生物数据库中检测到1500万个CNV,比以前对相同数据的分析结果多出六倍。他们利用这种方法发现了这些CNV和几十种人类性状之间的数百种生物联系,揭示了特定基因和诸如身高、血细胞计数和健康的生物标志物之类的人类性状之间的新联系。相关研究结果发表在2022年10月27日的Cell期刊上,论文标题为“Influences of rare copy-number variation on human complex traits”。
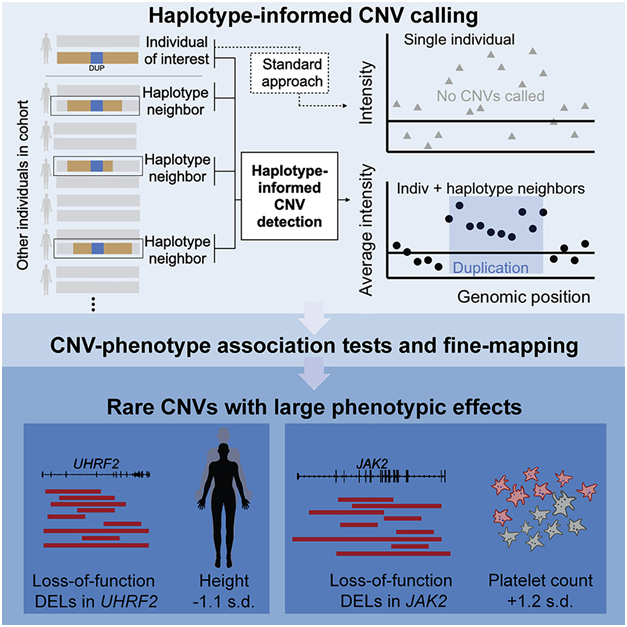
图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.028。
这些发现来自于迄今为止对CNV和性状之间联系的最彻底的分析,并提供了一种新的方法来检测和阐明以复杂方式影响基因组的较大结构变异(比如CNV)的影响。
论文共同通讯作者、布莱根妇女医院助理教授Po-Ru Loh说,“能够深入研究这些变异的潜力给了我们更多的机会来发现遗传变异影响人类表型的方式。在下游,它为我们提供了更多的线索来解释和理解遗传学和性状变异之间的复杂关联。”
9.Cell:存在30年的谜团终于解决!揭示WNK利用相分离让遭受应激的细胞恢复自身体积机制
doi:10.1016/j.cell.2022.09.042
在一项新的研究中,来自美国匹兹堡大学和卡耐基梅隆大学的研究人员在显微镜下拍摄了遭受应激的细胞的迷幻影片,这让他们踏上了解决一个谜团的旅程:细胞如何控制自身体积。他们的研究解释了科学家们如何利用一点偶然发现将30年前首次提出的这个谜团中的点连接起来。相关研究结果于2022年10月31日在线发表在Cell期刊上,论文标题为“WNK kinases sense molecular crowding and rescue cell volume via phase separation”。
论文共同第一作者、卡内基梅隆大学博士后研究员Daniel Shiwarski博士和他的妻子、论文共同第一作者Cary Boyd-Shiwarski博士描述如何将一个偶然的实验变成一个意外的发现时说道,“我们当时正在做与这项研究无关的活体荧光成像实验,当我们在细胞中加入盐溶液时,细胞质内部的物质迅速变成了荧光熔岩灯(lava lamp)。”

图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.042。
当细胞突然暴露在外部应激源下,如高浓度的盐或糖,它们的体积会减少。在20世纪90年代初,科学家们提出,细胞通过某种方式监测它的蛋白浓度或者说细胞内的“拥挤程度”来恢复它的体积。但是他们不知道细胞如何感觉到过度拥挤。然后,在21世纪初,人们发现了一类叫做With-No-Lysine激酶(With-No-Lysine kinase, WNK)。多年来,科学家们猜测WNK可逆转细胞萎缩,但它们如何做到这一点也是一个谜。
这项新的研究解决了这两个难题,揭示了WNK激酶如何激活一种“开关”,从而让细胞体积通过一种称为相分离(phase separation)的过程恢复平衡。论文通讯作者、匹兹堡大学医学院肾脏电解质科副教授Arohan R. Subramanya博士说,“细胞内部含有细胞质,通常人们认为细胞质是扩散的,在细胞质中多种分子漂浮在一种完美的混合溶液中。但是在我们对细胞质如何发挥作用的思考中发生了这种显著的改变。它真地就像一种乳剂,含有一堆小的、微小的蛋白团和液滴,然后当诸如过度拥挤之类的应激发生时,它们会聚集成大的液滴,通过可以用显微镜看到。”
这些液体状的液滴就是Shiwarski和Boyd-Shiwarski在那个决定性的日子里看到的“熔岩灯”,当时他们在实验室里向细胞中添加一种盐溶液。他们对WNK1进行了荧光标记,使它们扩散到整个细胞质上,导致整个细胞发光。当加入这种盐溶液时,WNK1聚集在一起,形成巨大的霓虹绿色小球,像熔岩灯中的粘液一样在细胞中渗出。他们将他们所看到的描述为相分离,也就是当WNK1与激活细胞中的盐分转运体SLC12的分子一起凝结成液滴。这一步骤允许细胞同时输入离子和水,使细胞的体积在几秒钟内恢复到原始状态。
10.Cell:适应性序列差异在人类中形成了新的促进神经发育的基因开关
doi:10.1016/j.cell.2022.10.016
在一项新的研究中,来自美国杜克大学的研究人员确定了一组人类DNA序列,它们驱动着大脑发育、消化和免疫方面的变化,这些变化似乎是在我们的家系从黑猩猩的家系中分离出来之后,但在我们与尼安德特人分裂之前就已经迅速进化。相关研究结果发表在2022年11月23日的Cell期刊上,论文标题为“Adaptive sequence divergence forged new neurodevelopmental enhancers in humans”。
与猿类相比,我们的大脑更大,我们的肠道更短。论文通讯作者、杜克大学医学院分子遗传学与微生物学助理教授Craig Lowe博士说,“在我们与黑猩猩的共同祖先分离以来的750万年里,我们认为独特的人类和人类特有的许多特征可能出现在这一时期。”
具体来说,这些称为人类祖先快速进化区(Human Ancestor Quickly Evolved Regions, HAQERS)的DNA序列调节基因。它们是告诉附近基因何时开启和关闭的开关。
Lowe说,基因组中这些区域的快速进化似乎对调节控制进行微调。随着序列成为调控区域,更多的开关被添加到人类基因组中,而且它们被更精细地调整以适应环境或发育线索。总体来说,这些变化对我们的物种是有利的。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


