2020年终盘点:2020年HIV重磅研究解读
来源:本站原创 2020-12-31 21:20
2020年12月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋
2020年12月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
迄今为止,全世界只报道了仅有的一名“柏林病人”Timothy Ray Brown被认为完全治愈了HIV。2007年,Brown在德国一家医院接受通过CCR5△32/CCR5△32基因型造血干细胞移植治疗白血病后,他体内的HIV病毒也完全消失了,成为世界上首例被“治愈”的艾滋病患者。2019年3月,一名被称为“伦敦病人”(London patient)的男性患者接受了HIV抵抗患者的骨髓移植后已经将近19个月没有出现HIV感染的迹象了,他很可能成为世界上第二名已知的被成功去除HIV的患者。
在即将过去的2020年,科学家们在HIV的病毒库、致病机制、检测和治疗等方面取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
1.Nat Commun:利用AAV9-CRISPR-Cas9基因编辑有望清除受感染细胞DNA中的HIV DNA
doi:10.1038/s41467-020-19821-7
猿猴免疫缺损病毒(SIV)是一种与人类免疫缺陷病毒(HIV)存在密切亲缘关系的病毒。在一项新的研究中,来自美国天普大学刘易斯-卡茨医学院和杜兰大学等研究机构的研究人员在HIV研究方面迈出了重要一步:他们成功地从非人灵长类动物的基因组中剔除了SIV。这一突破使得他们比以往任何时候都更接近开发治愈人类HIV感染的方法。相关研究结果近期发表在Nature Communications期刊上,论文标题为“CRISPR based editing of SIV proviral DNA in ART treated non-human primates”。
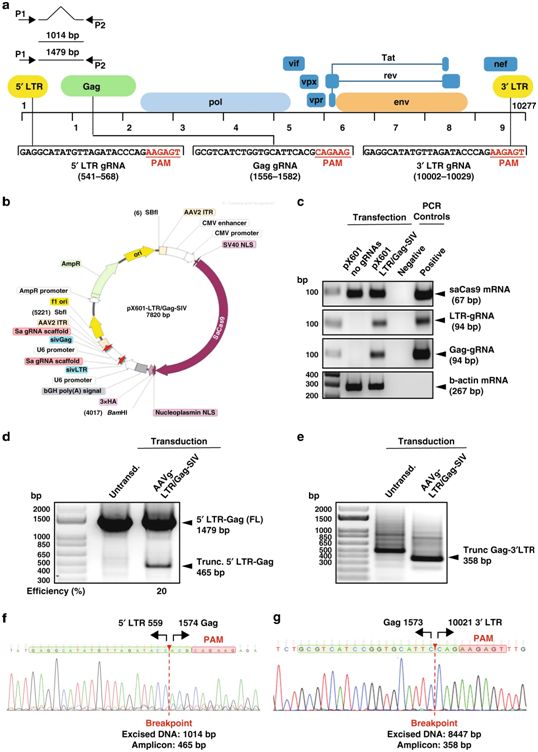
论文共同通讯作者、天普大学刘易斯-卡茨医学院综合神经艾滋病中心主任Kamel Khalili博士说,“我们首次发现,单次注射我们的由腺相关病毒(AAV)携带的CRISPR基因编辑构建体,可以从恒河猴的受感染细胞中剔除SIV基因组。”
2.Lancet:每8周1次的长效卡博特韦-利匹韦林治疗方案用于HIV感染者的治疗
doi:10.1016/S0140-6736(20)32666-0
在先前进行的III期ATLAS临床研究中,每4周1次的卡博特韦-利匹韦林肌肉注射的效果与口服抗病毒药物相当。在II期临床及模型研究中,每8周一次的卡博特韦-利匹韦林疗法也具有较好的治疗效果。近日研究人员比较了每8周vs 4周1次卡博特韦-利匹韦林治疗的抗HIV-1病毒效果。
ATLAS-2M研究在13个国家开展,为开放,IIIb期,非劣性研究,HIV-1感染患者每8周接受一次600mg卡博特韦联合900mg利匹韦林治疗或每4周接受一次400mg卡博特韦联合600mg利匹韦林治疗。研究的主要终点为48周时,每毫升血清HIV-1 RNA拷贝数大于50的患者比例,非劣性边界为4%。
1045名HIV感染者参与研究,其中8周治疗组522人,4周治疗组523人,其中391名患者来自ATLAS研究(37%)。参与者平均年龄42岁,27%为女性,73%为白人。研究结果显示,每8周1次卡博特韦联合利匹韦林治疗的效果与每4周1次治疗的效果相当,每毫升血清HIV-1 RNA拷贝数大于50的患者比例分别为2%和1%。8周治疗组8名患者(2%)以及4周治疗组2名(<1%)患者证实病毒学治疗失败。组间安全性相似,81%的患者报告了不良反应,无治疗导致的死亡发生。
对于HIV-1感染者,每8周1次卡博特韦联合利匹韦林治疗效果与每4周1次相当,研究支持每2个月1次的长效卡博特韦-利匹韦林治疗方案用于HIV-1感染者。
3.Science:重大进展!在体外重建HIV复制和整合过程,为开发靶向HIV衣壳的药物奠定基础
doi:10.1126/science.abc8420
在一项新的研究中,来自美国犹他大学医学院和弗吉尼亚大学的研究人员在试管中重现了导致获得性免疫缺陷综合征(AIDS,俗称艾滋病)的HIV(人类免疫缺陷病毒)感染的最初步骤,实现 了几十年来的梦想。这样做使得人们能够近距离观察HIV,并能够确定这种病毒在人类宿主体内复制所需的基本成分。相关研究结果发表在2020年10月9日的Science期刊上,论文标题 为“Reconstitution and visualization of HIV-1 capsid-dependent replication and integration in vitro”。
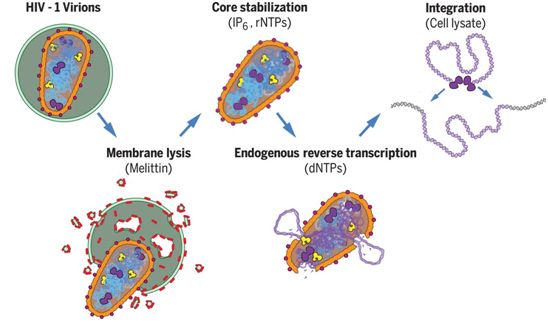
就HIV的所有危险性而言,这种病毒的外表却很简单。HIV类似于一个圆形的冰淇淋甜筒,它的外壳将它的遗传物质封装在里面。此前,人们一直认为,这个称为衣壳(capsid)的外壳的主要 作用是保护它的珍贵货物(即前面提及的遗传 物质)。但是,这项新的研究显示,HIV衣壳在感染过程中也发挥着积极作用。
在试管中进行感染的初始步骤,使得这些研究人员能够以以前不可能的方式精确地操纵HIV。他们发现,当他们使用遗传方法和生化方法破坏HIV衣壳的稳定性时,这种病毒无法有效复制它的 遗传物质。这是首次直接证明HIV衣壳不仅仅是 起着包装的作用,而且也是HIV感染过程本身的一个重要组成部分。
4.Nature论文解读:重大进展!利用纳米金刚石的量子特性进行试纸横向流动测试,可将灵敏度提高10万倍
doi:10.1038/s41586-020-2917-1
在一项新的研究中,来自英国伦敦大学学院和牛津大学的研究人员发现纳米金刚石(nanodiamond)的量子传感能力可用于提高基于试纸的诊断测试的灵敏度,从而有可能允许更早地检测HIV 感染等疾病。相关研究结果发表在2020年11月26日的Nature期刊上,论文标题为“Spin-enhanced nanodiamond biosensing for ultrasensitive diagnostics”。
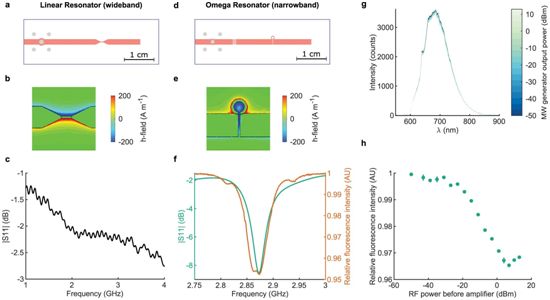
基于试条的横向流动测试的工作方式与妊娠测试相同,即将试条浸泡在液体样本中,颜色或荧光信号的变化表示阳性结果,并可检测病毒蛋白或DNA。它们被广泛用于检测从HIV到SARS-CoV-2 等病毒(目前针对COVID-19的横向流动测试正在英格兰各地进行试点),并且可以提供快速诊断,这是因为测试结果不必在实验室处理。
McKendry团队利用了含有缺陷的纳米金刚石的量子特性。金刚石高度规则结构中的这种缺陷会产生所谓的氮空位(nitrogen-vacancy, NV)中心。NV中心有许多潜在的应用,从用于超灵敏成 像的荧光生物标记到量子计算中的信息处理量子位。
NV中心可以通过发射明亮的荧光来产生指示抗原或其他靶分子存在的信号。在过去,荧光标记受到来自样品或试条的背景荧光的限制,使得难以检测到低浓度的病毒蛋白或DNA。然而,荧光纳 米金刚石的量子特性使它们的光发射可以被选择性调制,这意味着可以利用微波场将光信号固定在一个设定的频率上,并可以有效地从背景荧光中分离出来,从而解决了这一局限性。
这些光学结果显示,与金纳米颗粒相比,这种纳米金刚石技术的灵敏度提高了多达5个数量级(10万倍)(即产生可检测的信号仅需更低数量的纳米颗粒)。由于加入了一个短短10分钟的RNA 拷贝发生倍增的恒温扩增步骤,McKendry团队能够在模型样品中在单分子的水平下检测HIV RNA。
5.PNAS:治愈HIV感染有戏!一种抗生素分子可让免疫系统杀死被HIV感染的人体细胞
doi:10.1073/pnas.2008615117
在一项新的研究中,美国密歇根大学医学院的Mark Painter、Kathleen Collins博士及其同事们合作,着手通过靶向一种称为Nef的蛋白来寻找一种杀死HIV的武器。相关研究结果近期发表在 PNAS期刊上,论文标题为“Concanamycin A counteracts HIV-1 Nef to enhance immune clearance of infected primary cells by cytotoxic T lymphocytes”。
HIV利用Nef来逃避人体的免疫系统。这些研究人员确定一种名为concanamycin A的pleicomacrolide在比抑制溶酶体所需的浓度低得多的情况下抑制Nef。Painter说,“作为药物开发的先导化 合物,这是相当令人兴奋的,因为我们可以使用非常低的剂量,这样就可抑制Nef而不会对细胞产生短期毒性。”
在一个概念验证实验中,他们用concanamycin A处理HIV感染的、表达Nef的细胞,发现细胞毒性T细胞能够清除HIV感染的T细胞。
6.Nature:揭秘HIV精英控制者体内特殊HIV病毒库的特性!
doi:10.1038/s41586-020-2651-8
近日,一篇发表在国际杂志Nature上的研究报告中,来自麻省总医院等机构的科学家们通过研究成功对64名HIV精英控制者(elite controllers)和41名服用抗逆转录病毒药物(ART)的个体 机体中数以亿计的细胞进行测序,精英控制者,即在并不需要用药的情况下机体就能成功抑制HIV的水平和疾病进展;与接受ART治疗的个体不同的是,精英控制者体内的HIV病毒库似乎无法被 激活,这或许就能帮其维持自发且不使用药物的HIV水平的控制,同时这也揭示了HIV感染的功能性治愈的一个显著特征。
精英控制者机体的免疫系统会利用T细胞介导的免疫反应来在不服药的情况下控制病毒,从而利用标准的检测手段完全检测不到这些人群机体的病毒,而揭示精英控制者体内免疫系统和HIV之 间的相互作用或能帮助HIV感染者在不进行日常药物服用的情况下利用其免疫系统来抑制病毒进展。研究者Yu指出,这项研究中,我们对经营控制者体内的HIV病毒库进行了研究,利用新一代 的测序技术准确地绘制出了人类基因组中完整HIV基因组的具体位点,研究者发现,在精英控制者中,HIV会经常出现在被研究人员称之为基因沙漠的基因组未知,在人类基因组并不活跃的部 分,人类的DNA或许从未被开启过,而且HIV并不能被有效表达,而其会处于一种封闭和锁定的状态,这就意味着HIV会被锁定在细胞的基因组中,而病毒的基因组则会被阻断用于制造更多的病 毒,因此其就无法引起疾病的发生了。
7.Nat Med:开发出靶向HIV病毒库的Dual-CAR-T细胞,为治愈HIV感染奠定基础
doi:10.1038/s41591-020-1039-5
在一项新的研究中,来自美国拉根研究所、宾夕法尼亚大学和麻省总医院的研究人员描述了一种新型双CAR-T(Dual CAR T cell, Dual-CAR-T)细胞免疫疗法可以帮助对抗HIV感染。相关研究 结果于2020年8月31日在线发表在Nature Medicine期刊上,论文标题为“Dual CD4-based CAR T cells with distinct costimulatory domains mitigate HIV pathogenesis in vivo”。论文 通讯作者为拉根研究所的Todd Allen博士和宾夕法尼亚大学佩雷尔曼医学院微生物学教授Jim Riley博士。论文第一作者为宾夕法尼亚大学佩雷尔曼医学院研究生Colby Maldini和拉根研究所 研究员Daniel Claiborne博士。
作为一种新型的CAR-T细胞,这种Dual-CAR-T细胞是通过对T细胞进行基因改造使得同一个T细胞表达两种CAR。每种CAR都携带一个CD4蛋白,使得它能够靶向HIV感染细胞,而且每种CAR还有一 个共刺激结构域,用于向CAR-T细胞发出信号,增加这些T细胞的免疫功能。第一种CAR含有4-1BB共刺激结构域,可刺激细胞增殖和持久性,而第二种CAR具有CD28共刺激结构域,可增加这些T 细胞杀伤HIV感染细胞的能力。
由于HIV经常感染T细胞,他们还添加了一种叫做C34-CXCR4的蛋白,这种蛋白是在宾夕法尼亚大学佩雷尔曼医学院血液肿瘤科教授James Hoxie博士的实验室中开发出的。C34-CXCR4可以防止HIV附着在T细胞 上,因而也就阻止这种病毒感染它们。最终产生的Dual-CAR-T细胞寿命长,在应对HIV感染时进行复制,有效杀灭被感染的细胞,并对HIV感染形成部分抵抗力。
当将受保护的Dual-CAR-T细胞给送到HIV感染的小鼠体内时,这些研究人员观察到HIV复制速度变得较慢,而且相比于未给送Dual-CAR-T细胞的小鼠,它们具有更少的HIV感染细胞。他们还观察 到这些小鼠血液中的HIV病毒数量减少,CD4+T细胞得以保存下来。此外,当他们在HIV感染的小鼠中组合使用Dual-CAR-细胞细胞和ART时,这种病毒被更快地抑制,这就导致HIV病毒库比仅接 受ART治疗的小鼠更小。(生物谷 Bioon.com)
8.Science子刊:我国科学家发现利用小分子ACA靶向TGF-β信号通路,可抑制包括新冠病毒、HIV和甲流病毒在内 的一系列病毒
doi:10.1126/sciadv.aba7910
在一项新的研究中,来自中国香港大学、玛丽医院和海南医学院的研究人员鉴定出一种小分子,它通过靶向TGF-β信号通路,在组织培养物和小鼠体内抑制包括SARS-CoV-2在内的多种不同病毒 。通过鉴定出多种病毒成功感染所依赖的一种宿主细胞途径,这一发现为开发广谱抗病毒药物提供了一种潜在的靶标。相关研究结果近期发表在Science Advances期刊上,论文标题 为“Viruses harness YxxØ motif to interact with host AP2M1 for replication: a vulnerable broad-spectrum antiviral target”。
为了研究TGF-β信号通路是否可以作为对抗众多病毒的抗病毒疗法的靶点,香港大学微生物学系博士后研究员袁硕峰(Shuofeng Yuan)及其同事们对之前发现的该信号通路的抑制剂进行了筛 选。他们发现一种这样的化合物,即小分子N-(p-Amylcinnamoyl)anthranilic acid(简称ACA),在组织培养物和小鼠中都成功地抑制了甲型流感病毒、MERS-CoV、SARS-CoV-2、HIV、腺病毒 和两种小RNA病毒(picornavirus)。
他们还发现,ACA通过阻断AP2M1和许多病毒蛋白中存在的氨基酸基序YxxØ之间的相互作用来实现这种抑制作用。AP2M1是AP2接头复合体中的一个亚基,已知与TGF-β信号通路相互作用。
9.PLoS Pathog:多发性硬化症药物芬戈莫德可阻断HIV在人体免疫细胞中的感染和传播
doi:10.1371/journal.ppat.1008679
在一项新的研究中,美国乔治-华盛顿大学博士后研究员Rachel Resop、助理教授Alberto Bosque及其同事们发现作为一种经批准用于治疗多发性硬化症的免疫调节药物,芬戈莫德 (fingolimod, FTY720)可阻断HIV病毒在人类免疫细胞中的感染和传播。虽然在未来还需在动物和人类身体开展研究,但是这些初步研究结果表明这种化合物可能是一种很有前途的HIV治疗 和防御的新药物。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“Fingolimod inhibits multiple stages of the HIV-1 life cycle”。
Bosque及其同事们研究了一种替代策略来对抗HIV感染:靶向鞘氨醇-1-磷酸(S1P)受体---一种参与感染进展的免疫系统组分。为此,他们重点研究了芬戈莫德---一种耐受性良好的药物,可 以阻断S1P受体的作用,并获得了美国食品药物管理局(FDA)的批准用于治疗多发性硬化症。
他们发现,芬戈莫德通过阻碍HIV生命周期中的多个步骤,阻止HIV感染称为CD4+T细胞的人类免疫细胞。比如,芬戈莫德降低了CD4---一种在T细胞表面上发现的蛋白---的密度,从而抑制了这 种病毒的结合和融合。这种药物阻断了HIV在细胞间的传播,从而降低了可检测到的潜伏病毒。据他们的介绍,此前尚未有人报道S1P通路在HIV感染建立过程中的作用,之前也没有人报道调节 这一途径以改变感染过程或防止在CD4+T细胞中建立潜伏病毒库的潜力,因此,利用芬戈莫德靶向S1P通路可能是一种抑制HIV复制和减少潜伏病毒库的新策略。
10.Science:揭示HIV-1起始型变体的数量由传染源伴侣的感染阶段决定
doi:10.1126/science.aba5443
在性传播过程中,HIV-1在个体内的高遗传多样 性经常会减少到一个可引发感染的起始型变体(founder variant)。了解这一瓶颈的驱动因素有助于开发有效的感染控制策略。在这个瓶颈期,人们对传染源伴侣(source partner)的重要 性知之甚少。
在一项新的研究中,来自英国伦敦卫生与热带医学院、牛津大学、爱丁堡大学、瑞士苏黎世理工学院和美国耶鲁大学公共卫生学院的研究人员提出了一个假设:传染源伴侣影响HIV-1起始型变 体数量。为了验证这一假设,他们建立了一个系统动力学模型,并利用所有已知 传播方向和传染源伴侣感染阶段的性伴侣的遗传和流行病学数据对它进行校准。相关研究结果发表在2020年7月3日的 Science期刊上,论文标题为“Number of HIV-1 founder variants is determined by the recency of the source partner infection”。
这些研究人员利用112对性伴侣的流行病学和遗传 学数据,发现相比于慢性(晚期)感染阶段的个体,急性(早期)感染阶段的个体更可能传播多种起始型HIV-1变体。这项研究提供了首个直接测试传染源伴侣的特征来解释多种起始型 HIV-1变体感染的低频率发生。
11.JCI:老药新用新成果!科学家发现四种药物或能有效治疗HIV感染!
doi:10.1172/JCI137371
近日,一项刊登在国际杂志Journal of Clinical Investigation上的研究报告中,来自耶鲁大学等机构的科学家们通过研究识别出了四种药物或能帮助减少HIV感染所引发的长期健康效应。
文章中,研究人员开始寻找可能会帮助抑制HIV再度激活并能降低损伤性免疫系统反应的药物,他们对FDA批准的1430种药物进行筛查从而评估HIV对所感染的人类细胞的效应,最后研究人员锁定了四种被批准的药物,其在抑制潜在HIV激活的同时还能减少损伤性的免疫系 统反应。
其中两种药物目前已经用于临床试验中来治疗HIV 感染,即用于治疗血液障碍的药物鲁索替尼(ruxolitinib)和用于抑制器官排斥反应的霉酚酸(mycophenolic acid),然而,研究人员发现,另外两种药物filgotinib和安体舒通 (spironolactone)同样也能抑制HIV的再度激活和HIV诱导的免疫激活反应,filgotinib能够调节免疫反应并用来治疗 自身免疫性疾病,而安体舒通则是一种能用来治疗心力衰竭的激素药物。这些HIV抑制性药物或能在HIV治疗过程中用来补充抗逆转录病毒疗法 ,从而降低患者机体的慢性免疫激活,而单独使用抗逆转录病毒疗法似乎无法实现这一目标;相关研究由NIH等机构提供资助。
12.Nature重大突破!开发只需一年两次给药的HIV药物!
doi:10.1038/s41586-020-2443-1
科学家报告说,一种可能每年只服用几次的艾滋病药物已经取得初步进展。这种名为lenacapavir的试验性药物,只需注射一次,就能降低一小群患者血液中艾滋病病毒的水平。它能够在超过 六个月的时间里保持血液中的有效药物水平。这项发表在7月1日《自然》(Nature)杂志上的新研究提供了一个"原理证明",即每六个月间隔一次给药是可能的。
研究人员发现,在40名健康人身上,lenacapavir似乎是安全的,并且可以在体内保持活性6个月以上。在32名未经治疗的艾滋病毒患者中,一次注射可以在9天内降低血液中的病毒水平。令人 鼓舞的是,这种药物"可以每六个月给药一次",位于波士顿的马萨诸塞州总医院的传染病医生Rajesh Gandhi说。(生物谷 Bioon.com)
13.Science子刊:重大进展!新型佐剂3M-052可在体内诱导针对HIV的持久免疫力
doi:10.1126/sciimmunol.abb1025
在一项新的研究中,来自美国耶基斯国家灵长动物研究中心和埃默里疫苗中心的研究人员首次发现一种称为3M-052的新型佐剂有助于诱导针对HIV的持久免疫力。相关研究结果发表在2020年6 月19日的Science Immunology期刊上,论文标题为“3M-052, a synthetic TLR-7/8 agonist, induces durable HIV-1 envelope–specific plasma cells and humoral immunity in nonhuman primates”。
在这项纳入90只恒河猴的临床前研究中,这些研究人员发现作为一种靶向特定受体TLR 7/8的新合成小分子,3M-052成功地诱导了疫苗特异性的长寿命骨髓浆细胞(BM-LLPC),BM-LLPC对持久 免疫力至关重要。在一个引人注目的观察中,3M-052诱导的BM-LLPC在接种疫苗后维持较高的数量超过一年。这种较长的持续时间不仅在监测临床前的有效性方面是可行的,而且在选择候选疫 苗时也有很高的参考价值。
14.PLoS Pathog:重大发现!HIV可感染脑细胞,并从大脑中转移到外周器官
doi:10.1371/journal.ppat.1008381
在一项新的研究中,来自美国拉什大学医学中心的研究人员发现作为一种脑细胞,星形胶质细胞可以藏匿HIV病毒,然后将这种病毒传播给大脑中的免疫细胞,这些免疫细胞可从大脑中迁移出 去,进入其他器官。即使针对HIV的标准治疗方法---联合抗逆转录病毒疗法(cART)---可抑制HIV,这种病毒仍通过这一途径从大脑中转移出来。相关研究结果于2020年6月11日发表在PLoS Pathogens期刊上,论文标题为“HIV infects astrocytes in vivo and egresses from the brain to the periphery”。
美国美国国家卫生研究院国家精神卫生研究所HIV神经病理、遗传学与治疗学分部主任Jeymohan Joseph博士说,“这项研究证实了大脑作为HIV病毒库的关键作用,它能够使得这种病毒重新感 染外周器官。这些研究结果表明为了从体内根除HIV,治愈策略必须解决中枢神经系统在HIV传播中发挥的作用。”
15.Science子刊突破!一种两亲性肽杀死HIV-1病毒粒子和感染细胞!
doi:10.1126/scitranslmed.aaz2254
近日来自复旦大学、北京协和医学院、河北农业大学和中科院生物物理研究所等单位的研究人员从HIV包膜蛋白中筛选了一个肽库,以寻找能够抑制病毒的肽,相关研究成果于近日发表在 Science Translational Medicine上,题为"An amphipathic peptide targeting the gp41 cytoplasmic tail kills HIV-1 virions and infected cells"。
研究人员从细胞质区鉴定了一个能够有效灭活HIV-1病毒粒子、诱导HIV-1感染细胞坏死、并使潜伏感染细胞重新激活的肽F9170,这种肽对游离病毒粒子或HIV感染细胞有效。
进一步研究发现,F9170特异性靶向保守的HIV-1 Env细胞质尾部,有效破坏了病毒膜的完整性。短期单次给药F9170可控制病毒载量,使其低于慢性SHIV感染猕猴的检测限度。研究人员还发现 F9170可以进入大脑和淋巴结,这是HIV潜伏的部位之一。因此,研究人员认为F9170有望成为治疗艾滋病的候选药物。
16.PLoS Pathog:重大进展!鉴定出一种潜在新的潜伏HIV病毒库
doi:10.1371/journal.ppat.1008450
科学家们早就知道,即使接受抗逆转录病毒治疗,一些HIV也会永远存在于感染者体内,隐藏在免疫系统的较小细胞库(亦即HIV病毒库,指的是HIV整合到宿主免疫细胞基因组中而不再活跃地 增殖)中。当患者停止治疗后,这种病毒几乎总是从HIV病毒库中迅速反弹,导致致命的症状再次出现。
这些HIV病毒库仍然是治愈HIV/AIDS的主要障碍。但是,目前还没有一种简单的方法可以靶向病毒库细胞以便进行清除。科学家们也无法有效地从患者身上提取出病毒库细胞进行研究,以便最 终找到控制它们的方法。原因在于,这些细胞中的HIV病毒是潜伏的。因此,这些细胞的表面并没有携带易被宿主免疫系统发现的病毒蛋白。因此,科学家们一直在寻找其他的方法来精确地找 到病毒库细胞。
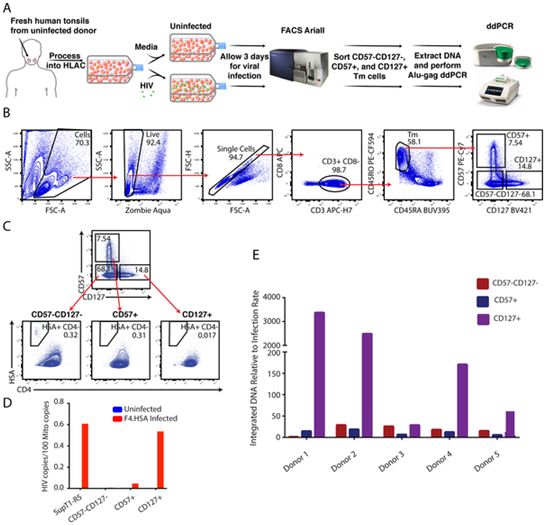
在一项新的研究中,美国格拉德斯通病毒学和免疫学研究所访问学者Nadia Roan博士和她的团 队描述了一类优先支持HIV潜伏感染的细胞。这些细胞表达表面蛋白CD127,存在于淋巴结等组织中,并被认为它们携带的HIV病毒库比血液中的更多。相关研究结果近期发表在PLoS Pathogens 期刊上,论文标题为“Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection”。
Roan说,“我们的研究结果表明,组织中的CD127阳性细胞可能是治愈HIV感染的重要靶点。”
17.PNAS:新研究表明苔藓虫素类似物可改善对HIV的根除
doi:10.1073/pnas.1919408117
美国斯坦福大学的化学家Paul Wender和他的同事们正在努力改善对癌症、HIV和阿尔茨海默病的治疗---他们认为,一种海洋无脊椎动物就是实现这一目标的手段。他们把目光投向了这种看似 不起眼的生物:总合草苔虫(Bugula neritina),这是因为它与肠道中的细菌合作制造草苔虫素(bryostatin),特别是草苔虫素-1(bryostatin-1),即一类能以至关重要的和可控的方式操纵细胞活动的分子。
在一项新的研究中,来自Wender实验室、加州大学洛杉矶分校Jerome Zack实验室和Matthew Marsden实验室的研究人员与美国国家卫生研究院的Tae-Wook Chun合作,将苔藓虫素修饰为前体药 物,而且所产生的前体药物随着时间的推移可以释放出它们的活性形式并展现它们的药效。相关研究结果于2020年5月6日在线发表在PNAS期刊上,论文标题为“Prodrugs of PKC modulators show enhanced HIV latency reversal and an expanded therapeutic window”。
普罗斯左汀(prostratin)、巨大戟酯(ingenol ester)、苔藓虫素及其类似物等蛋白激酶C(PKC)调节剂都是几种处于不同开发阶段的强效的潜伏逆转试剂(latency-reversing agent, LRA),即一类可激活潜伏性感染细胞中的HIV的化合物。虽然LRA很有前景,但与临床使用相关的一个主要挑战是在最大限度地减少副作用的同时,维持有治疗意义的活性药物水平。
在这项新的研究中,在动物模型和来自HIV阳性患者的感染细胞中,他们合成的这些前体药物在体外表现出的活性类似于或优于母体化合物(即苔藓虫素)。选定的前体药物可诱导更高的体内 CD69(一种活化生物标志物)表达,并且通过随着时间的推移释放其活性形式 ,显著提高了耐受性。更一般地说,这些选定的前体药物避免了母体化合物的大剂量毒性,表现出更大的疗效和扩大的耐受性,从而解决了许多临床应用的长期目标。如果在人类身上取得同 样的成功,那么HIV患者的治疗频率和药物副作用就会降低。
18.Nature:揭秘RNA结构多样性在HIV-1 RNA剪接过程中扮演的关键角色
doi:10.1038/s41586-020-2253-5
近日,一项刊登在国际杂志Nature上题为“Determination of RNA structural diversity and its role in HIV-1 RNA splicing”的研究报告中,来自怀特黑德生物医学研究所等机构的科学 家们通过研究确定了RNA的结构多样性及其在HIV-1剪接过程中扮演的关键角色。
这项研究中,研究者Phillip J. Tomezsko等人通过研究使用硫酸二甲酯突变谱结合名为DMS-MaPseq的测序技术分析了细胞中HIV-1的RNA的结构,同时他们还开发出了一种名为DREEM的新型算 法来解释由相同RNA序列所假设的可变构象结构,DREEM算法即利用期望最大化原则来检测RNA的折叠效果。与此前分析人口平均值的模型相反,本文研究中,研究者揭示了整合HIV-1基因组中 RNA结构的异质性区域,除了证实在体外研究中发现的HIV-1 Rev反应元件的替代结构也存在于细胞中外,研究者还发现,关键剪接位点的替代构象或许也会影响转录物亚型的比例。
最后研究者表示,本文研究他们同事测定了RNA的剪接和胞内结构,为长期存在的科学家假设提供了一定的证据,即证实了RNA构象的异质性能够调节剪接位点的使用及病毒基因的表达量,为 后期科学家们理解HIV-1感染机体的分子机制提供了新的线索和思路。
19.Science:重大突破!揭示单个鸟苷酸决定着HIV RNA基因组的命运
doi:10.1126/science.aaz7959
人类免疫缺陷病毒(HIV, 也称为艾滋病病毒)感染了100多万美国人和全球4000万人。一项针对HIV病毒结构的新研究揭示出一个有前景的新药物靶标可用于靶向HIV感染。它发现HIV感染的细 胞可以通过两种不同的方式读取这种病毒的遗传 密码。结果就是被感染的细胞制造出这种病毒RNA的两种不同形式。相关研究结果发表在2020年4月24日的Science期刊上,论文标题为“Structural basis for transcriptional start site control of HIV-1 RNA fate”。
HIV-1 RNA基因组的转录本既可以经剪接后翻译成病毒蛋白,也可以作为子代基因组被包装成新的病毒颗粒。所选择的路径取决于这种转录本是否在5′末端含有一个鸟苷酸(1G)还是两个或三 个鸟苷酸(2G或3G)。这项新的研究利用核磁共振光谱学研究发现1G转录本(即5′末端仅含有一个鸟苷酸的HIV-1 RNA基因组转录本)采用二聚体结构,该结构封存了翻译和剪接所需的末端帽 ,但暴露了与HIV-1 Gag蛋白结合的位点,其中Gag蛋白在病毒组装过程中招募HIV-1 RNA基因组。反之,2G或3G转录本可以接触到这个末端帽,但Gag结合位点被封存。因此,单个鸟苷酸作为 一个构象开关,决定了HIV-1转录本的命运。
论文第一作者Joshua Brown说,“这种功能的多样性对于这种病毒在体内复制是必不可少的。这种病毒必须在两种形式的RNA之间保持适当的平衡。几十年来,科学界已经知道HIV RNA存在两种 不同的结构形式,只是不知道是什么控制了这种平衡。我们发现单个核苷酸产生巨大的影响,这是理解HIV如何发挥作用的一个观念转变。”
20.NEJM:Fostemsavir治疗多药耐药性HIV感染者
doi:10.1056/NEJMoa1902493
对已接受多种抗逆转录病毒治疗但效果不佳的HIV感染者,急需具有新作用机制的新型抗病毒药物。HIV融合抑制剂Fostemsavir是一种潜在选择。
在23个国家开展的III期临床研究中,多药耐药HIV-1感染患者分为两组。在第一组中,患者在接受1-2种获批的抗逆转录病毒药物(与先前疗法不同)基础上,随机接受Fostemsavir (每天2 次,每次600mg)或安慰剂,为期8天, 随后接受Fostemsavir联合优化背景疗法(随机队列)。在第二个队列中,无可替换抗逆转录病毒药物选择的患者在第1天开始接受开放标签的 Fostemsavir联合优化背景治疗(非随机队列)。研究的主要终点是随机队列中HIV-1RNA水平从第1天到第8天的平均变化。
共371名患者参与研究,其中随机队列272名,非随机队列99名。第8天,Fostemsavir组HIV-1RNA水平的平均下降0.79 log10拷贝/mL,安慰剂组为0.17 log10拷贝/mL。在第48周,随机队列中 54%的患者和非随机队列中38%的患者出现了病毒应答(即HIV-1RNA水平<40个拷贝/毫升),CD4+T细胞计数的平均分别增加139个细胞/立方毫米和64个细胞/立方毫米。不良事件导致7%患者 停用Fostemsavir。在随机队列中,47例病毒学失败患者中有20例(43%)出现糖蛋白120(gp120)替换。
研究认为,HIV融合抑制剂Fostemsavir可显著减少多药耐药HIV感染患者血液RNA水平。
21.Nat Med:免疫检查点抑制剂组合使用可显著缩小猴子中的HIV病毒库大小
doi:10.1038/s41591-020-0782-y
在一项新的研究中,研究人员得出结论,利用两种癌症免疫治疗药物组合使用刺激免疫细胞,可缩小感染了猿猴免疫病毒(SIV)并接受抗病毒药物治疗的非人灵长类动物中的病毒库大小。这 种病毒库包括经过接受强效抗病毒药物治疗后仍携带SIV病毒的免疫细胞。相关研究结果近期发表在Nature Medicine期刊上,论文标题为“CTLA-4 and PD-1 dual blockade induces SIV reactivation without control of rebound after antiretroviral therapy interruption”。

在这篇论文中,这些研究人员使用了免疫检查点抑制剂伊匹单抗(ipilimumab)和纳武单抗(nivolumab)的猴子版本,它们分别阻断抑制性受体CTLA-4和PD-1(也是两种常见的免疫检查点) 。他们观察到相比于仅接受纳武单抗的猴子,同时接受伊匹单抗和纳武单抗的猴子的T细胞具有更强的活化作用。对血液中的病毒DNA测序表明,与使用其中的一种免疫检查点抑制剂相比,两 种免疫检查点抑制剂组合使用可重新激活更多的病毒。
Paiardini说,“我们观察到组合使用CTLA-4抑制剂和PD-1抑制剂可以有效地重新激活处于潜伏状态的HIV并使之对免疫系统可见。”
在以前的研究中,仅通过单一免疫检查点抑制剂或其他免疫刺激剂可以观察到HIV病毒库的有限缩小。在这项新的研究中,仅接受免疫检查点抑制剂组合治疗的猴子表现出这种病毒库大小的持 续显著下降。这是通过“DNAscope”---一种可视化组织中受感染细胞的成像技术---和通过测量携带完整病毒DNA的CD4 T细胞(HIV和SIV的主要靶标)的频率进行测量的。尽管有这种效果,但 一旦停用抗病毒药物,在接受免疫检查点抑制剂组合治疗的猴子中HIV病毒仍会恢复到先前的水平。
22.NEJM:临床试验表明HIV药物洛匹那韦-利托那韦不能有效治疗COVID-19
doi:10.1056/NEJMoa2001282; doi:10.1056/NEJMe2005477
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,中国研究人员发现有效治疗HIV感染者的药物对COVID-19无效。相关研究结果于2020年 3月18日发表在NEJM期刊上,论文标题为“A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19”。在这篇论文中,他们描述了他们在中国武汉在COVID-19患者中 开展的一项临床试验以及他们从中获得的发现。 美国布莱根妇女医院的Lindsey Baden和Eric Rubin在同期NEJM期刊上发表了一篇标题为“Covid-19—The Search for Effective Therapy”的社论文章,讨论了这项在中国开展的临床研究。
最近,医学界注意到SARS-CoV-2和HIV都需要一种称为蛋白酶的酶才能具有传染性。先前的研究已发现蛋白酶抑制剂洛匹那韦(lopinavir)和利托那韦(ritonavir)对治疗HIV感染者有效, 这使得许多人猜测它们是否也可能有效地抵抗SARS-CoV-2。为了确定这种情形是否可能发生,这些研究人员在中国武汉开启了一项临床试验。
这项临床试验将199例晚期COVID-19患者分为两组 ,其中的一组接受标准治疗(包括补充氧气),另一组接受标准治疗并给予洛匹那韦和利托那韦。最终,共有94例患者给予了这两种蛋白酶抑制剂。不幸的是,这些研究人员发现使用这两种 药物没有益处。那些给予这两种药物的患者的表现并不好于那些没有给予它们的患者。
不过,这项临床试验存在一些局限。首先,所有患者均处于疾病晚期,这使得任何治疗都不太可能帮助他们。其次,这项临床试验规模很小。
23.两篇NEJM指出HIV治疗新方法---每月肌肉注射长效卡博替韦和利匹韦林
doi:10.1056/NEJMoa1909512; doi:10.1056/NEJMoa1904398; doi:10.1056/NEJMe2002199
根据近期发表在NEJM期刊上的两项临床研究,对HIV-1受到抑制的患者而言,长效的卡博替韦 (cabotegravir,一种HIV整合酶抑制剂)和利匹韦林(rilpivirine)的组合使用(下称长效卡 博替韦+利匹韦林)并不逊于口服度鲁特韦-阿巴卡韦-拉米夫定(dolutegravir-abacavir-lamivudine)和标准口服治疗。

英国伦敦女王玛丽大学的Chloe Orkin博士及其同事们进行了一项III期随机试验(称为FLAIR临床试验),该试验涉及遭受HIV-1感染的成年人,这些患者在20周内每天接受度鲁特韦-阿巴卡韦-拉米夫定口服诱导治疗。HIV-1 RNA水平低于50 copies/mL的参与者被随机分配继续进行现行口服治疗,或改用口服卡博替韦-利匹韦林治疗一个月,然后接受长效卡博替韦+利匹韦林治疗。这些研究人员发现,在48周时接受长效卡博替韦+ 利匹韦林和口服卡博替韦-利匹韦林治疗的HIV感染者中,分别有2.1%和2.5%的患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为-0.4%;置信区间为95%, -2.8至2.1),满 足主要终点的非劣性标准(criterion for noninferiority)。
来自美国内布拉斯加大学医学中心的Susan Swindells博士及其同事们一项III期临床试验(称为ATLAS临床试验)中对血浆HIV-1 RNA水平低于50 copies/mL的患者在接受标准抗逆转录病毒药物(ART)口服治疗的至少6个月内随机分配继续 进行ART治疗,或者改为每月肌肉注射长效卡博替韦和长效利匹韦林(每组308例患者)。这些研究人员发现,在接受长效卡博替韦+利匹韦林治疗和口服治疗的患者中,分别有1.6%和1.0%的 患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为0.6%; 95%的置信区间为-1.2至2.5),满足主要终点的非劣性标准。
24.Sci Trans Med:急性抗病毒疗法有助于缩小HIV病毒库
doi:10.1126/scitranslmed.aav3491
在抗逆转录病毒疗法(ART)期间,HIV会通过整合在宿主免疫细胞基因组中,形成“病毒库”,这是抗逆转录病毒疗法不能最终治愈患者的原因。研究团队多年来一直努力探究抗逆转录病毒治 疗期间HIV病毒库是如何形成的。近日,一项新的研究表明,最早建立的“病毒库”在早期阶段仍然是“敏感的”,立即启动抗逆转录病毒治疗后可能会缩小约100倍。
在《Science Translational Medicine》上发表的这项研究中,研究人员提供了对早期HIV感染关键阶段中发生的事件的见解。“在早期阶段开始抗病毒治疗,通过清除肠道相关淋巴组织和淋 巴结中大量的感染细胞池,从而大大减少了病毒库的大小。众所周知,淋巴结是感染过程中HIV优先建立病毒库的地方。
尽管这些早期接受治疗的患者的病毒库很小,但这种病毒仍然存在,因此,有人可能会怀疑这种疗法的临床益处。由于这些早期接受治疗的患者的病毒库比对照组小100倍,这些研究人员可以 合理地认为,在接受抗逆转录病毒疗法的初始阶段,根除这些较小的病毒库相对更加容易。(生物谷 Bioon.com)
25.重磅!两篇Nature揭示逆转HIV潜伏的新策略
doi:10.1038/s41586-020-1951-3; doi:10.1038/s41586-020-1946-0
如今,在第一项新的研究中,来自美国北卡罗来纳大学教堂山分校和埃默里大学的研究人员使用一种称为AZD5582的化合物来激活血液和很多不同组织中遭受HIV潜伏感染的CD4+ T细胞,这种 激活达到了令人印象深刻的水平,而且没有或几乎没有毒性。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Systemic HIV and SIV latency reversal via non- canonical NF-κB signalling in vivo”。
这项开创性的研究是由北卡罗来纳大学教堂山分校医学院的研究人员在具有功能完整的人类免疫细胞的小鼠模型中完成的,这些免疫细胞遭受HIV感染,并通过ART药物加以抑制。重要的是, 这项研究随后在埃默里大学的一项纵向多剂量实验中得到了扩展。这项纵向多剂量实验以感染了猿猴免疫缺陷病毒(SIV)并可通过ART药物加以抑制的恒河猴为研究对象。Qura Therapeutics 公司与北卡罗来纳大学教堂山分校和ViiV Healthcare公司合作,开展了基础科学研究,从而加快了动物模型中的研究工作。在人体中开始测试之前,还需开展更多的研究,但是这项研究被认 为是迈向开发治愈性疗法的重要科学步骤。
这些研究人员随后在全身组织含有可被HIV感染且可通过ART药物加以抑制的人CD4+ T细胞的小鼠模型中测试了AZD5582。他们记录了在血液和几乎所有组织(包括淋巴结、胸腺、骨髓、肝脏、 肺部和大脑)中表达的HIV病毒RNA增加了。在某些情况下,HIV病毒RNA增加了20倍以上。
他们还在遭受SIV感染且可通过ART加以抑制的恒河猴中测试了AZD5582,给它们提供多剂量的AZD5582而且是每周提供一剂量,随后发现了类似的结果。他们观察到这些恒河猴的淋巴结和血液 中的SIV RNA表达激增,这标志着一种潜伏逆转剂首次在两种动物模型中完成了这一壮举,而且几乎没有毒性。
在第二项新的研究中,Guido Silvestri博士和Chahroudi领导的埃默里大学研究人员与北卡罗来纳大学教堂山分校的研究人员合作,以一种不同的方式实现了潜伏逆转。相关研究结果于2020 年1月22日在线发表在Nature期刊上,论文标题为“Robust and persistent reactivation of SIV and HIV by N-803 and depletion of CD8+ cells”。
他们将一种抗体注射到感染HIV并通过ART加以抑制的非人灵长类动物中来清除在控制病毒感染中起着非常重要作用的CD8+ T细胞。他们随后给送细胞因子IL-15的一种改进版本,结果发现这种 组合用药让SIV RNA出现在之前未观察到的血液和组织中。针对HIV,他们在进行过AZD5582测试的相同小鼠模型中发现类似的结果。
26.Science:HIV耐药性机制新见解
doi:10.1126/science.aay4919
如今,已有许多有助于控制HIV感染的药物,包括整合酶链转移抑制剂在内。该药物家族中有四种药物:raltegravir,elvitegravir,dolutegravir和bictegravir。它们都通过与HIV的一种 被称为整合酶的关键酶类结合而起作用,以阻止其将病毒的遗传物质插入人体细胞的DNA中。尽管最初非常有效,但随着时间的流逝,HIV会对这些药物产生抵抗力。
近日,Dana-Farber癌症研究所的研究揭示了HIV对多种药物产生耐药性的机制,这一发现为开发更有效的治疗方法打开了大门。这项研究于2020年1月30日在《Science》杂志上在线发表,该 研究发现了HIV产生药物耐药性的机制。尽管这些药物通常在结合和阻断整合酶方面非常有效,但随着时间的流逝,病毒会削弱药物的能力,从而使HIV再次起作用。
“我们的结构生物学方面的研究使得我们能够看到药物与病毒酶活性位点的精确结构。这一结构将为设计更有效的整合酶抑制剂提供参考,从而可以改善数百万HIV感染者的生活。”美国Dana- Farber癌症研究所癌症免疫学和病毒学教授Alan Engelman说。
27.Science:从结构上揭示INSTI药物结合HIV整合体机制
doi:10.1126/science.aay8015
在一项新的研究中,来自美国国家糖尿病与消化疾病研究所、美国国家癌症研究所、沙克生物研究所和斯克里普斯研究所的研究人员发现了一类强大的HIV药物如何结合HIV整合体(intasome )的一个关键部分。通过首次解析出这种整合体与不同药物结合在一起时的三维结构,他们发现了是什么让这类药物如此有效。这项研究提供了可能有助于设计或改进HIV新疗法的重要见解。 相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for strand transfer inhibitor binding to HIV intasomes”。
HIV整合体是这种病毒感染的一种关键结构,它由HIV蛋白整合酶(integrase)和病毒DNA链组成,而且是在这种病毒入侵人细胞时形成的。这种整合体进入人细胞,随后进行必要的化学反应 ,从而将这种病毒的遗传物质整合到人DNA中。一些称为整合酶链转移抑制剂(integrase strand transfer inhibitor, INSTI)的药物成功地阻断这种整合体;当它不能将病毒DNA整合到人 类基因组中时,HIV就不能够感染人细胞。目前,有四种INSTI药物获得美国食品药物管理局(FDA)的批准,还有一些正在开发当中。
在这项新的研究中,Lyumkis的研究团队获得了HIV整合体被四种INSTI---市售药物bictegravir;三种称为4f、4d和4c 的实验性化合物---之一阻断时的结构。他们使用了倾斜单粒子低温电子 显微镜(single-particle cryo-electron microscopy(他们帮助优化的一种成像技术)来揭示每种HIV整合体-药物复合物的结构。
Lyumkis的第一个观察结果是,这些药物与HIV整合体结合在一起时与它们与PFV整合体结合在一起时有何不同。比如,化合物4f在与PFV整合体结合时会回环到它自身上,而在与HIV整合体结合 时却保持相对平坦,这些细节可以帮助人们改善潜在的未来分子的结合特性。
28.Nat Med:抗体疗法可增强HIV感染者体内的T细胞免疫反应
doi:10.1038/s41591-019-0747-1
大多数HIV感染者通过服用抗逆转录病毒药物(ART)来控制这种病毒。尽管这种药物非常有效,但体内潜伏的HIV病毒库的存在意味着这些患者需要终身治疗。已有研究表明联合使用两种抗 HIV抗体的免疫疗法像ART药物那样也可以抑制HIV。如今,在一项新的研究中,来自加拿大蒙特利尔大学医院研究中心、美国洛克菲勒大学和德国科隆大学的研究人员发现在ART药物停用期间 ,使用这些抗体对HIV感染者的免疫系统产生影响。相关研究结果于2020年2月3日在线发表在Nature Medicine期刊上,论文标题为“Combination anti-HIV-1 antibody therapy is associated with increased virus-specific T cell immunity”。
这些研究人员描述了注射这些强效的称为中和抗体的抗HIV抗体如何与特异性识别HIV病毒的T细胞反应增强相关。T细胞是重要的白细胞,有助于控制诸如HIV感染之类的慢性感染。这项研究显 示了人类免疫系统的两个分支---体液免疫(抗体)和细胞免疫(T细胞)---之间的意外相互作用和潜在影响。
论文共同通讯作者、蒙特利尔大学医院研究中心研究员Daniel E. Kaufmann教授说,“这确实是概念验证。在这项研究中,我们分析了一项临床试验中参与者的血样,在这项临床试验中,我们 的合作者使用了实验室产生的单克隆抗体来阻断这种病毒。所有参与者在ART药物停用后至少维持了15周的病毒抑制。”
29.Cell:强效抗体1-18可限制HIV耐药性产生
doi:10.1016/j.cell.2020.01.010
如今,在一项新的研究中,来自德国科隆大学和美国加州理工学院的研究人员鉴定出一种新的称为1-18的抗体。这种抗体是强效的,可抵抗97%的接受测试的HIV变体。因此,1-18是迄今为止 描述的最好的HIV广泛中和抗体之一。相关研究结果于2020年1月30日在线发表在Cell期刊上,论文标题为“Restriction of HIV-1 Escape by a Highly Broad and Potent Neutralizing Antibody”。论文通讯作者为科隆大学的Florian Klein博士。论文第一作者为科隆大学的Philipp Schommers博士、Henning Grüll博士和加州理工学院的Morgan E. Abernathy博士。
这些研究人员详细确定了1-18抗体的作用机制。1-18结合并灭活HIV的一个表面结构,这是特别有意义的,毕竟这个表面结构对这种病毒的感染和复制至关重要。
在一种可再现人体HIV感染的小鼠模型中,这些研究人员研究了这种新鉴定出的抗体1-18的治疗功效。在这种模型中,其他的广泛中和抗体因HIV对它们快速地产生耐药性而仅显示出短期效应 。相反,用抗体1-18进行治疗可抑制病毒载量,而且在治疗期间维持这种抑制。Grüll说,“这些结果表明与其他抗体相比,HIV对抗体1-18的耐药性受到限制。”
30.Science子刊:在经过诱导的记忆T细胞亚群中,仅1.7%的完整HIV-1原病毒释放出具有复制能力的病毒
doi:10.1126/scitranslmed.aax6795
治愈HIV-1感染的主要障碍是潜伏在静止性CD4+ T细胞中的HIV-1病毒库,这使得这种病毒能够以一种让免疫系统无法检测到或不受抗逆转录病毒药物(ART)影响的形式持续存在。一种治愈策 略涉及诱导病毒基因表达,以便可以消除潜伏感染的T细胞。人们已经提出潜伏的HIV-1可能富含在特定的CD4+ T细胞亚群中,这将允许潜伏逆转药物更特异性地靶向它们。目前尚不清楚这种 潜伏的HIV-1病毒库是否主要存在于CD4+ T细胞的特定亚群中,这一点可能对理解这种HIV-1病毒库的稳定性和开发治愈性疗法有影响。近期的研究已表明HIV-1感染的CD4+ T细胞的增殖是这种 潜伏HIV-1病毒库产生和持久性存在的主要因素,并且在体内发生克隆扩增的潜伏感染T细胞可以在体外增殖而不产生病毒颗粒。
在某些CD4+记忆T细胞亚群中,HIV-1原病毒(provirus)可能处于更深的潜伏状态,这会使得这些细胞发生增殖而不产生病毒蛋白,从而可以逃避免疫清除。为了评估这种可能性,在一项新 的研究中,来自美国约翰霍普金斯大学等研究机构的研究人员使用了多重刺激病毒生长试验,在体外对来自10名接受ART药物治疗的HIV-1感染者的静止性初始CD4+ T细胞、中枢记忆CD4+ T细 胞(TCM)、过渡记忆CD4+ T细胞(TTM)和效应记忆CD4+ T细胞(TEM)进行培养。相关研究结果发表在2020年1月29日的Science Translational Medicine期刊上,论文标题为“Different human resting memory CD4+ T cell subsets show similar low inducibility of latent HIV-1 proviruses”。
平均而言,在所有T细胞亚群中,在这些细胞受到刺激后,只有1.7%的完整HIV-1原病毒在诱导后转录病毒基因并且释放出具有复制能力的病毒。他们没有在任何T细胞亚群中发现完整或可诱 导的原病毒的持续富集。此外,他们观察到这些典型的记忆T细胞亚群在体外激活后具有显著的可塑性,而且诱导感染性病毒释放的能力在人与人之间存在显著差异。这一发现使得基于记忆T 细胞亚群的HIV-1靶向治疗的愿景变得更加复杂。(生物谷 Bioon.com)
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
迄今为止,全世界只报道了仅有的一名“柏林病人”Timothy Ray Brown被认为完全治愈了HIV。2007年,Brown在德国一家医院接受通过CCR5△32/CCR5△32基因型造血干细胞移植治疗白血病后,他体内的HIV病毒也完全消失了,成为世界上首例被“治愈”的艾滋病患者。2019年3月,一名被称为“伦敦病人”(London patient)的男性患者接受了HIV抵抗患者的骨髓移植后已经将近19个月没有出现HIV感染的迹象了,他很可能成为世界上第二名已知的被成功去除HIV的患者。
在即将过去的2020年,科学家们在HIV的病毒库、致病机制、检测和治疗等方面取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
1.Nat Commun:利用AAV9-CRISPR-Cas9基因编辑有望清除受感染细胞DNA中的HIV DNA
doi:10.1038/s41467-020-19821-7
猿猴免疫缺损病毒(SIV)是一种与人类免疫缺陷病毒(HIV)存在密切亲缘关系的病毒。在一项新的研究中,来自美国天普大学刘易斯-卡茨医学院和杜兰大学等研究机构的研究人员在HIV研究方面迈出了重要一步:他们成功地从非人灵长类动物的基因组中剔除了SIV。这一突破使得他们比以往任何时候都更接近开发治愈人类HIV感染的方法。相关研究结果近期发表在Nature Communications期刊上,论文标题为“CRISPR based editing of SIV proviral DNA in ART treated non-human primates”。

体外靶向SIV前病毒DNA的CRISPR-Cas9构建体的构建、图谱和验证。Nature Communications, 2020, doi:10.1038/s41467-020-19821-7。
论文共同通讯作者、天普大学刘易斯-卡茨医学院综合神经艾滋病中心主任Kamel Khalili博士说,“我们首次发现,单次注射我们的由腺相关病毒(AAV)携带的CRISPR基因编辑构建体,可以从恒河猴的受感染细胞中剔除SIV基因组。”
2.Lancet:每8周1次的长效卡博特韦-利匹韦林治疗方案用于HIV感染者的治疗
doi:10.1016/S0140-6736(20)32666-0
在先前进行的III期ATLAS临床研究中,每4周1次的卡博特韦-利匹韦林肌肉注射的效果与口服抗病毒药物相当。在II期临床及模型研究中,每8周一次的卡博特韦-利匹韦林疗法也具有较好的治疗效果。近日研究人员比较了每8周vs 4周1次卡博特韦-利匹韦林治疗的抗HIV-1病毒效果。
ATLAS-2M研究在13个国家开展,为开放,IIIb期,非劣性研究,HIV-1感染患者每8周接受一次600mg卡博特韦联合900mg利匹韦林治疗或每4周接受一次400mg卡博特韦联合600mg利匹韦林治疗。研究的主要终点为48周时,每毫升血清HIV-1 RNA拷贝数大于50的患者比例,非劣性边界为4%。
1045名HIV感染者参与研究,其中8周治疗组522人,4周治疗组523人,其中391名患者来自ATLAS研究(37%)。参与者平均年龄42岁,27%为女性,73%为白人。研究结果显示,每8周1次卡博特韦联合利匹韦林治疗的效果与每4周1次治疗的效果相当,每毫升血清HIV-1 RNA拷贝数大于50的患者比例分别为2%和1%。8周治疗组8名患者(2%)以及4周治疗组2名(<1%)患者证实病毒学治疗失败。组间安全性相似,81%的患者报告了不良反应,无治疗导致的死亡发生。
对于HIV-1感染者,每8周1次卡博特韦联合利匹韦林治疗效果与每4周1次相当,研究支持每2个月1次的长效卡博特韦-利匹韦林治疗方案用于HIV-1感染者。
3.Science:重大进展!在体外重建HIV复制和整合过程,为开发靶向HIV衣壳的药物奠定基础
doi:10.1126/science.abc8420
在一项新的研究中,来自美国犹他大学医学院和弗吉尼亚大学的研究人员在试管中重现了导致获得性免疫缺陷综合征(AIDS,俗称艾滋病)的HIV(人类免疫缺陷病毒)感染的最初步骤,实现 了几十年来的梦想。这样做使得人们能够近距离观察HIV,并能够确定这种病毒在人类宿主体内复制所需的基本成分。相关研究结果发表在2020年10月9日的Science期刊上,论文标题 为“Reconstitution and visualization of HIV-1 capsid-dependent replication and integration in vitro”。

在体外重建和可视化观察HIV-1衣壳依赖性的复制和整合。图片来自Science, 2020, doi:10.1126/science.abc8420。
就HIV的所有危险性而言,这种病毒的外表却很简单。HIV类似于一个圆形的冰淇淋甜筒,它的外壳将它的遗传物质封装在里面。此前,人们一直认为,这个称为衣壳(capsid)的外壳的主要 作用是保护它的珍贵货物(即前面提及的遗传 物质)。但是,这项新的研究显示,HIV衣壳在感染过程中也发挥着积极作用。
在试管中进行感染的初始步骤,使得这些研究人员能够以以前不可能的方式精确地操纵HIV。他们发现,当他们使用遗传方法和生化方法破坏HIV衣壳的稳定性时,这种病毒无法有效复制它的 遗传物质。这是首次直接证明HIV衣壳不仅仅是 起着包装的作用,而且也是HIV感染过程本身的一个重要组成部分。
4.Nature论文解读:重大进展!利用纳米金刚石的量子特性进行试纸横向流动测试,可将灵敏度提高10万倍
doi:10.1038/s41586-020-2917-1
在一项新的研究中,来自英国伦敦大学学院和牛津大学的研究人员发现纳米金刚石(nanodiamond)的量子传感能力可用于提高基于试纸的诊断测试的灵敏度,从而有可能允许更早地检测HIV 感染等疾病。相关研究结果发表在2020年11月26日的Nature期刊上,论文标题为“Spin-enhanced nanodiamond biosensing for ultrasensitive diagnostics”。

图片来自Nature, 2020, doi:10.1038/s41586-020-2917-1。
基于试条的横向流动测试的工作方式与妊娠测试相同,即将试条浸泡在液体样本中,颜色或荧光信号的变化表示阳性结果,并可检测病毒蛋白或DNA。它们被广泛用于检测从HIV到SARS-CoV-2 等病毒(目前针对COVID-19的横向流动测试正在英格兰各地进行试点),并且可以提供快速诊断,这是因为测试结果不必在实验室处理。
McKendry团队利用了含有缺陷的纳米金刚石的量子特性。金刚石高度规则结构中的这种缺陷会产生所谓的氮空位(nitrogen-vacancy, NV)中心。NV中心有许多潜在的应用,从用于超灵敏成 像的荧光生物标记到量子计算中的信息处理量子位。
NV中心可以通过发射明亮的荧光来产生指示抗原或其他靶分子存在的信号。在过去,荧光标记受到来自样品或试条的背景荧光的限制,使得难以检测到低浓度的病毒蛋白或DNA。然而,荧光纳 米金刚石的量子特性使它们的光发射可以被选择性调制,这意味着可以利用微波场将光信号固定在一个设定的频率上,并可以有效地从背景荧光中分离出来,从而解决了这一局限性。
这些光学结果显示,与金纳米颗粒相比,这种纳米金刚石技术的灵敏度提高了多达5个数量级(10万倍)(即产生可检测的信号仅需更低数量的纳米颗粒)。由于加入了一个短短10分钟的RNA 拷贝发生倍增的恒温扩增步骤,McKendry团队能够在模型样品中在单分子的水平下检测HIV RNA。
5.PNAS:治愈HIV感染有戏!一种抗生素分子可让免疫系统杀死被HIV感染的人体细胞
doi:10.1073/pnas.2008615117
在一项新的研究中,美国密歇根大学医学院的Mark Painter、Kathleen Collins博士及其同事们合作,着手通过靶向一种称为Nef的蛋白来寻找一种杀死HIV的武器。相关研究结果近期发表在 PNAS期刊上,论文标题为“Concanamycin A counteracts HIV-1 Nef to enhance immune clearance of infected primary cells by cytotoxic T lymphocytes”。

图片来自PNAS, 2020, doi:10.1073/pnas.2008615117。
HIV利用Nef来逃避人体的免疫系统。这些研究人员确定一种名为concanamycin A的pleicomacrolide在比抑制溶酶体所需的浓度低得多的情况下抑制Nef。Painter说,“作为药物开发的先导化 合物,这是相当令人兴奋的,因为我们可以使用非常低的剂量,这样就可抑制Nef而不会对细胞产生短期毒性。”
在一个概念验证实验中,他们用concanamycin A处理HIV感染的、表达Nef的细胞,发现细胞毒性T细胞能够清除HIV感染的T细胞。
6.Nature:揭秘HIV精英控制者体内特殊HIV病毒库的特性!
doi:10.1038/s41586-020-2651-8
近日,一篇发表在国际杂志Nature上的研究报告中,来自麻省总医院等机构的科学家们通过研究成功对64名HIV精英控制者(elite controllers)和41名服用抗逆转录病毒药物(ART)的个体 机体中数以亿计的细胞进行测序,精英控制者,即在并不需要用药的情况下机体就能成功抑制HIV的水平和疾病进展;与接受ART治疗的个体不同的是,精英控制者体内的HIV病毒库似乎无法被 激活,这或许就能帮其维持自发且不使用药物的HIV水平的控制,同时这也揭示了HIV感染的功能性治愈的一个显著特征。

图片来自Pixabay/CC0 Public Domain。
精英控制者机体的免疫系统会利用T细胞介导的免疫反应来在不服药的情况下控制病毒,从而利用标准的检测手段完全检测不到这些人群机体的病毒,而揭示精英控制者体内免疫系统和HIV之 间的相互作用或能帮助HIV感染者在不进行日常药物服用的情况下利用其免疫系统来抑制病毒进展。研究者Yu指出,这项研究中,我们对经营控制者体内的HIV病毒库进行了研究,利用新一代 的测序技术准确地绘制出了人类基因组中完整HIV基因组的具体位点,研究者发现,在精英控制者中,HIV会经常出现在被研究人员称之为基因沙漠的基因组未知,在人类基因组并不活跃的部 分,人类的DNA或许从未被开启过,而且HIV并不能被有效表达,而其会处于一种封闭和锁定的状态,这就意味着HIV会被锁定在细胞的基因组中,而病毒的基因组则会被阻断用于制造更多的病 毒,因此其就无法引起疾病的发生了。
7.Nat Med:开发出靶向HIV病毒库的Dual-CAR-T细胞,为治愈HIV感染奠定基础
doi:10.1038/s41591-020-1039-5
在一项新的研究中,来自美国拉根研究所、宾夕法尼亚大学和麻省总医院的研究人员描述了一种新型双CAR-T(Dual CAR T cell, Dual-CAR-T)细胞免疫疗法可以帮助对抗HIV感染。相关研究 结果于2020年8月31日在线发表在Nature Medicine期刊上,论文标题为“Dual CD4-based CAR T cells with distinct costimulatory domains mitigate HIV pathogenesis in vivo”。论文 通讯作者为拉根研究所的Todd Allen博士和宾夕法尼亚大学佩雷尔曼医学院微生物学教授Jim Riley博士。论文第一作者为宾夕法尼亚大学佩雷尔曼医学院研究生Colby Maldini和拉根研究所 研究员Daniel Claiborne博士。
作为一种新型的CAR-T细胞,这种Dual-CAR-T细胞是通过对T细胞进行基因改造使得同一个T细胞表达两种CAR。每种CAR都携带一个CD4蛋白,使得它能够靶向HIV感染细胞,而且每种CAR还有一 个共刺激结构域,用于向CAR-T细胞发出信号,增加这些T细胞的免疫功能。第一种CAR含有4-1BB共刺激结构域,可刺激细胞增殖和持久性,而第二种CAR具有CD28共刺激结构域,可增加这些T 细胞杀伤HIV感染细胞的能力。
由于HIV经常感染T细胞,他们还添加了一种叫做C34-CXCR4的蛋白,这种蛋白是在宾夕法尼亚大学佩雷尔曼医学院血液肿瘤科教授James Hoxie博士的实验室中开发出的。C34-CXCR4可以防止HIV附着在T细胞 上,因而也就阻止这种病毒感染它们。最终产生的Dual-CAR-T细胞寿命长,在应对HIV感染时进行复制,有效杀灭被感染的细胞,并对HIV感染形成部分抵抗力。
当将受保护的Dual-CAR-T细胞给送到HIV感染的小鼠体内时,这些研究人员观察到HIV复制速度变得较慢,而且相比于未给送Dual-CAR-T细胞的小鼠,它们具有更少的HIV感染细胞。他们还观察 到这些小鼠血液中的HIV病毒数量减少,CD4+T细胞得以保存下来。此外,当他们在HIV感染的小鼠中组合使用Dual-CAR-细胞细胞和ART时,这种病毒被更快地抑制,这就导致HIV病毒库比仅接 受ART治疗的小鼠更小。(生物谷 Bioon.com)
8.Science子刊:我国科学家发现利用小分子ACA靶向TGF-β信号通路,可抑制包括新冠病毒、HIV和甲流病毒在内 的一系列病毒
doi:10.1126/sciadv.aba7910
在一项新的研究中,来自中国香港大学、玛丽医院和海南医学院的研究人员鉴定出一种小分子,它通过靶向TGF-β信号通路,在组织培养物和小鼠体内抑制包括SARS-CoV-2在内的多种不同病毒 。通过鉴定出多种病毒成功感染所依赖的一种宿主细胞途径,这一发现为开发广谱抗病毒药物提供了一种潜在的靶标。相关研究结果近期发表在Science Advances期刊上,论文标题 为“Viruses harness YxxØ motif to interact with host AP2M1 for replication: a vulnerable broad-spectrum antiviral target”。
为了研究TGF-β信号通路是否可以作为对抗众多病毒的抗病毒疗法的靶点,香港大学微生物学系博士后研究员袁硕峰(Shuofeng Yuan)及其同事们对之前发现的该信号通路的抑制剂进行了筛 选。他们发现一种这样的化合物,即小分子N-(p-Amylcinnamoyl)anthranilic acid(简称ACA),在组织培养物和小鼠中都成功地抑制了甲型流感病毒、MERS-CoV、SARS-CoV-2、HIV、腺病毒 和两种小RNA病毒(picornavirus)。
他们还发现,ACA通过阻断AP2M1和许多病毒蛋白中存在的氨基酸基序YxxØ之间的相互作用来实现这种抑制作用。AP2M1是AP2接头复合体中的一个亚基,已知与TGF-β信号通路相互作用。
9.PLoS Pathog:多发性硬化症药物芬戈莫德可阻断HIV在人体免疫细胞中的感染和传播
doi:10.1371/journal.ppat.1008679
在一项新的研究中,美国乔治-华盛顿大学博士后研究员Rachel Resop、助理教授Alberto Bosque及其同事们发现作为一种经批准用于治疗多发性硬化症的免疫调节药物,芬戈莫德 (fingolimod, FTY720)可阻断HIV病毒在人类免疫细胞中的感染和传播。虽然在未来还需在动物和人类身体开展研究,但是这些初步研究结果表明这种化合物可能是一种很有前途的HIV治疗 和防御的新药物。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“Fingolimod inhibits multiple stages of the HIV-1 life cycle”。

图片来源:NIAID。
Bosque及其同事们研究了一种替代策略来对抗HIV感染:靶向鞘氨醇-1-磷酸(S1P)受体---一种参与感染进展的免疫系统组分。为此,他们重点研究了芬戈莫德---一种耐受性良好的药物,可 以阻断S1P受体的作用,并获得了美国食品药物管理局(FDA)的批准用于治疗多发性硬化症。
他们发现,芬戈莫德通过阻碍HIV生命周期中的多个步骤,阻止HIV感染称为CD4+T细胞的人类免疫细胞。比如,芬戈莫德降低了CD4---一种在T细胞表面上发现的蛋白---的密度,从而抑制了这 种病毒的结合和融合。这种药物阻断了HIV在细胞间的传播,从而降低了可检测到的潜伏病毒。据他们的介绍,此前尚未有人报道S1P通路在HIV感染建立过程中的作用,之前也没有人报道调节 这一途径以改变感染过程或防止在CD4+T细胞中建立潜伏病毒库的潜力,因此,利用芬戈莫德靶向S1P通路可能是一种抑制HIV复制和减少潜伏病毒库的新策略。
10.Science:揭示HIV-1起始型变体的数量由传染源伴侣的感染阶段决定
doi:10.1126/science.aba5443
在性传播过程中,HIV-1在个体内的高遗传多样 性经常会减少到一个可引发感染的起始型变体(founder variant)。了解这一瓶颈的驱动因素有助于开发有效的感染控制策略。在这个瓶颈期,人们对传染源伴侣(source partner)的重要 性知之甚少。
在一项新的研究中,来自英国伦敦卫生与热带医学院、牛津大学、爱丁堡大学、瑞士苏黎世理工学院和美国耶鲁大学公共卫生学院的研究人员提出了一个假设:传染源伴侣影响HIV-1起始型变 体数量。为了验证这一假设,他们建立了一个系统动力学模型,并利用所有已知 传播方向和传染源伴侣感染阶段的性伴侣的遗传和流行病学数据对它进行校准。相关研究结果发表在2020年7月3日的 Science期刊上,论文标题为“Number of HIV-1 founder variants is determined by the recency of the source partner infection”。
这些研究人员利用112对性伴侣的流行病学和遗传 学数据,发现相比于慢性(晚期)感染阶段的个体,急性(早期)感染阶段的个体更可能传播多种起始型HIV-1变体。这项研究提供了首个直接测试传染源伴侣的特征来解释多种起始型 HIV-1变体感染的低频率发生。
11.JCI:老药新用新成果!科学家发现四种药物或能有效治疗HIV感染!
doi:10.1172/JCI137371
近日,一项刊登在国际杂志Journal of Clinical Investigation上的研究报告中,来自耶鲁大学等机构的科学家们通过研究识别出了四种药物或能帮助减少HIV感染所引发的长期健康效应。
文章中,研究人员开始寻找可能会帮助抑制HIV再度激活并能降低损伤性免疫系统反应的药物,他们对FDA批准的1430种药物进行筛查从而评估HIV对所感染的人类细胞的效应,最后研究人员锁定了四种被批准的药物,其在抑制潜在HIV激活的同时还能减少损伤性的免疫系 统反应。
其中两种药物目前已经用于临床试验中来治疗HIV 感染,即用于治疗血液障碍的药物鲁索替尼(ruxolitinib)和用于抑制器官排斥反应的霉酚酸(mycophenolic acid),然而,研究人员发现,另外两种药物filgotinib和安体舒通 (spironolactone)同样也能抑制HIV的再度激活和HIV诱导的免疫激活反应,filgotinib能够调节免疫反应并用来治疗 自身免疫性疾病,而安体舒通则是一种能用来治疗心力衰竭的激素药物。这些HIV抑制性药物或能在HIV治疗过程中用来补充抗逆转录病毒疗法 ,从而降低患者机体的慢性免疫激活,而单独使用抗逆转录病毒疗法似乎无法实现这一目标;相关研究由NIH等机构提供资助。
12.Nature重大突破!开发只需一年两次给药的HIV药物!
doi:10.1038/s41586-020-2443-1
科学家报告说,一种可能每年只服用几次的艾滋病药物已经取得初步进展。这种名为lenacapavir的试验性药物,只需注射一次,就能降低一小群患者血液中艾滋病病毒的水平。它能够在超过 六个月的时间里保持血液中的有效药物水平。这项发表在7月1日《自然》(Nature)杂志上的新研究提供了一个"原理证明",即每六个月间隔一次给药是可能的。
研究人员发现,在40名健康人身上,lenacapavir似乎是安全的,并且可以在体内保持活性6个月以上。在32名未经治疗的艾滋病毒患者中,一次注射可以在9天内降低血液中的病毒水平。令人 鼓舞的是,这种药物"可以每六个月给药一次",位于波士顿的马萨诸塞州总医院的传染病医生Rajesh Gandhi说。(生物谷 Bioon.com)
13.Science子刊:重大进展!新型佐剂3M-052可在体内诱导针对HIV的持久免疫力
doi:10.1126/sciimmunol.abb1025
在一项新的研究中,来自美国耶基斯国家灵长动物研究中心和埃默里疫苗中心的研究人员首次发现一种称为3M-052的新型佐剂有助于诱导针对HIV的持久免疫力。相关研究结果发表在2020年6 月19日的Science Immunology期刊上,论文标题为“3M-052, a synthetic TLR-7/8 agonist, induces durable HIV-1 envelope–specific plasma cells and humoral immunity in nonhuman primates”。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
在这项纳入90只恒河猴的临床前研究中,这些研究人员发现作为一种靶向特定受体TLR 7/8的新合成小分子,3M-052成功地诱导了疫苗特异性的长寿命骨髓浆细胞(BM-LLPC),BM-LLPC对持久 免疫力至关重要。在一个引人注目的观察中,3M-052诱导的BM-LLPC在接种疫苗后维持较高的数量超过一年。这种较长的持续时间不仅在监测临床前的有效性方面是可行的,而且在选择候选疫 苗时也有很高的参考价值。
14.PLoS Pathog:重大发现!HIV可感染脑细胞,并从大脑中转移到外周器官
doi:10.1371/journal.ppat.1008381
在一项新的研究中,来自美国拉什大学医学中心的研究人员发现作为一种脑细胞,星形胶质细胞可以藏匿HIV病毒,然后将这种病毒传播给大脑中的免疫细胞,这些免疫细胞可从大脑中迁移出 去,进入其他器官。即使针对HIV的标准治疗方法---联合抗逆转录病毒疗法(cART)---可抑制HIV,这种病毒仍通过这一途径从大脑中转移出来。相关研究结果于2020年6月11日发表在PLoS Pathogens期刊上,论文标题为“HIV infects astrocytes in vivo and egresses from the brain to the periphery”。
美国美国国家卫生研究院国家精神卫生研究所HIV神经病理、遗传学与治疗学分部主任Jeymohan Joseph博士说,“这项研究证实了大脑作为HIV病毒库的关键作用,它能够使得这种病毒重新感 染外周器官。这些研究结果表明为了从体内根除HIV,治愈策略必须解决中枢神经系统在HIV传播中发挥的作用。”
15.Science子刊突破!一种两亲性肽杀死HIV-1病毒粒子和感染细胞!
doi:10.1126/scitranslmed.aaz2254
近日来自复旦大学、北京协和医学院、河北农业大学和中科院生物物理研究所等单位的研究人员从HIV包膜蛋白中筛选了一个肽库,以寻找能够抑制病毒的肽,相关研究成果于近日发表在 Science Translational Medicine上,题为"An amphipathic peptide targeting the gp41 cytoplasmic tail kills HIV-1 virions and infected cells"。
研究人员从细胞质区鉴定了一个能够有效灭活HIV-1病毒粒子、诱导HIV-1感染细胞坏死、并使潜伏感染细胞重新激活的肽F9170,这种肽对游离病毒粒子或HIV感染细胞有效。
进一步研究发现,F9170特异性靶向保守的HIV-1 Env细胞质尾部,有效破坏了病毒膜的完整性。短期单次给药F9170可控制病毒载量,使其低于慢性SHIV感染猕猴的检测限度。研究人员还发现 F9170可以进入大脑和淋巴结,这是HIV潜伏的部位之一。因此,研究人员认为F9170有望成为治疗艾滋病的候选药物。
16.PLoS Pathog:重大进展!鉴定出一种潜在新的潜伏HIV病毒库
doi:10.1371/journal.ppat.1008450
科学家们早就知道,即使接受抗逆转录病毒治疗,一些HIV也会永远存在于感染者体内,隐藏在免疫系统的较小细胞库(亦即HIV病毒库,指的是HIV整合到宿主免疫细胞基因组中而不再活跃地 增殖)中。当患者停止治疗后,这种病毒几乎总是从HIV病毒库中迅速反弹,导致致命的症状再次出现。
这些HIV病毒库仍然是治愈HIV/AIDS的主要障碍。但是,目前还没有一种简单的方法可以靶向病毒库细胞以便进行清除。科学家们也无法有效地从患者身上提取出病毒库细胞进行研究,以便最 终找到控制它们的方法。原因在于,这些细胞中的HIV病毒是潜伏的。因此,这些细胞的表面并没有携带易被宿主免疫系统发现的病毒蛋白。因此,科学家们一直在寻找其他的方法来精确地找 到病毒库细胞。

图片来自PLoS Pathogens, 2020, doi:10.1371/journal.ppat.1008450。
在一项新的研究中,美国格拉德斯通病毒学和免疫学研究所访问学者Nadia Roan博士和她的团 队描述了一类优先支持HIV潜伏感染的细胞。这些细胞表达表面蛋白CD127,存在于淋巴结等组织中,并被认为它们携带的HIV病毒库比血液中的更多。相关研究结果近期发表在PLoS Pathogens 期刊上,论文标题为“Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection”。
Roan说,“我们的研究结果表明,组织中的CD127阳性细胞可能是治愈HIV感染的重要靶点。”
17.PNAS:新研究表明苔藓虫素类似物可改善对HIV的根除
doi:10.1073/pnas.1919408117
美国斯坦福大学的化学家Paul Wender和他的同事们正在努力改善对癌症、HIV和阿尔茨海默病的治疗---他们认为,一种海洋无脊椎动物就是实现这一目标的手段。他们把目光投向了这种看似 不起眼的生物:总合草苔虫(Bugula neritina),这是因为它与肠道中的细菌合作制造草苔虫素(bryostatin),特别是草苔虫素-1(bryostatin-1),即一类能以至关重要的和可控的方式操纵细胞活动的分子。
在一项新的研究中,来自Wender实验室、加州大学洛杉矶分校Jerome Zack实验室和Matthew Marsden实验室的研究人员与美国国家卫生研究院的Tae-Wook Chun合作,将苔藓虫素修饰为前体药 物,而且所产生的前体药物随着时间的推移可以释放出它们的活性形式并展现它们的药效。相关研究结果于2020年5月6日在线发表在PNAS期刊上,论文标题为“Prodrugs of PKC modulators show enhanced HIV latency reversal and an expanded therapeutic window”。
普罗斯左汀(prostratin)、巨大戟酯(ingenol ester)、苔藓虫素及其类似物等蛋白激酶C(PKC)调节剂都是几种处于不同开发阶段的强效的潜伏逆转试剂(latency-reversing agent, LRA),即一类可激活潜伏性感染细胞中的HIV的化合物。虽然LRA很有前景,但与临床使用相关的一个主要挑战是在最大限度地减少副作用的同时,维持有治疗意义的活性药物水平。
在这项新的研究中,在动物模型和来自HIV阳性患者的感染细胞中,他们合成的这些前体药物在体外表现出的活性类似于或优于母体化合物(即苔藓虫素)。选定的前体药物可诱导更高的体内 CD69(一种活化生物标志物)表达,并且通过随着时间的推移释放其活性形式 ,显著提高了耐受性。更一般地说,这些选定的前体药物避免了母体化合物的大剂量毒性,表现出更大的疗效和扩大的耐受性,从而解决了许多临床应用的长期目标。如果在人类身上取得同 样的成功,那么HIV患者的治疗频率和药物副作用就会降低。
18.Nature:揭秘RNA结构多样性在HIV-1 RNA剪接过程中扮演的关键角色
doi:10.1038/s41586-020-2253-5
近日,一项刊登在国际杂志Nature上题为“Determination of RNA structural diversity and its role in HIV-1 RNA splicing”的研究报告中,来自怀特黑德生物医学研究所等机构的科学 家们通过研究确定了RNA的结构多样性及其在HIV-1剪接过程中扮演的关键角色。
这项研究中,研究者Phillip J. Tomezsko等人通过研究使用硫酸二甲酯突变谱结合名为DMS-MaPseq的测序技术分析了细胞中HIV-1的RNA的结构,同时他们还开发出了一种名为DREEM的新型算 法来解释由相同RNA序列所假设的可变构象结构,DREEM算法即利用期望最大化原则来检测RNA的折叠效果。与此前分析人口平均值的模型相反,本文研究中,研究者揭示了整合HIV-1基因组中 RNA结构的异质性区域,除了证实在体外研究中发现的HIV-1 Rev反应元件的替代结构也存在于细胞中外,研究者还发现,关键剪接位点的替代构象或许也会影响转录物亚型的比例。
最后研究者表示,本文研究他们同事测定了RNA的剪接和胞内结构,为长期存在的科学家假设提供了一定的证据,即证实了RNA构象的异质性能够调节剪接位点的使用及病毒基因的表达量,为 后期科学家们理解HIV-1感染机体的分子机制提供了新的线索和思路。
19.Science:重大突破!揭示单个鸟苷酸决定着HIV RNA基因组的命运
doi:10.1126/science.aaz7959
人类免疫缺陷病毒(HIV, 也称为艾滋病病毒)感染了100多万美国人和全球4000万人。一项针对HIV病毒结构的新研究揭示出一个有前景的新药物靶标可用于靶向HIV感染。它发现HIV感染的细 胞可以通过两种不同的方式读取这种病毒的遗传 密码。结果就是被感染的细胞制造出这种病毒RNA的两种不同形式。相关研究结果发表在2020年4月24日的Science期刊上,论文标题为“Structural basis for transcriptional start site control of HIV-1 RNA fate”。

图片来自CC0 Public Domain。
HIV-1 RNA基因组的转录本既可以经剪接后翻译成病毒蛋白,也可以作为子代基因组被包装成新的病毒颗粒。所选择的路径取决于这种转录本是否在5′末端含有一个鸟苷酸(1G)还是两个或三 个鸟苷酸(2G或3G)。这项新的研究利用核磁共振光谱学研究发现1G转录本(即5′末端仅含有一个鸟苷酸的HIV-1 RNA基因组转录本)采用二聚体结构,该结构封存了翻译和剪接所需的末端帽 ,但暴露了与HIV-1 Gag蛋白结合的位点,其中Gag蛋白在病毒组装过程中招募HIV-1 RNA基因组。反之,2G或3G转录本可以接触到这个末端帽,但Gag结合位点被封存。因此,单个鸟苷酸作为 一个构象开关,决定了HIV-1转录本的命运。
论文第一作者Joshua Brown说,“这种功能的多样性对于这种病毒在体内复制是必不可少的。这种病毒必须在两种形式的RNA之间保持适当的平衡。几十年来,科学界已经知道HIV RNA存在两种 不同的结构形式,只是不知道是什么控制了这种平衡。我们发现单个核苷酸产生巨大的影响,这是理解HIV如何发挥作用的一个观念转变。”
20.NEJM:Fostemsavir治疗多药耐药性HIV感染者
doi:10.1056/NEJMoa1902493
对已接受多种抗逆转录病毒治疗但效果不佳的HIV感染者,急需具有新作用机制的新型抗病毒药物。HIV融合抑制剂Fostemsavir是一种潜在选择。
在23个国家开展的III期临床研究中,多药耐药HIV-1感染患者分为两组。在第一组中,患者在接受1-2种获批的抗逆转录病毒药物(与先前疗法不同)基础上,随机接受Fostemsavir (每天2 次,每次600mg)或安慰剂,为期8天, 随后接受Fostemsavir联合优化背景疗法(随机队列)。在第二个队列中,无可替换抗逆转录病毒药物选择的患者在第1天开始接受开放标签的 Fostemsavir联合优化背景治疗(非随机队列)。研究的主要终点是随机队列中HIV-1RNA水平从第1天到第8天的平均变化。
共371名患者参与研究,其中随机队列272名,非随机队列99名。第8天,Fostemsavir组HIV-1RNA水平的平均下降0.79 log10拷贝/mL,安慰剂组为0.17 log10拷贝/mL。在第48周,随机队列中 54%的患者和非随机队列中38%的患者出现了病毒应答(即HIV-1RNA水平<40个拷贝/毫升),CD4+T细胞计数的平均分别增加139个细胞/立方毫米和64个细胞/立方毫米。不良事件导致7%患者 停用Fostemsavir。在随机队列中,47例病毒学失败患者中有20例(43%)出现糖蛋白120(gp120)替换。
研究认为,HIV融合抑制剂Fostemsavir可显著减少多药耐药HIV感染患者血液RNA水平。
21.Nat Med:免疫检查点抑制剂组合使用可显著缩小猴子中的HIV病毒库大小
doi:10.1038/s41591-020-0782-y
在一项新的研究中,研究人员得出结论,利用两种癌症免疫治疗药物组合使用刺激免疫细胞,可缩小感染了猿猴免疫病毒(SIV)并接受抗病毒药物治疗的非人灵长类动物中的病毒库大小。这 种病毒库包括经过接受强效抗病毒药物治疗后仍携带SIV病毒的免疫细胞。相关研究结果近期发表在Nature Medicine期刊上,论文标题为“CTLA-4 and PD-1 dual blockade induces SIV reactivation without control of rebound after antiretroviral therapy interruption”。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
在这篇论文中,这些研究人员使用了免疫检查点抑制剂伊匹单抗(ipilimumab)和纳武单抗(nivolumab)的猴子版本,它们分别阻断抑制性受体CTLA-4和PD-1(也是两种常见的免疫检查点) 。他们观察到相比于仅接受纳武单抗的猴子,同时接受伊匹单抗和纳武单抗的猴子的T细胞具有更强的活化作用。对血液中的病毒DNA测序表明,与使用其中的一种免疫检查点抑制剂相比,两 种免疫检查点抑制剂组合使用可重新激活更多的病毒。
Paiardini说,“我们观察到组合使用CTLA-4抑制剂和PD-1抑制剂可以有效地重新激活处于潜伏状态的HIV并使之对免疫系统可见。”
在以前的研究中,仅通过单一免疫检查点抑制剂或其他免疫刺激剂可以观察到HIV病毒库的有限缩小。在这项新的研究中,仅接受免疫检查点抑制剂组合治疗的猴子表现出这种病毒库大小的持 续显著下降。这是通过“DNAscope”---一种可视化组织中受感染细胞的成像技术---和通过测量携带完整病毒DNA的CD4 T细胞(HIV和SIV的主要靶标)的频率进行测量的。尽管有这种效果,但 一旦停用抗病毒药物,在接受免疫检查点抑制剂组合治疗的猴子中HIV病毒仍会恢复到先前的水平。
22.NEJM:临床试验表明HIV药物洛匹那韦-利托那韦不能有效治疗COVID-19
doi:10.1056/NEJMoa2001282; doi:10.1056/NEJMe2005477
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,中国研究人员发现有效治疗HIV感染者的药物对COVID-19无效。相关研究结果于2020年 3月18日发表在NEJM期刊上,论文标题为“A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19”。在这篇论文中,他们描述了他们在中国武汉在COVID-19患者中 开展的一项临床试验以及他们从中获得的发现。 美国布莱根妇女医院的Lindsey Baden和Eric Rubin在同期NEJM期刊上发表了一篇标题为“Covid-19—The Search for Effective Therapy”的社论文章,讨论了这项在中国开展的临床研究。
最近,医学界注意到SARS-CoV-2和HIV都需要一种称为蛋白酶的酶才能具有传染性。先前的研究已发现蛋白酶抑制剂洛匹那韦(lopinavir)和利托那韦(ritonavir)对治疗HIV感染者有效, 这使得许多人猜测它们是否也可能有效地抵抗SARS-CoV-2。为了确定这种情形是否可能发生,这些研究人员在中国武汉开启了一项临床试验。
这项临床试验将199例晚期COVID-19患者分为两组 ,其中的一组接受标准治疗(包括补充氧气),另一组接受标准治疗并给予洛匹那韦和利托那韦。最终,共有94例患者给予了这两种蛋白酶抑制剂。不幸的是,这些研究人员发现使用这两种 药物没有益处。那些给予这两种药物的患者的表现并不好于那些没有给予它们的患者。
不过,这项临床试验存在一些局限。首先,所有患者均处于疾病晚期,这使得任何治疗都不太可能帮助他们。其次,这项临床试验规模很小。
23.两篇NEJM指出HIV治疗新方法---每月肌肉注射长效卡博替韦和利匹韦林
doi:10.1056/NEJMoa1909512; doi:10.1056/NEJMoa1904398; doi:10.1056/NEJMe2002199
根据近期发表在NEJM期刊上的两项临床研究,对HIV-1受到抑制的患者而言,长效的卡博替韦 (cabotegravir,一种HIV整合酶抑制剂)和利匹韦林(rilpivirine)的组合使用(下称长效卡 博替韦+利匹韦林)并不逊于口服度鲁特韦-阿巴卡韦-拉米夫定(dolutegravir-abacavir-lamivudine)和标准口服治疗。

图片来源:NIAID。
英国伦敦女王玛丽大学的Chloe Orkin博士及其同事们进行了一项III期随机试验(称为FLAIR临床试验),该试验涉及遭受HIV-1感染的成年人,这些患者在20周内每天接受度鲁特韦-阿巴卡韦-拉米夫定口服诱导治疗。HIV-1 RNA水平低于50 copies/mL的参与者被随机分配继续进行现行口服治疗,或改用口服卡博替韦-利匹韦林治疗一个月,然后接受长效卡博替韦+利匹韦林治疗。这些研究人员发现,在48周时接受长效卡博替韦+ 利匹韦林和口服卡博替韦-利匹韦林治疗的HIV感染者中,分别有2.1%和2.5%的患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为-0.4%;置信区间为95%, -2.8至2.1),满 足主要终点的非劣性标准(criterion for noninferiority)。
来自美国内布拉斯加大学医学中心的Susan Swindells博士及其同事们一项III期临床试验(称为ATLAS临床试验)中对血浆HIV-1 RNA水平低于50 copies/mL的患者在接受标准抗逆转录病毒药物(ART)口服治疗的至少6个月内随机分配继续 进行ART治疗,或者改为每月肌肉注射长效卡博替韦和长效利匹韦林(每组308例患者)。这些研究人员发现,在接受长效卡博替韦+利匹韦林治疗和口服治疗的患者中,分别有1.6%和1.0%的 患者的HIV-1 RNA水平达到50 copies/mL或更高(调整后的差异为0.6%; 95%的置信区间为-1.2至2.5),满足主要终点的非劣性标准。
24.Sci Trans Med:急性抗病毒疗法有助于缩小HIV病毒库
doi:10.1126/scitranslmed.aav3491
在抗逆转录病毒疗法(ART)期间,HIV会通过整合在宿主免疫细胞基因组中,形成“病毒库”,这是抗逆转录病毒疗法不能最终治愈患者的原因。研究团队多年来一直努力探究抗逆转录病毒治 疗期间HIV病毒库是如何形成的。近日,一项新的研究表明,最早建立的“病毒库”在早期阶段仍然是“敏感的”,立即启动抗逆转录病毒治疗后可能会缩小约100倍。
在《Science Translational Medicine》上发表的这项研究中,研究人员提供了对早期HIV感染关键阶段中发生的事件的见解。“在早期阶段开始抗病毒治疗,通过清除肠道相关淋巴组织和淋 巴结中大量的感染细胞池,从而大大减少了病毒库的大小。众所周知,淋巴结是感染过程中HIV优先建立病毒库的地方。
尽管这些早期接受治疗的患者的病毒库很小,但这种病毒仍然存在,因此,有人可能会怀疑这种疗法的临床益处。由于这些早期接受治疗的患者的病毒库比对照组小100倍,这些研究人员可以 合理地认为,在接受抗逆转录病毒疗法的初始阶段,根除这些较小的病毒库相对更加容易。(生物谷 Bioon.com)
25.重磅!两篇Nature揭示逆转HIV潜伏的新策略
doi:10.1038/s41586-020-1951-3; doi:10.1038/s41586-020-1946-0
如今,在第一项新的研究中,来自美国北卡罗来纳大学教堂山分校和埃默里大学的研究人员使用一种称为AZD5582的化合物来激活血液和很多不同组织中遭受HIV潜伏感染的CD4+ T细胞,这种 激活达到了令人印象深刻的水平,而且没有或几乎没有毒性。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Systemic HIV and SIV latency reversal via non- canonical NF-κB signalling in vivo”。
这项开创性的研究是由北卡罗来纳大学教堂山分校医学院的研究人员在具有功能完整的人类免疫细胞的小鼠模型中完成的,这些免疫细胞遭受HIV感染,并通过ART药物加以抑制。重要的是, 这项研究随后在埃默里大学的一项纵向多剂量实验中得到了扩展。这项纵向多剂量实验以感染了猿猴免疫缺陷病毒(SIV)并可通过ART药物加以抑制的恒河猴为研究对象。Qura Therapeutics 公司与北卡罗来纳大学教堂山分校和ViiV Healthcare公司合作,开展了基础科学研究,从而加快了动物模型中的研究工作。在人体中开始测试之前,还需开展更多的研究,但是这项研究被认 为是迈向开发治愈性疗法的重要科学步骤。
这些研究人员随后在全身组织含有可被HIV感染且可通过ART药物加以抑制的人CD4+ T细胞的小鼠模型中测试了AZD5582。他们记录了在血液和几乎所有组织(包括淋巴结、胸腺、骨髓、肝脏、 肺部和大脑)中表达的HIV病毒RNA增加了。在某些情况下,HIV病毒RNA增加了20倍以上。
他们还在遭受SIV感染且可通过ART加以抑制的恒河猴中测试了AZD5582,给它们提供多剂量的AZD5582而且是每周提供一剂量,随后发现了类似的结果。他们观察到这些恒河猴的淋巴结和血液 中的SIV RNA表达激增,这标志着一种潜伏逆转剂首次在两种动物模型中完成了这一壮举,而且几乎没有毒性。
在第二项新的研究中,Guido Silvestri博士和Chahroudi领导的埃默里大学研究人员与北卡罗来纳大学教堂山分校的研究人员合作,以一种不同的方式实现了潜伏逆转。相关研究结果于2020 年1月22日在线发表在Nature期刊上,论文标题为“Robust and persistent reactivation of SIV and HIV by N-803 and depletion of CD8+ cells”。
他们将一种抗体注射到感染HIV并通过ART加以抑制的非人灵长类动物中来清除在控制病毒感染中起着非常重要作用的CD8+ T细胞。他们随后给送细胞因子IL-15的一种改进版本,结果发现这种 组合用药让SIV RNA出现在之前未观察到的血液和组织中。针对HIV,他们在进行过AZD5582测试的相同小鼠模型中发现类似的结果。
26.Science:HIV耐药性机制新见解
doi:10.1126/science.aay4919
如今,已有许多有助于控制HIV感染的药物,包括整合酶链转移抑制剂在内。该药物家族中有四种药物:raltegravir,elvitegravir,dolutegravir和bictegravir。它们都通过与HIV的一种 被称为整合酶的关键酶类结合而起作用,以阻止其将病毒的遗传物质插入人体细胞的DNA中。尽管最初非常有效,但随着时间的流逝,HIV会对这些药物产生抵抗力。
近日,Dana-Farber癌症研究所的研究揭示了HIV对多种药物产生耐药性的机制,这一发现为开发更有效的治疗方法打开了大门。这项研究于2020年1月30日在《Science》杂志上在线发表,该 研究发现了HIV产生药物耐药性的机制。尽管这些药物通常在结合和阻断整合酶方面非常有效,但随着时间的流逝,病毒会削弱药物的能力,从而使HIV再次起作用。
“我们的结构生物学方面的研究使得我们能够看到药物与病毒酶活性位点的精确结构。这一结构将为设计更有效的整合酶抑制剂提供参考,从而可以改善数百万HIV感染者的生活。”美国Dana- Farber癌症研究所癌症免疫学和病毒学教授Alan Engelman说。
27.Science:从结构上揭示INSTI药物结合HIV整合体机制
doi:10.1126/science.aay8015
在一项新的研究中,来自美国国家糖尿病与消化疾病研究所、美国国家癌症研究所、沙克生物研究所和斯克里普斯研究所的研究人员发现了一类强大的HIV药物如何结合HIV整合体(intasome )的一个关键部分。通过首次解析出这种整合体与不同药物结合在一起时的三维结构,他们发现了是什么让这类药物如此有效。这项研究提供了可能有助于设计或改进HIV新疗法的重要见解。 相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for strand transfer inhibitor binding to HIV intasomes”。
HIV整合体是这种病毒感染的一种关键结构,它由HIV蛋白整合酶(integrase)和病毒DNA链组成,而且是在这种病毒入侵人细胞时形成的。这种整合体进入人细胞,随后进行必要的化学反应 ,从而将这种病毒的遗传物质整合到人DNA中。一些称为整合酶链转移抑制剂(integrase strand transfer inhibitor, INSTI)的药物成功地阻断这种整合体;当它不能将病毒DNA整合到人 类基因组中时,HIV就不能够感染人细胞。目前,有四种INSTI药物获得美国食品药物管理局(FDA)的批准,还有一些正在开发当中。
在这项新的研究中,Lyumkis的研究团队获得了HIV整合体被四种INSTI---市售药物bictegravir;三种称为4f、4d和4c 的实验性化合物---之一阻断时的结构。他们使用了倾斜单粒子低温电子 显微镜(single-particle cryo-electron microscopy(他们帮助优化的一种成像技术)来揭示每种HIV整合体-药物复合物的结构。
Lyumkis的第一个观察结果是,这些药物与HIV整合体结合在一起时与它们与PFV整合体结合在一起时有何不同。比如,化合物4f在与PFV整合体结合时会回环到它自身上,而在与HIV整合体结合 时却保持相对平坦,这些细节可以帮助人们改善潜在的未来分子的结合特性。
28.Nat Med:抗体疗法可增强HIV感染者体内的T细胞免疫反应
doi:10.1038/s41591-019-0747-1
大多数HIV感染者通过服用抗逆转录病毒药物(ART)来控制这种病毒。尽管这种药物非常有效,但体内潜伏的HIV病毒库的存在意味着这些患者需要终身治疗。已有研究表明联合使用两种抗 HIV抗体的免疫疗法像ART药物那样也可以抑制HIV。如今,在一项新的研究中,来自加拿大蒙特利尔大学医院研究中心、美国洛克菲勒大学和德国科隆大学的研究人员发现在ART药物停用期间 ,使用这些抗体对HIV感染者的免疫系统产生影响。相关研究结果于2020年2月3日在线发表在Nature Medicine期刊上,论文标题为“Combination anti-HIV-1 antibody therapy is associated with increased virus-specific T cell immunity”。
这些研究人员描述了注射这些强效的称为中和抗体的抗HIV抗体如何与特异性识别HIV病毒的T细胞反应增强相关。T细胞是重要的白细胞,有助于控制诸如HIV感染之类的慢性感染。这项研究显 示了人类免疫系统的两个分支---体液免疫(抗体)和细胞免疫(T细胞)---之间的意外相互作用和潜在影响。
论文共同通讯作者、蒙特利尔大学医院研究中心研究员Daniel E. Kaufmann教授说,“这确实是概念验证。在这项研究中,我们分析了一项临床试验中参与者的血样,在这项临床试验中,我们 的合作者使用了实验室产生的单克隆抗体来阻断这种病毒。所有参与者在ART药物停用后至少维持了15周的病毒抑制。”
29.Cell:强效抗体1-18可限制HIV耐药性产生
doi:10.1016/j.cell.2020.01.010
如今,在一项新的研究中,来自德国科隆大学和美国加州理工学院的研究人员鉴定出一种新的称为1-18的抗体。这种抗体是强效的,可抵抗97%的接受测试的HIV变体。因此,1-18是迄今为止 描述的最好的HIV广泛中和抗体之一。相关研究结果于2020年1月30日在线发表在Cell期刊上,论文标题为“Restriction of HIV-1 Escape by a Highly Broad and Potent Neutralizing Antibody”。论文通讯作者为科隆大学的Florian Klein博士。论文第一作者为科隆大学的Philipp Schommers博士、Henning Grüll博士和加州理工学院的Morgan E. Abernathy博士。
这些研究人员详细确定了1-18抗体的作用机制。1-18结合并灭活HIV的一个表面结构,这是特别有意义的,毕竟这个表面结构对这种病毒的感染和复制至关重要。
在一种可再现人体HIV感染的小鼠模型中,这些研究人员研究了这种新鉴定出的抗体1-18的治疗功效。在这种模型中,其他的广泛中和抗体因HIV对它们快速地产生耐药性而仅显示出短期效应 。相反,用抗体1-18进行治疗可抑制病毒载量,而且在治疗期间维持这种抑制。Grüll说,“这些结果表明与其他抗体相比,HIV对抗体1-18的耐药性受到限制。”
30.Science子刊:在经过诱导的记忆T细胞亚群中,仅1.7%的完整HIV-1原病毒释放出具有复制能力的病毒
doi:10.1126/scitranslmed.aax6795
治愈HIV-1感染的主要障碍是潜伏在静止性CD4+ T细胞中的HIV-1病毒库,这使得这种病毒能够以一种让免疫系统无法检测到或不受抗逆转录病毒药物(ART)影响的形式持续存在。一种治愈策 略涉及诱导病毒基因表达,以便可以消除潜伏感染的T细胞。人们已经提出潜伏的HIV-1可能富含在特定的CD4+ T细胞亚群中,这将允许潜伏逆转药物更特异性地靶向它们。目前尚不清楚这种 潜伏的HIV-1病毒库是否主要存在于CD4+ T细胞的特定亚群中,这一点可能对理解这种HIV-1病毒库的稳定性和开发治愈性疗法有影响。近期的研究已表明HIV-1感染的CD4+ T细胞的增殖是这种 潜伏HIV-1病毒库产生和持久性存在的主要因素,并且在体内发生克隆扩增的潜伏感染T细胞可以在体外增殖而不产生病毒颗粒。

当遭受HIV潜伏感染的免疫细胞受到重新激活时,这种细胞开始产生HIV病毒颗粒(红色),这些病毒颗粒出芽并从细胞(蓝色)中释放出来,图片来自NIAID。
在某些CD4+记忆T细胞亚群中,HIV-1原病毒(provirus)可能处于更深的潜伏状态,这会使得这些细胞发生增殖而不产生病毒蛋白,从而可以逃避免疫清除。为了评估这种可能性,在一项新 的研究中,来自美国约翰霍普金斯大学等研究机构的研究人员使用了多重刺激病毒生长试验,在体外对来自10名接受ART药物治疗的HIV-1感染者的静止性初始CD4+ T细胞、中枢记忆CD4+ T细 胞(TCM)、过渡记忆CD4+ T细胞(TTM)和效应记忆CD4+ T细胞(TEM)进行培养。相关研究结果发表在2020年1月29日的Science Translational Medicine期刊上,论文标题为“Different human resting memory CD4+ T cell subsets show similar low inducibility of latent HIV-1 proviruses”。
平均而言,在所有T细胞亚群中,在这些细胞受到刺激后,只有1.7%的完整HIV-1原病毒在诱导后转录病毒基因并且释放出具有复制能力的病毒。他们没有在任何T细胞亚群中发现完整或可诱 导的原病毒的持续富集。此外,他们观察到这些典型的记忆T细胞亚群在体外激活后具有显著的可塑性,而且诱导感染性病毒释放的能力在人与人之间存在显著差异。这一发现使得基于记忆T 细胞亚群的HIV-1靶向治疗的愿景变得更加复杂。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


