4月Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2022-04-28 10:27
时间匆匆易逝,转眼间4月份即将结束,在即将过去的4月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时间匆匆易逝,转眼间4月份即将结束,在即将过去的4月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:揭示TMEM106B以一种依赖年龄的方式形成淀粉样蛋白细丝
doi:10.1038/s41586-022-04650-z
在一项新的研究中,来自英国剑桥MRC分子生物学实验室和美国印第安纳大学等研究机构的研究人员确定了在神经退行性疾病中发现的一种常见的蛋白---TMEM106B---以一种依赖年龄的方式形成淀粉样蛋白细丝。相关研究结果于2022年3月28日在线发表在Nature期刊上,论文标题为“Age-dependent formation of TMEM106B amyloid filaments in human brains”。
许多年龄依赖性的神经退行性疾病,如阿尔茨海默病和帕金森病,富含淀粉样蛋白斑块。在这篇新论文中,这些作者利用电子低温显微镜结构测定,发现溶酶体II型跨膜蛋白TMEM106B也在人类大脑中形成淀粉样蛋白细丝,但独特的是,它以年龄依赖的方式形成,可能与疾病类型无关。
论文共同作者、印第安纳大学医学院病理学与实验医学教授Bernardino Ghetti博士说,“在此之前,人类组织中丰富的神经元内淀粉样蛋白细丝的存在总是与疾病有关。虽然TMEM106B与额颞叶痴呆症和其他疾病有关,但TMEM106B聚集和疾病之间的因果关系的证据现在仍不清楚。”
这些作者研究了22个有大量淀粉样蛋白沉积的人,包括散发性和遗传性阿尔茨海默病,以及三个神经系统正常人的额叶皮层。他们还研究了三种TMEM106B细丝,这些细丝与疾病之间没有明确的关系。在年老而非年轻的神经系统正常人的大脑中发现的TMEM106B细丝表明这些TMEM106B细丝的形成与年龄有关,而且与神经退行性疾病之间没有明确的关系。此前,TMEM106B已被确定为额颞叶变性的一个风险因素,但是这项研究表明该蛋白可能不再与疾病的原因有关。
【2】Nature:揭示与FTLD-TDP相关的淀粉样蛋白是TMEM106B而不是TDP-43
doi:10.1038/s41586-022-04670-9
额颞叶变性(frontotemporal lobar degeneration, FTLD)是第三大最常见的神经退行性疾病,仅次于阿尔茨海默病和帕金森病。FTLD通常出现在45~64岁的人群中,伴有行为改变或语言能力的逐渐下降。作为FTLD的一种亚型,伴有TDP-43阳性包涵体的FTLD(FTLD-TDP)的特点是具有某些临床症状和病理神经元包涵体,这种TDP-43阳性包含物可通过TAR DNA结合蛋白(TDP-43)免疫反应加以检测。
根据TDP-43的分布和形态,FTLD-TDP可分为5个亚型:A型FTLD-TDP、B型FTLD-TDP、C型FTLD-TDP、D型FTLD-TDP和E型FTLD-TDP,这些亚型与潜在的遗传学和临床表现部分相关。A型FTLD-TDP和B型FTLD-TDP是最常见的两种FTLD-TDP。A型FTLD-TDP的特点是主要在皮层2中存在许多神经元胞质TDP-43包涵体和较短的营养不良神经突。B型FTLD-TDP的特点是许多胞质TDP-43包涵体分布在所有皮层中,营养不良神经突很少。
C型FTLD-TDP的特点是胞质TDP-43包涵体较少,主要在皮层2中存在大量较长的营养不良神经突。D型FTLD-TDP的特点是胞质TDP-43包涵体很少,在所有皮层含有许多扁豆状的神经元核内包涵体,而且与VCP基因突变相关联。E型FTLD-TDP的特点是疾病进展快,具有广泛的TDP-43病理和独特的TDP-43羧基端片段(CTF)模式。
【3】Nature:新研究揭示出STING蛋白的一个新的结合位点
doi:10.1038/s41586-022-04559-7
在一项新的研究中,来自德克萨斯大学西南医学中心的研究人员发现对一种通常被称为STING的关键免疫蛋白进行近原子分辨率的成像,发现了它的一个以前未被认识的结合位点,该结合位点似乎对发起免疫攻击至关重要。这些研究结果可能会带来操纵STING的新方法,以促进更强的免疫反应或阻止它在自身免疫性疾病中的作用。相关研究结果于2022年4月6日在线发表在Nature期刊上,论文标题为“Activation of STING by targeting a pocket in the transmembrane domain”。
论文共同通讯作者、德克萨斯大学西南医学中心药理学与生物物理学教授Xuewu Zhang博士说,“这项研究首次提供了STING激活状态的精确结构图,这对于理解它在正常免疫和自身免疫疾病中的作用至关重要。”STING是先天免疫系统的核心部分,而先天免疫系统身体对抗病毒、细菌和癌症的第一道防线。在一种称为cGAS的传感蛋白检测到细胞中的外来DNA后,它产生了一种称为环状GMP-AMP(cGAMP)的信使分子,从而激活了STING。接着,STING启动了几个信号通路,刺激炎症分子和化学信号的产生,从而促使细胞清理废弃物以消灭入侵者。
在与德克萨斯大学西南医学中心分子生物学教授Zhijian Chen博士的合作下,Zhang实验室和Bai实验室此前报告了用低温电镜(cryo-EM)拍摄的首批STING结构图。尽管他们阐明了控制STING活性的一些基本机制,但是这种蛋白究竟是如何转换为活性形式的一直不清楚。为了回答这个问题,Zhang实验室和Bai实验室将纯化的STING蛋白与cGAMP混合,并使用冷冻电镜对所产生的产物进行成像。然而,他们看观察到较少的活化STING分子,而且那些存在的活化STING分子也是不稳定的。
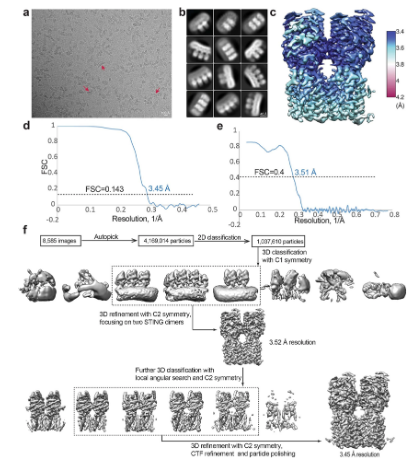
与cGAMP和C53结合在一起时的人类STING四聚体的图片处理程序。
图片来源:Nature, 2022, doi:10.1038/s41586-022-04559-7。
【4】Nature:利用小分子化合物靶向非编码RNA Xist,有望治疗一系列X连锁疾病
doi:10.1038/s41586-022-04537-z
核糖核酸(RNA)在人类健康中发挥着许多作用。在一项新的研究中,来自麻省总医院等研究机构的研究人员提供了强有力的证据表明RNA也可能成为药物开发的可行靶标。相关研究结果发表在2022年4月7日的Nature期刊上,论文标题为“Targeting Xist with compounds that disrupt RNA structure and X inactivation”。在人类基因组计划确定的大约2万种人类蛋白中,目前几乎所有的药物靶向大约700种疾病相关的蛋白之一。然而,近年来,人们对扩大“药物可靶向的(druggable)”靶标名单以包括RNA的兴趣越来越大。在细胞中,脱氧核糖核酸(DNA)携带表达蛋白的遗传密码。一段DNA被复制,或通过转录成产生编码蛋白的RNA,然后通过翻译产生蛋白。然而,人类基因组产生的绝大部分RNA---98%---是“非编码”的。
论文通讯作者、麻省总医院分子生物学系Jeannie Lee博士说,“这些非编码RNA在基因组中发挥着非常重要的作用,而且我们现在了解到,在这种非编码的基因组区域发生的突变会导致疾病。这些RNA基因可能远远多于蛋白编码基因。如果我们能够靶向这些RNA,我们将极大地增加我们能找到治疗患者的药物的范围。”
然而,制药业历来对追求RNA作为药物靶标犹豫不决。蛋白往往有稳定的形状,或者说构象,这使得它们成为最佳的靶标:药物与蛋白的结合就像钥匙插入锁中。Lee解释说,相比之下,RNA往往是高度灵活的,并且能够拥有多种构象。Lee说,“如果锁不断改变形状,那么钥匙就不会起作用。非编码RNA的不稳定性使得制药公司不愿意投资尝试开发针对它们的药物。然而,人们已知道RNA上的一些区域保持着稳定的构象,但是找到这样的区域一直是一个挑战。”
Lee和和她的团队在麻省总医院研究RNA及其在一种称为X染色体失活(XCI)的生物过程中的作用,其中XCI使得雌性哺乳动物的一个X染色体拷贝失活,是正常发育所必需的。在这项新的研究中,这些作者看看RNA是否可以成为可行的药物靶标。他们的研究重点是一种叫做Xist的非编码RNA,它能使X染色体上的基因沉默。找到一种干扰这一过程并重新激活休眠的X染色体的方法,可能有助于开发治疗由X染色体上的突变引起的遗传疾病(称为X连锁疾病,比如雷特综合征和脆性X综合征)的方法。
【5】Nature:重磅!科学家绘制出人类血液干细胞发育的首个完整图谱!
doi:10.1038/s41586-022-04571-x
由于无法识别造血干细胞在机体不同造血部位的出现和成熟,因此关于人类造血干细胞的个体发生过程的定义,研究人员并不清楚。近日,一篇发表在国际杂志Nature上题为“Mapping human haematopoietic stem cells from haemogenic endothelium to birth”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究开发出了一种能追踪人类胚胎中血液干细胞发育每个步骤的史无前例的路线图,这或许能为科学家们提供一种蓝图在实验室中制造出完全功能性的血液干细胞,同时这一研究结果也能帮助扩大治疗多种血液癌症和遗传性血液疾病的新型疗法。
血液干细胞,又称为造血干细胞,其具有无限自我复制的能力,并能分化为人类机体每一种血细胞类型,几十年来,临床医生已经使用来自供体骨髓和新生儿脐带中的血液干细胞来用于作为挽救生命的移植疗法治疗血液和免疫性疾病,然而,这些疗法往往受到了匹配供体短缺的限制,以及脐带血中干细胞数量较少的阻碍。为此,研究人员就想克服这种障碍,尝试在实验室中利用人类多能干细胞来制造血液干细胞,其或许能产生机体中任何的细胞类型;但研究人员一直并未取得成功,部分是因为缺少准则来在实验室中制造出分化为自我更新血液干细胞(而并非短期存活的血液祖细胞)的实验室培育细胞,血液祖细胞仅能产生有效的血细胞类型。
研究者Mikkola说道,目前并没有科学家能成功利用人类多能干细胞来旨在功能性的血液干细胞,因为我们并没有足够了解我们所要尝试产生的细胞。本文中,研究人员所绘制出的新的路线图或许就能帮助研究人员理解两种细胞类型之间的根本差异,这对于创造出适合移植疗法使用的细胞至关重要。如今研究人员拥有了一本“手册”关于如何在胚胎中旨在造血干细胞,以及其如何获得对病人非常有用的具有独特特性的手册。
【6】Nature:科学家利用化学方法将人类体细胞塑造为多能干细胞
doi:10.1038/s41586-022-04593-5
细胞身份是在发育过程中建立起来的,以获得和维持体细胞的特殊细胞功能。细胞重编程可以操纵细胞特性,使其产生所需的细胞类型,在疾病模型、药物发现和再生医学中提供广泛的应用。利用卵母细胞成分和转录因子等细胞因子,可以强制体细胞重编程为多能干(PS)细胞。有研究证明,化学刺激可以通过简单地暴露于小分子将小鼠体细胞重新编程为PS细胞。然而,人类体细胞由于其稳定的表观基因组而难以进行化学刺激。并降低可塑性;因此,通过化学重编程诱导人类多能干细胞具有挑战性。近日,北京大学基础医学院再生医学工程研究中心的研究学者在Nature上发表了一篇题为“Chemical reprogramming of human somatic cells to pluripotent stem cells”的学术论文,他们认为,创建中间可塑性状态是小分子解锁人类体细胞有限效力并允许产生人PS(hPS)细胞的关键。
为了诱导人体细胞去分化,研究人员鉴定小分子以破坏成纤维细胞身份,促进细胞增殖并重新激活去分化相关基因,并在此基础上,添加了表观遗传调节剂5-氮杂胞苷和反式环丙胺,以调节保护体细胞身份的全局DNA甲基化。然后,通过筛选小分子激活多能性基因OCT4表达,建立人类多能性网络。对于在人胚胎干(hES)细胞培养基中显示出典型的hES细胞形态的菌落,称为人类化学诱导的PS(hCiPS)细胞。
研究人员对中间塑性状态细胞进行重新编程,以获得发育中的人肢芽细胞的特征,该过程类似于蝾螈肢体再生的情况,在去分化过程中,支配胚胎肢体发育的基因被重新激活。随后,他们在人类化学重编程过程中确定了三个连续的关键阶段:在早期阶段(阶段I和阶段II)获得再生样基因程序,激活XEN程序(阶段III),最后建立朴素多能网络(阶段IV)。为了确定JNKIN8如何调节中间可塑性状态,他们在使用或不使用JNKIN8处理后的II阶段进行了scRNA-seq分析,发现JNK途径是通过调节促炎症相关途径来重建人类体细胞中可塑性的主要障碍,对它的抑制对于通过抑制促炎症途径诱导细胞可塑性和类似再生的程序是必不可少的。
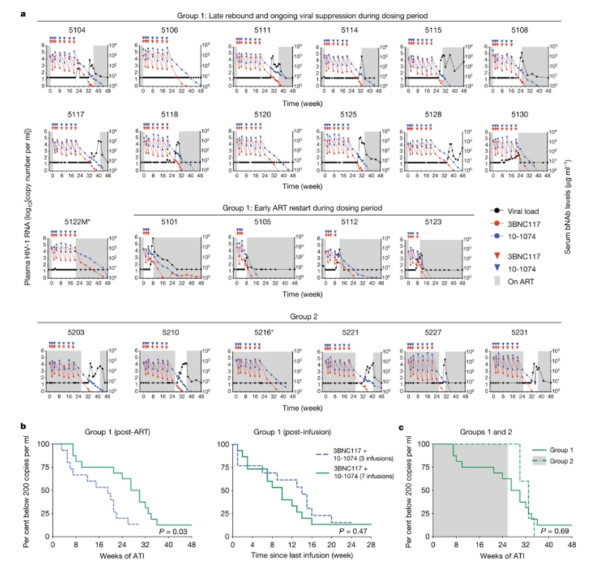
个体参与者的病毒学和药代动力学随访。
【7】Nature:科学家发现抗HIV-1抗体治疗可抑制病毒感染
doi:10.1038/s41586-022-04597-1
HIV-1感染仍然是一个无法治愈的公共卫生问题。抗逆转录病毒疗法(ART)在抑制病毒复制和预防疾病进展方面非常有效,但由于潜伏前病毒库稳定地整合到CD4 T细胞基因组中,因此需要终身药物管理。在没有抗逆转录病毒治疗的情况下,向人类施用抗HIV-1广泛中和抗体(bNAbs)是安全的,并且能够有效地预防感染,降低病毒血症和维持抗体敏感病毒的病毒抑制。有人提出,广泛中和抗体可以作为ART的辅助药物,或作为旨在诱导长期无ARTHIV-1缓解的独立维持治疗。近日,洛克菲勒大学的研究学者们在Nature上发表了一篇题为“Prolonged viral suppression with anti-HIV-1 antibody therapy”的学术论文,评估了重复bNAb联合治疗维持长期病毒抑制的有效性及其对HIV感染者潜伏病毒库的大小和组成的影响。
在本研究中,研究人员进行了一项临床研究,其中HIV感染者在存在或不存在ART的情况下,在20周内接受了七剂两种广泛中和抗体3BNC117和10-1074的组合,对其安全性、耐受性和抗病毒活性进行了研究。
研究发现,3BNC117和10-1074的药代动力学特征在病毒抑制期间与同时存在的抗逆转录病毒药物无关,并且在20周内多次给药后不会改变。在没有预先筛查抗体敏感性的情况下,17名(76%)可评估的1组受试者中有13名在ART停用后至少20周内保持病毒抑制。在第20周后仍然受到抑制的个体中,反弹时3BNC117和10-1074的平均血清浓度分别为3.5和28.3μg·ml?1。为了检查病毒单克隆抗体敏感性测试对病毒反弹时间的潜在影响,研究人员对储库和血浆反弹病毒进行了事后分析。研究发现,事后敏感性分析并不能预测病毒反弹的时间。在病毒被抑制20周以上的个体中,当其中一种抗体的血清浓度达到10μg·ml?1以下时,会出现反弹的病毒血症。在接受所有七个抗体剂量的人中,有两个人在一年后保持了抑制。抗体治疗6个月后进行的储库分析显示完整的前病毒储库的大小和组成发生了变化。相比之下,这些人的缺陷库没有明显的减少。
【8】Nature:科学家利用人类多能干细胞生成3D泪腺类器官!
doi:10.1038/s41586-022-04613-4
泪腺是眼睛的主要外分泌腺体。它们位于眼眶内,上眼睑后面,朝向每只眼睛的颞叶侧,分泌泪液作为泪膜的主要成分。泪腺对建立和维持健康的泪膜、保持良好的视力有重要作用。泪腺功能障碍和泪液分泌减少与一系列病因有关,并且是最常见的自身免疫性疾病之一——斯约克伦综合症的特征,在这种情况下会导致干眼症。胎儿哺乳动物的泪腺细胞具有再生能力。然而,在成人中,泪腺的再生能力似乎很小。因此,科学家们将泪腺确定为旨在使用人多能干(PS)细胞进行再生治疗和药物发现的研究靶标。
近日,来自日本大阪大学的研究学者在Nature上发表了一篇题为“Generation of 3D lacrimal gland organoids from human pluripotent stem cells”的研究论文,他们从人类多能干细胞生成了3D泪腺类器官。
在本研究中,他们鉴定了具有泪腺原基特征的细胞,这些细胞出现在从人类多能干细胞培养的二维眼样类器官中。含有眼表上皮样细胞的SEAM区3会产生泪腺的前体。他们采用流式细胞仪对从分离的泪腺样簇中获得的细胞进行分析,使用先前确定的抗体组合(抗ITGB4、抗SSEA-4和抗CD200)来识别眼表上皮干细胞。研究发现,泪腺样细胞簇被纳入SEAM内的眼表上皮干细胞群中,细胞群(CD200+?ITGB4SSEA-4)被鉴定为由hiPS细胞制造的泪腺样类器官的起源。研究人员筛选了泪腺样类器官形成的最佳培养基,即EGF/Y-27632培养基,并在此培养基上形成了泪腺样组织类器官。当通过细胞分选分离并在规定的条件下生长时,这些细胞形成了一个三维的泪腺样组织器官,具有导管和尖头,通过出芽和分支得以实现。克隆集落分析表明,该类器官起源于多潜能的眼表上皮干细胞。器官体在形态、免疫标记特征和基因表达模式方面与本地泪腺有明显的相似性,当移植到受体大鼠的眼睛附近时,会发生功能成熟,形成管腔并产生泪膜蛋白。
doi:10.1038/s41586-022-04596-2
什么物质能进入大脑,什么物质不能进入大脑,都受到严格的控制。在一项新的研究中,来自弗莱堡大学等研究机构的研究人员如今研究了覆盖在大脑血管表面并加强血脑屏障的吞噬细胞(phagocyte)。他们发现吞噬细胞只有在出生后才会按照规定的逐步发育程序完全成熟。在此之前,人们一直认为这一过程是在胚胎发育期间完成的。这些研究结果起初是在转基因小鼠系上获得的,并在人类样本上得到证实。它们有望为大脑疾病的产生和治疗提供重要的新见解。相关研究结果于2022年4月20日在线发表在Nature期刊上,论文标题为“Specification of CNS macrophage subsets occurs postnatally in defined niches”。
论文共同通讯作者、弗莱堡大学医学中心神经病理学研究所医学主任Marco Prinz教授说,“我们能够发现,我们研究的这些免疫细胞在出生前不久从脑膜迁移到大脑的血管中,并在那里成熟。这一过程可能在出生后几周才完成,这可能部分上解释为什么大脑在生命之初如此脆弱。这些称为巨噬细胞的吞噬细胞成熟的时间很晚,这让我们非常惊讶,因为它们的祖细胞在很久之前就已经存在于大脑中。”
此外,这些作者能够首次证实作为大脑的结构赋予细胞,血管为大脑巨噬细胞的正常发育发送重要信号。血脑屏障是由大脑血管上的细胞形成的。它们控制哪些物质可以进入大脑,哪些不能。这保护了大脑免受有害物质和病原体的侵害。在传染性疾病、某些脑肿瘤和缺氧的情况下,血脑屏障特别容易渗透。
Prinz补充说,“除了血脑屏障之外,我们研究的这些免疫细胞还控制着哪些物质可以从血液中到达脑细胞,它们吞噬病原体并防止过度炎症。它们还参与了癌症、阿尔茨海默病和多发性硬化症的产生。我们的发现对于更好地了解这些疾病和在未来开发治疗方法可能很重要。”

STING在SARS-CoV-2感染晚期炎症反应中的作用
图片来源: https://doi.org/10.1038/s41392-022-00967-3
【10】Nature:STING,SARS-CoV-2免疫病理学的关键调控因子
doi: 10.1038/s41392-022-00967-3
最近,Domizio等人在《自然》杂志上发表的一项研究揭示了严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染后期异常免疫病理的潜在机制。干扰素基因刺激物(STING)在冠状病毒病2019年(新冠肺炎)期间由线粒体DNA(MtDNA)诱导的肺泡-毛细血管细胞因子风暴中发挥着独特的作用。研究发现STING激动剂通过触发I型干扰素(IFN)反应来阻断SARS-CoV-2的感染,而另一些研究发现SARS-CoV-2通过促进细胞与细胞的融合而诱导染色质DNA进入胞浆,从而激活cGAS-STING信号。
近日,浙江大学研究者们在“Signal Transduction and Targeted Therapy”杂志上发表了题为“STING, a critical contributor to SARS-CoV-2 immunopathology”的评论性文章,本文对环状GMP-AMP合成酶(CGAS)-STING通路在SARS-CoV-2感染时肺部炎症中的作用提供了新的视角。新冠肺炎疫情造成了巨大的生命损失,并拖累了全球经济。有报道称,I型干扰素对SARS-CoV-2感染有较大影响,且其作用效果与剂量有关。在感染的晚期,持续高水平的I型干扰素推动免疫病理。因此,在新冠肺炎治疗过程中,适当地调节I型干扰素信号通路是至关重要的。
cGAS-STING通路是I型干扰素应答的重要组成部分。已有多项研究报道cGAS-STING通路参与SARS-CoV-2感染。STING激动剂DiABZI通过刺激I型干扰素反应有效地阻止SARS-CoV-2感染。Rui等人揭示SARS-CoV-2通过ORF3a和3CL抑制cGAS-STING途径,而周等人表明SARS-CoV-2通过Spike蛋白促进细胞间融合,导致染色质DNA从细胞核穿梭,最终触发cGAS-STING途径。SARS-CoV-2是否通过其他机制在肺泡-毛细血管界面激活cGAS-STING通路仍有待研究。(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


