1型肝肾综合征(HRS-1)药物!特利加压素(terlipressin)遭美国FDA拒绝批准,已在多国上市!
来源:本站原创 2020-09-15 15:49
terlipressin已在多个国家获批,该药是强效血管加压素类似物,可逆转肾功能恶化。

2020年09月15日讯 /生物谷BIOON/ --Mallinckrodt是一家总部位于英国的全球性专业制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已针对terlipressin(特利加压素)治疗1型肝肾综合征(HRS-1)成人患者的新药申请(NDA)发布了一封完整回应函(CRL)。在CRL中,FDA表示,根据现有数据,该机构不能批准terlipressin目前的NDA,需要更多信息来支持terlipressin治疗HRS-1患者积极风险-益处预测。
值得一提的是,今年7月,FDA心血管和肾脏药物咨询委员会(CRDAC)以8票赞成、7票反对的投票结果,建议批准terlipressin。不过,该委员会的建议对FDA没有约束力。
在美国,HRS-1每年影响3-4万名患者,目前还没有批准治疗HRS-1的药物疗法。如果获得批准,terlipressin将成为美国第一个治疗HRS-1成人患者的药物。此前,FDA授予了terlipressin快速通道资格(FTD)和孤儿药资格(ODD)。
Terlipressin化学结构式(图片来源:medchemexpress.cn)
肝肾综合征(HRS)是发生在重症肝病如肝硬化合并腹水、急性肝衰竭和酒精性肝炎患者中以肾功能损伤为主要表现的一种严重并发症。1型肝肾综合征(HRS-1)是一种急性危及生命的综合征,在肝硬化患者中导致快速进行性急性肾功能衰竭,如果不进行治疗,该病的中位生存时间约为2周,3个月内死亡率超过80%。最近发表的一项研究显示,美国的出院数据表明,住院死亡率为34.2%(n=1133),另有14.4%(n=475)的患者被送往临终安养院。
terlipressin是一种强效的血管加压素(vasopressin)类似物,选择性作用于小动脉的平滑肌细胞上的V1受体发挥作用。在美国和加拿大,该药正被研究用于治疗HRS-1。在美国和加拿大以外地区,terlipressin已被多个国家批准使用,几十年来,该药一直是治疗HRS-1患者的标准护理疗法。在terlipressin已上市的国家中,terlipressin联用白蛋白是目前推荐的HRS-1标准护理方案。
Mallinckrodt执行副总裁兼首席科学官Steven Romano医学博士表示:“虽然我们对美国FDA针对terlipressin发布完整回应函感到失望,但我们仍然对我们3期CONFIRM研究数据的强度充满信心,这是在这种罕见疾病中开展的最大规模的临床试验。HRS-1是一种复杂的疾病,影响着一个危重的患者群体,目前在美国还没有获批的治疗方法。我们对美国FDA的决定感到惊讶和不同意,并继续致力于寻求所有可用的选择,继续与FDA合作,寻求批准terlipressin,以帮助解决这一难治和危及生命的综合征。”
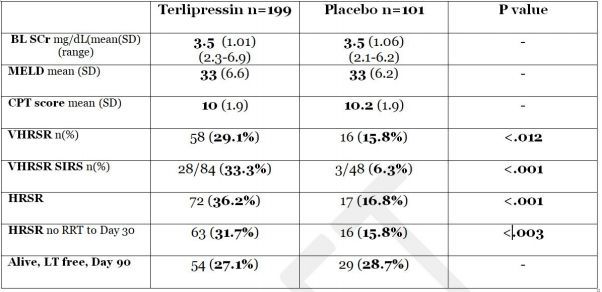
terlipressin的新药申请(NDA),部分基于III期CONFIRM试验(NCT02770716)的结果。这是有史以来针对HR-1患者开展的最大规模前瞻性研究(n=300),也是持续17年开发terlipressin以供美国和加拿大上市的成果。该研究的初步结果已在2019年美国肝病研究协会(AASLD)年会上公布,与安慰剂+白蛋白治疗组相比,terlipressin治疗组肾功能恶化明显逆转、缓解持久、早期肾脏替代疗法(RRT)的需求减少。
CONFIRM试验应用了严格标准来定义HRS-1,结果显示:与安慰剂+白蛋白治疗组相比,terlipressin+白蛋白治疗组有统计学上显著更高比例的患者达到了确认HRS逆转(VHRSR)的主要终点(29.1% vs 15.8%,p=0.012)。VHRSR定义为:2次连续的血清肌酐[SCr]值≤1.5mg/dL,在第14天前或出院前至少间隔2小时,在第2次SCr≤1.5mg/dL后,受试者在无肾脏替代疗法[RRT]的情况下至少存活10天。
此外,terlipressin在研究的4个预先指定的次要终点方面也表现出优势,包括:(1)HRS逆转,定义为第14天前或出院前SCr≤1.5mg/dL(患者比例:36.2% vs 16.8%,p<0.001)。(2)持久/维持HRS逆转,定义为在30天内在不进行RRT/透析的情况下维持HRS逆转(患者比例:31.7% vs 15.8%,p<0.003)。(3)系统炎症反应综合征(SIRS)亚组中的HRS逆转(患者比例:33.3% vs 6.3%,p<0.001)。(4)第30天前,确认HRS逆转无HRS复发(患者比例:24.1% vs 15.8%,p=0.092)。
安全性方面,2组不良事件(AE)相似,terlipressin治疗组有65%(n=130)的患者出现严重不良事件,安慰剂组为60.6%(n=60)。最常见的严重不良事件包括呼吸衰竭(10% vs 3%)、腹痛(5% vs 1%)。(生物谷Bioon.com)
原文出处:Mallinckrodt Receives a Complete Response Letter from the U.S. Food and Drug Administration (FDA) for Terlipressin for the Treatment of Hepatorenal Syndrome Type 1 (HRS-1)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


