IMMUNITY:一种SARS-CoV-2抗体通过协同识别病毒易损部位来广泛中和SARS相关冠状病毒及其变体
来源:生物谷 2021-08-26 17:47
与针对其他突变RNA病毒的抗体类似,针对抗原发散病毒的强效中和活性和广度是大多数CoV2中和抗体的不相容特征。
CoV2中和抗体的主要表位位于刺突蛋白的受体结合域(RBD),根据抗原-抗体复合物的结构,RBD表位分为4类,其中1类和2类表位与血管紧张素转换酶2 (ACE2)结合位点重叠,从而构成高效中和抗体的主要靶点。然而,CoV2和其他冠状病毒(CoVs)之间受体结合位点(RBS)序列的低保守性降低了RBS抗体交叉中和多种CoV的可能性;此外,由于RBS表位的抗原漂移,许多RBS抗体在单一治疗使用下容易受到CoV2逃逸突变的影响。因此,与针对其他突变RNA病毒的抗体类似,针对抗原发散病毒的强效中和活性和广度是大多数CoV2中和抗体的不相容特征。
图片来源:https://doi.org/10.1016/j.immuni.2021.08.025
有效中和SARS-CoV-2抗体通常针对刺突蛋白RBS,但RBS表位的可变性阻碍了多种沙贝病毒(sarbecovirus)和漂移病毒的广泛中和。该研究使用人源化小鼠鉴定了一种带有种系VH基因的RBS抗体,该抗体可有效中和SARS相关冠状病毒,包括SARS-CoV和SARS-CoV-2变体。X射线晶体学显示非RBS保守位点的重链和RBS的轻链协同识别,结合角模拟了ACE2受体,RBS高变区的最小足迹有助于中和的广度,这通过IgG3类别转换得到增强。协同结合导致SARS-CoV和新出现的SARS-CoV-2变异体被广泛中和,广泛中和活性的结构基础可以为广谱疗法和疫苗的设计提供信息。

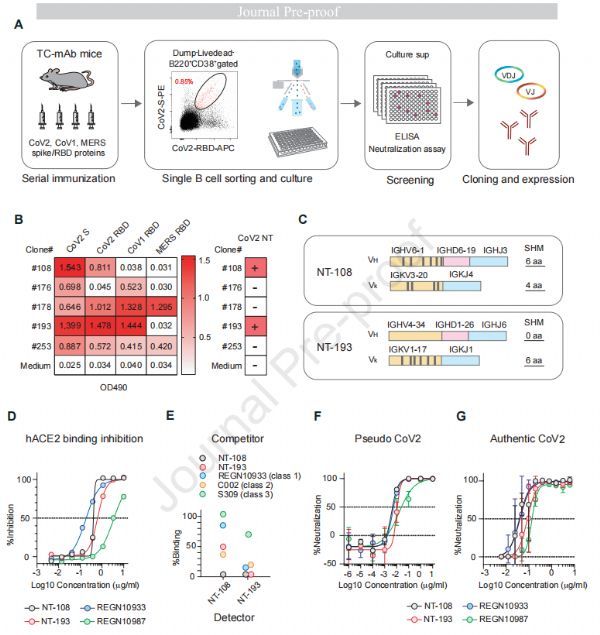
NT-108/NT-193抗体可有效中和SARS-CoV-2 图片来源:https://doi.org/10.1016/j.immuni.2021.08.025
该研究使用了TC-mAb小鼠,它在小鼠Ig敲除背景中稳定地保持了一个工程染色体,其中包含整个人Ig重链和kappa链的基因座,将来自CoV2、CoV1和中东呼吸综合征(MERS)-CoV的刺突/受体结合域(RBD)抗原进行连续免疫后,对与CoV2 RBD结合的B细胞进行单细胞培养。在高亲和力CoV2 RBD结合剂中,通过基于水泡性口炎病毒(VSV)的假病毒测定鉴定了两个有效的中和抗体克隆,其中一个克隆(#108)对CoV2 RBD具有特异性,但另一个克隆(#193)与CoV2/CoV1 RBD交叉反应,这两个克隆都是人IgG1亚类(#108和#193克隆分别表示为NT-108和NT-193)。
RBS表位可细分为1类和2类或RBS-A、-B和-C;此外,RBD中有非RBS表位,分为3类和4类或S309-蛋白聚糖和CR3022-隐蔽位点。中和抗体通常由会聚的VH基因编码,例如IGHV3-53、IGHV3-66、IGHV3-30、IGHV1-2和IGHV1-69,而NT-108和NT-193分别使用非典型的IGHV6-1和IGHV4-34基因,且均抑制RBD与人ACE2的结合,表明它们的表位与RBS重叠。该研究进行了竞争性ELISA试验,其中RBD 1-3类表位被每一类的代表性抗体掩盖,1类抗体(REGN10933)的额外竞争表明NT-193识别包含1类和2类的表位;此外,NT-108和NT-193相互竞争可能会识别部分重叠的表位,并且这两种抗体都是CoV2假型病毒和真实病毒的高效中和剂,其半最大抑制浓度(IC50)与再生元制药(REGN)抗体(IC50 < 100 ng/mL)一样有效。



NT-193通过IgG3亚类增强CoV2和CoV1中和活性 图片来源:https://doi.org/10.1016/j.immuni.2021.08.025
该研究通过表面等离子体共振 (SPR)分析比较了IgG1、IgG3和Fab背景下NT-108和NT-193的RBD结合亲和力,不考虑IgG 亚类,NT-193以高亲和力(表观亲和力约为10-10~-11 M)与CoV2和CoV1 RBD结合,然而,NT-193 Fab的RBD结合亲和力下降到低于NT-193 IgG抗体的1/100倍。SPR分析下的极高亲和力结合可能低估了IgG1和IgG3亚类之间的亲和力差异,此外,为了模拟CoV2病毒粒子上RBS表位的低密度,ELISA板以非饱和浓度包被,然后将IgG1和IgG3亚类的NT-193添加到板中以评估它们的结合亲和力。IgG3依赖性增强与针对CoV2假型和真病毒的中和活性适度但显著增加相关,使用D614G变体进一步评估了IgG3依赖性增强,该变体被认为通过减少S1的脱落而比武汉菌株更丰富地表达S三聚体,该变体还以升高的频率表达具有单开放构象的RBD,但这种变体的使用夸大了IgG3依赖性增强,表明这种现象取决于S三聚体的密度和/或开放构象的频率,REGN10933的增强也很明显,其表位被封闭的RBD构象掩盖。
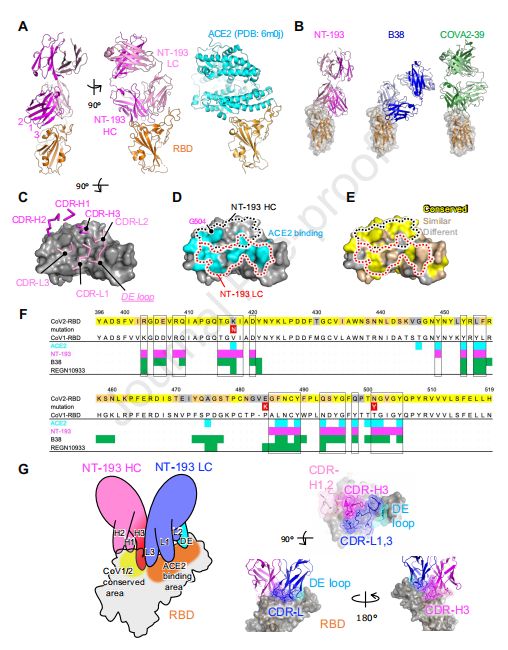


NT-193 Fab-RBD复合物的结构揭示了不同的结合模式 图片来源:https://doi.org/10.1016/j.immuni.2021.08.025
为了获得有关NT-193 219强效交叉中和活性和IgG3亚类增强的结构信息,该研究进行了X 射线晶体学分析,成功获得RBD蛋白与NT-193 Fab复合物的晶体,复合物的分辨率为2.8 Å。NT-193识别RBD的顶部区域,该区域与ACE2的结合位点广泛重叠,但与S3099(3类)和 CR3022(4类)抗体的结合位点不重叠;1类/RBS-A和2类/RBS-B抗体也识别RBD的顶部区域,然而,NT-193的识别模式明显不同于基准抗体B38(1类)和COVA2-39(2类)。NT-193抗体不仅利用轻链的互补决定区(CDR)-1和CDR-3(称为CDR-L),而且利用框架区DE环来识别ACE2 结合点,体细胞超突变置换轻链中的6个氨基酸,其中丝氨酸(Ser)到甘氨酸(Gly)突变的第31和66位位于与RBD的界面,这些Ser到Gly的取代不太可能导致任何空间位阻或不合适的静电互补,表明体细胞超突变对NT-193结合的贡献很小(如果有的话)。另一方面,重链突出的DR-3(以下称为CDR-Hs),以及重链中仅有的一小部分CDR-H1和CDR-H2,负责与CoV1/CoV2的结合ACE2结合位点旁边的保守区域。这些结构特征导致了一种非典型的结合模式,允许广泛覆盖ACE2结合位点,并通过亲合力效应以最小的足迹实现有效的交叉反应。
该研究的局限性在于,IgG1和IgG3亚类之间NT-193对原始CoV2毒株的治疗活性没有明显差异,未来需要通过使用CoV1或WIV-1病毒进行攻击来进一步研究这一点,因为使用这些病毒可以观察到更强大的中和增强。 此外,评估VOC挑战模型下的治疗活动也很重要,除了体外中和活性外,NT-193的体内最佳治疗保护还可以通过IgG Fc效应子功能进行调节,但这一点仍有待验证。(生物谷 bioon)
参考文献
Taishi Onodera et al. A SARS-CoV-2 Antibody Broadly Neutralizes SARS-related Coronaviruses and Variants by Coordinated Recognition of a Virus Vulnerable Site. IMMUNITY(2021 Aug 23) doi:https://doi.org/10.1016/j.immuni.2021.08.025
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。