科学家们如何利用3D打印技术打印出具有成熟形态的机体组织器官?
来源:本站原创 2019-08-19 13:15
2019年8月19日 讯 /生物谷BIOON/ --3D打印技术的快速发展使得直接利用细胞和聚合物材料的活性油墨打印器官样、细胞致密组织的前景更加广阔,当活性油墨被置于生理条件下时,细胞就会在聚合物基质上施加机械力并动态改变墨水的形状和机械性质,为了帮助3D打印在组织工程中的发展,研究人员就需要对活性墨水的特性进行定量分析理解,以便其一旦被放入培养基中就能够有效预测并控制形状的演变。图片来源:Mo
2019年8月19日 讯 /生物谷BIOON/ --3D打印技术的快速发展使得直接利用细胞和聚合物材料的活性油墨打印器官样、细胞致密组织的前景更加广阔,当活性油墨被置于生理条件下时,细胞就会在聚合物基质上施加机械力并动态改变墨水的形状和机械性质,为了帮助3D打印在组织工程中的发展,研究人员就需要对活性墨水的特性进行定量分析理解,以便其一旦被放入培养基中就能够有效预测并控制形状的演变。
图片来源:Morley et al
日前,发表在国际杂志Nature Communications上的研究报告中,研究者Morley等人就提供了关于活性墨水和其机械性能迄今为止最完整的定量化描述,相关研究或为后期4D生物打印奠定了一定基础,在4D打印过程中,生物材料会进行一系列形态发生步骤来引导,比如改变印刷物体的生物学过程,而这些步骤都会汇聚于功能和结构先进的最终形式。
最广泛使用的3D打印机是一种基于挤压的设备,其中墨水被推动通过喷嘴以形成具有特定直径和几何形状的细丝;如今组织工程师已经能够将成为浆液的微粒转变成为柔软的材料,比如3D打印细胞混合物和细胞外基质组分(ECM);浆液能够抑制在重力作用下产生的结构单元的坍塌,在研究中,研究者Morley能利用一种自由形式的打印技术将活性墨水的细丝转化称为由聚合物微粒所形成的浆液,随后其就会在介质中转变为液体。
这些活性墨水由活的成纤维细胞(动物机体中最常见的细胞)和普遍存在的ECM蛋白—胶原蛋白-1组成,胶原蛋白能够提供成纤维细胞附着并引发收缩反应的基质材料,这些打印出的长丝结构具有一系列几何形状以及与成纤维细胞和胶原蛋白并不相同的组分,文章中,研究人员利用这些丝状结构作为最简单构建打印组织基本元件的模型,这类似于支撑框架中的单个梁。
研究者Morley等人测定了打印后细丝的几何形状如何随时间而变化,因为细胞对胶原蛋白-1施加了牵引力并重塑了基质的结构,通过系统性地改变长丝的厚度和长度,以及其胶原蛋白-1和细胞成分,研究人员就能够全面理解生物材料中细丝的机械性能,尽管该研究仅限于简单的细丝几何形状,但从原则上来讲,其所得到的数据适用于机械模型,而该模型则能描述组织的变形及具有更复杂的细丝几何形状和模式的组织。
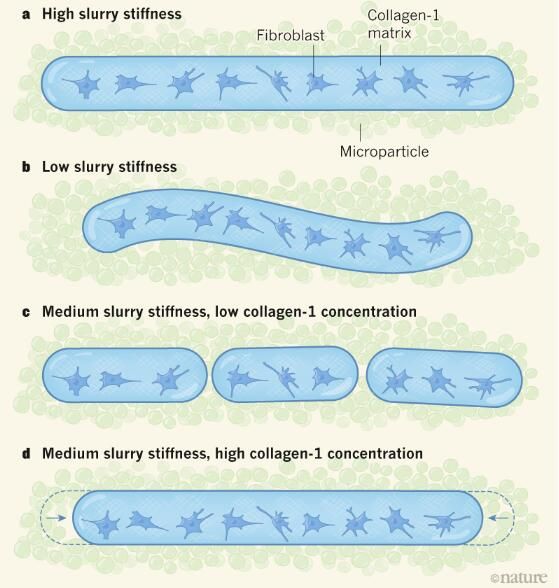
在一系列关键实验中,研究者在细胞牵引下观察到了四种类型的细丝行为,其能够通过利用细丝的材料特性和微粒浆液的硬度来进行定量解释(如图),在具有低刚性的微粒浆液中,细丝会弯曲成波状形状从而减轻细胞施加的内应力;然而,如果浆液变得更硬的话就能够防止弯曲,在中等浆液的硬度下,长丝要么会破裂成为较小的部分,要么会发生缩短,这取决于长丝中胶原蛋白-1的浓度,为此研究人员提出了一种理论框架,其能够帮助预测3D打印机的克隆参数如何决定后期行为的发生。
图片来源:pubs.rsc.org
研究者认为,他们所提出的理论框架能为4D生物打印提供定量的工程指南,比如,其能够对细胞和ECM组分的打印排列进行成像,这些组分能够自发地改变形状从而产生阻止和器官的合成形式,比如肾脏、肺脏和血管等,其要比现实更加真实。
然而在这一愿景成为现实之前,研究人员或许还面临着很多挑战,利用4D生物打印对功能性阻止进行工程化改造需要将大量活细胞和ECM组分整合到打印机所挤出的材料中,所有这些都将通过生物化学和机械方式彼此相互作用,那么多个偶联的细丝如何在相互连接的框架中表现?其又是如何相互推拉的?而且细胞动力学本身如何随着结构曲线的变化而变化?目前研究人员并不清楚如何使用形态发生过程将更为复杂的物体工程化改造来得到一个稳定的结果,或者是否这些过程并没有研究人员所分析的细胞行为那样强大,比如细胞增殖、分化和运动等。
最后,应该指出的是,所有基于挤压的打印技术都存在空间分辨率的问题,有趣的是,研究者Morley等人的观察结果提出了组织工程可能会采用的解决方法,他们发现,这些细丝能够在某个参数范围内发生收缩;因此,由于细胞牵引对整个打印对象的压缩作用,打印组织结构的有效空间分辨率可能要比打印机喷嘴的直径要好得多;未来4D生物打印技术的挑战也给众多工程师们提供了前所未有的机会,他们能将工程学与机体组织发育过程结合,设计出更多设计主题可控的打印产品。(生物谷Bioon.com)
原始出处:
【1】Hughes AJ, Miyazaki H, Coyle MC, et al. Engineered Tissue Folding by Mechanical Compaction of the Mesenchyme. Dev Cell. 2018 Jan 22;44(2):165-178.e6. doi: 10.1016/j.devcel.2017.12.004
【3】Morley CD, Ellison ST, Bhattacharjee T, et al. Quantitative characterization of 3D bioprinted structural elements under cell generated forces. Nat Commun. 2019 Jul 10;10(1):3029. doi: 10.1038/s41467-019-10919-1.
【4】Murphy SV, Atala A. 3D bioprinting of tissues and organs. Nat Biotechnol. 2014 Aug;32(8):773-85. doi: 10.1038/nbt.2958.
【5】Kolesky DB, Homan KA, Skylar-Scott MA, et al. Three-dimensional bioprinting of thick vascularized tissues. Proc Natl Acad Sci U S A. 2016 Mar 22;113(12):3179-84. doi: 10.1073/pnas.1521342113. Epub 2016 Mar 7.
【6】Bhattacharjee T, Zehnder SM, Rowe KG, et al. Writing in the granular gel medium. Sci Adv. 2015 Sep 25;1(8):e1500655. doi: 10.1126/sciadv.1500655. eCollection 2015 Sep.
【7】Hinton TJ, Jallerat Q, Palchesko RN, et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Sci Adv. 2015 Oct 23;1(9):e1500758. doi: 10.1126/sciadv.1500758. eCollection 2015 Oct.
【8】Gladman AS, Matsumoto EA, Nuzzo RG, et al. Biomimetic 4D printing. Nat Mater. 2016 Apr;15(4):413-8. doi: 10.1038/nmat4544. Epub 2016 Jan 25.
【9】Bade ND, Xu T, Kamien RD, et al. Gaussian Curvature Directs Stress Fiber Orientation and Cell Migration. Biophys J. 2018 Mar 27;114(6):1467-1476. doi: 10.1016/j.bpj.2018.01.039.
【10】Grimes A, Breslauer DN, Long M, et al. Shrinky-Dink microfluidics: rapid generation of deep and rounded patterns. Lab Chip. 2008 Jan;8(1):170-2. Epub 2007 Nov 20.
【11】Zev Gartner & Alex Hughes. Getting the measure of living biomaterials, Nature 572, 38-39 (2019) doi: 10.1038/d41586-019-02263-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


