中美免疫细胞治疗产品上市之路与几点思考
来源:美柏医健 2021-11-01 21:55
近年来,以 CAR-T 为代表的免疫细胞治疗在肿瘤治疗等领域取得的进展和突破备受瞩目。
近年来,以 CAR-T 为代表的免疫细胞治疗在肿瘤治疗等领域取得的进展和突破备受瞩目。免疫细胞治疗类产品获得的突破性进展和国内外CAR-T细胞治疗产品的批准上市,为晚期肿瘤患者的治疗带来新的希望治疗方案。
01 免疫细胞治疗产品的研发与申报概况
截至目前,全球共已有6款CAR-T细胞治疗免疫细胞治疗产品获批上市,均为CAR-T细胞产品,其中5款在美国上市、2款在国内上市。在CAR-T领域,美国拥有最多专利并处于领先地位,但中国正在迎头赶上,越来越多的中国公司参与到CAR-T领域中来,目前在中国开展的CAR-T细胞产品临床试验数量已是全球第一。
根据全球著名医疗行业咨询公司IQVIA联合非营利组织癌症研究所发布的《The clinical pipeline for cancer cell therapies》,截止到2021年4月16日,全球CAR-T细胞产品新增的临床管线达到299条,较2020年增长35%,而在开发的靶点中,研究最多并有显著成果的血液瘤靶点是CD19,其次是BCMA。不少公司也在布局针对实体瘤的细胞治疗产品,研究靶点最多的是Mesothelin。截至止2021年9月,CDE网站显示免疫细胞治疗产品的申报企业达39家,申报数量达86次;除已上市的两款产品,还有多个品种处在pre-NDA阶段。而据Cortellis数据库,美国已有30多个产品处在关键临床阶段,3个产品(含sBLA)处于上市申请状态。CAR-T细胞产品疗法已然成为免疫细胞疗法中的主流疗法。
02 中美上市申请法规比较
美国NDA/BLA审评审批流程:
美国NDA/BLA申请一般由药理、化学、医学、统计等不同专业人员成立审评小组。第一步,由审评小组进行完整性审查(completeness review),如果资料不全,有可能则会被拒绝送审受理。如果资料完整,将被受理并启动正式审评。首先,审评小组的每位审评人员先对自己所负责的部分进行全面的技术审评,每一个学科还会涉及上一级的审评。FDA检查官还会对临床试验机构和生产场地进行PAI检查。最后,由项目经理把各个审评人员的审评意见、现场检查报告等整合到一个“action package”中,由审评小组给出建议,FDA高层最终做出最终的批准与否的决定。通常,NDA包括评估药品安全性与有效性的所需的所有数据。有时也会例外的情况,比如有些问题需要进一步的考虑或者存在争议,。在这种情形下,FDA会组织顾问咨询会,以获得独立的专业建议并允许公众提建议。顾问委员会的结论不具有法律效力,但是一般FDA会接受顾问委员会的建议。因此顾问委员会的会议不能等闲视之,申请人需要做好充分准备。
美国NDA/BLA审评时限:
根据美国《处方药使用者法案》(PDUFA),为加快药品审查目的,建立两种审查模式级审查时间,即标准审评和优先审评。FDA会对每一份申报是否符合优先审评的要求进行评估,并在收到最初的BLA/NDA 60天内,告知申请人优先审评认定情况。优先审评一般在6个月内完成,标准审评在10个月内完成。FDA审评过程中会动态地问询交流和要求提供补充资料,审评时限不会延长。但若在审评过程中提交重大补充资料,审评时限将延长3个月。
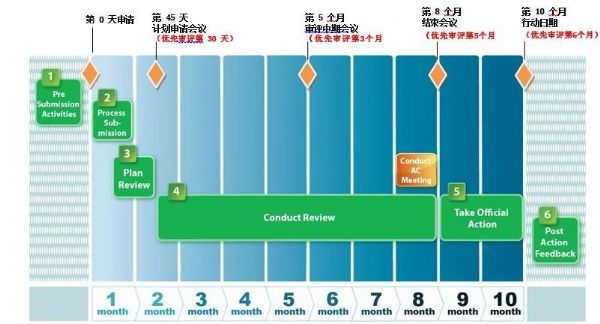
图注: FDA标准审评和优先审评时间表(图源:FDA CDER 21st Century Review Process)
中国的NDA审评审批流程:
与美国相似,中国NDA递交后,需要进行形式审查,如符合要求的,5个工作日予以受理。CDE将组织药学、药理毒理、临床和统计等技术人员进行技术审评,审评过程中,基于风险启动药学注册检查、注册检验。CDE将根据药品注册申报资料技术审评结果、核查结果、检验结果等,对药品的安全性、有效性和质量可控性进行综合审评,向国家药品监督管理局(NMPA)呈送综合审评报告,并提出批准或不批准的建议,由NMPA最终决定是否批准。
中国NDA审评时限:
2020年7月1日生效的新版《药品注册管理办法》规定了标准审评和优先审评,其中标准审评的时限为200个工作日,优先审评时限为130个工作日。以上时间不包括申请人补充资料、核查后整改以及按要求核对生产工艺、质量标准和说明书等所占用的时间;审评过程中若有发补,审评时间需要相应延长(标准审评延长三分之一,优先审评延长四分之一)。
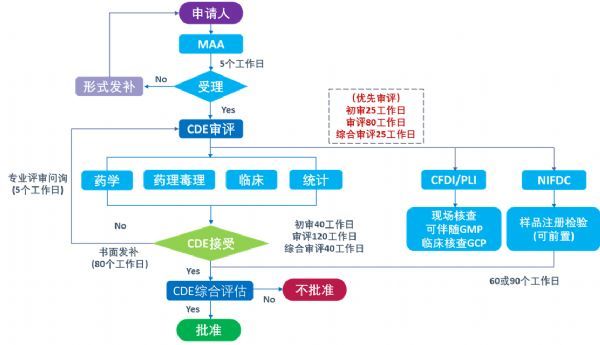
图注:中国药品注册审评流程图
03 中美CAR-T细胞治疗产品批准信息汇总
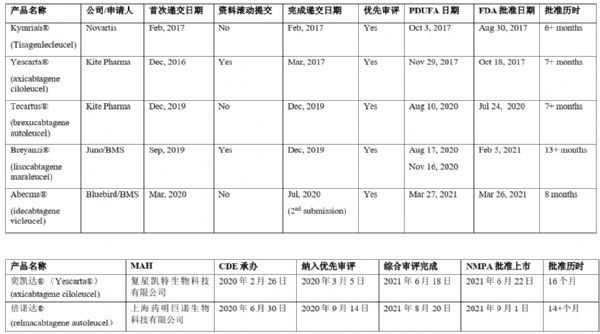
04 对中美免疫细胞治疗产品上市申报的分析与思考
随着药品注册管理办法(2020年第27号令)的发布实施,我国深化药品审评审批改革的成果得以巩固,上市审评时限(标准审评和优先审评)已与FDA的审评时限基本一致,这为中美上市审批时限趋同奠定了法规基础,使得中美同时申报同时审批成为可能。
依照上述表中的信息,当前美国上市批准的5款免疫细胞治疗产品均获得了优先审评。2017年至2020年3款CAR-T细胞治疗产品(Kymriah®、Yescarta®、Tecartus®)从申报完成到批准上市时长均小于8个月,且均在PDUFA 日期前约1个月获批上市,由此可见FDA对于具有突破性疗效的CAR-T细胞治疗产品的重视与支持。Breyanzi®的上市审评超出13个月,主要原因有:因重大CMC补充资料PDUFA 日期延期3个月;受新冠疫情影响FDA现场核查延期在PDUFA 日期后2个多月才批准。 Abecma®的首次上市申报则是因CMC资料的不充分,而未通过FDA完整性审查,用时2个月完善后重新申报,FDA在PDUFA 日期前一天批准上市。Breyanzi® 和Abecma®上市申报和审批时限均因为CMC显著延长。
2021年NMPA批准两款细胞治疗产品奕凯达®和倍诺达®上市,两款产品且均给予了优先审评,审评审批时限分别为16个月和14个月,延长的主要原因为审评过程中补充资料提交和审评及应对注册监管要求。
如何缩短中美免疫细胞治疗产品申报上市的,如何缩短申报和审批时限?对此,笔者有分享以下几点思考:
·免疫细胞治疗产品临床开发周期短,需要有很好的CMC规划,进行充分的CMC研究,避免审评过程中因重大的补充资料而延长PDUFA日期(FDA);或提交补充资料(CDE),而增加补充申请资料审评时间(CDE)。
·免疫细胞治疗产品不同于传统药物,CMC研究需要更多的数据支持可比性评价,甚至需要临床研究数据支持。
·新冠疫情常态化环境下,做好准备以及时灵活应对不同形式的核查形式(现场检查或远程检查)。
药物上市的根本目的是解决患者的需求,药物研发应以患者需求为核心,以临床价值为导向已经成为普遍共识。当前我国细胞治疗产品的药物研发处于快速发展阶段,患者对于药物的安全性、治疗体验和生存质量都有了更高的期望。期待未来有更多产品获批上市,让全球更多患者因此受益。(生物谷 bioon)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


