CAR-T细胞疗法研究进展(第40期)
来源:生物谷原创 2023-11-30 07:03
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Cancer Discov:新研究表明破坏SUV39H1 基因有望改善CAR-T细胞疗法的抗癌效果
doi:10.1158/2159-8290.CD-22-1319
在一项新的研究中,MSK医学博士Michel Sadelain实验室发现破坏 CAR-T 细胞中的单个基因可以使它们变得更强大,能够更持久地对抗肿瘤。相关研究结果近期发表在Cancer Discovery期刊上,论文标题为“Disruption of SUV39H1-mediated H3K9 methylation sustains CAR T cell function”。

在这篇论文中,这些作者证实破坏 SUV39H1 基因会产生连锁反应:它会恢复多个有助于维持 T 细胞寿命的基因的表达。他们指出这种方法提高了CAR-T细胞对抗小鼠多种癌症的疗效。论文共同第一作者、Sadelain实验室成员Nayan Jain博士说,“如果我们能通过破坏一个基因来帮助CAR-T细胞维持其功能,这将带来广泛的治疗益处。”
Jain博士说,“这种新方法需要更少的CAR-T细胞,因此可能能够扩大有资格接受这种治疗的患者范围。它还能提高CAR-T细胞疗法对每名患者的疗效。”
论文共同第一作者、Sadelain实验室的Zeguo Zhao博士说,“这种新方法可以延长CAR-T细胞的寿命,并同时维持其杀伤肿瘤的功能,因此我们可以使用较低的剂量来治疗患者,这可能会减少一种叫做细胞因子释放综合征(cytokine release syndrome, CRS)的严重副作用。”
2.Nature:震惊!CAR-T细胞疗法可能导致HHV-6病毒重新激活
doi:10.1038/s41586-023-06704-2
在一项新的研究中,来自美国斯坦福大学的研究人员收集了之前有关CAR-T细胞疗法研究的数据,探究了嵌合抗原受体(CAR)T 细胞(CAR-T)在接受CAR-T细胞疗法的患者体内重新激活人类疱疹病毒6型(human herpesvirus 6, HHV-6)的情况。该研究试图描述HHV-6重新激活现象的特征,尤其是在CAR-T细胞治疗B细胞淋巴瘤或白血病的情况下。他们发现CAR-T细胞疗法有可能导致患者体内的CAR-T细胞重新激活HHV-6。相关研究结果发表在2023年11月16日的Nature期刊上,论文标题为“Latent human herpesvirus 6 is reactivated in CAR T cells”。
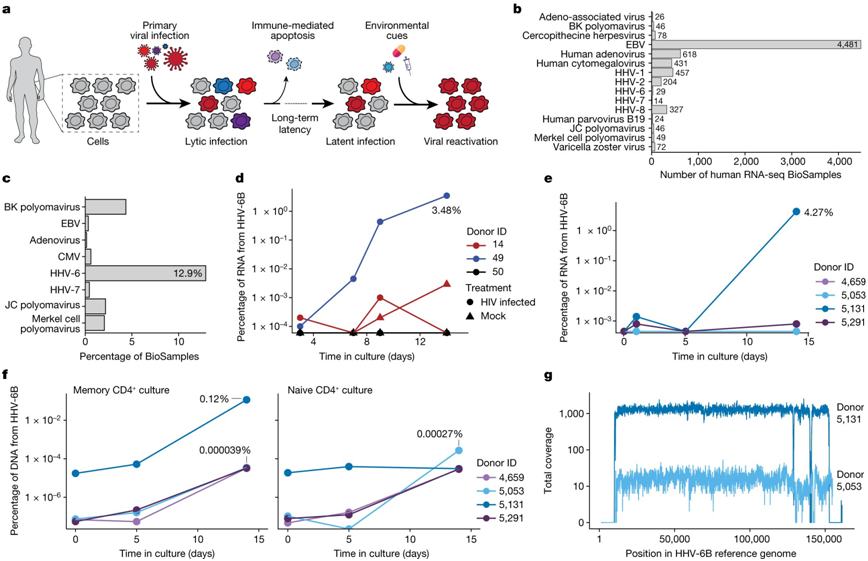
图片来自Nature, 2023, doi:10.1038/s41586-023-06704-2。
这些作者对接受自体 CAR-T 细胞产品治疗的三组患者的 scRNA-seq 数据集进行了重新分析。虽然在输注前CAR-T 细胞产品中未检测到 HHV-6 病毒转录本,但在输注后样本中观察到 HHV-6+细胞显著增加。
这些作者发现,输注后样本中 28 个CAR-T 细胞表达 HHV-6B 转录本,其中 13 个CAR-T 细胞类似于研究级异体 CAR-T 细胞中罕见的HHV-6“超级表达(super-expressor)”细胞。对两名HHV-6超级表达的患者的详细时间过程分析显示,在治疗一周后出现了HHV-6+细胞,与免疫效应相关神经毒性综合征的临床症状相吻合。精神错乱和神经认知能力下降等症状与血液中存在的HHV-6病毒相吻合,但并非对所有患者都是因果关系。
这些发现表明,T细胞活化、增殖和培养持续时间与HHV-6重新激活之间存在联系,强调了在开发和监测CAR-T细胞疗法时需要进一步考虑的问题。
3.Nat Immunol:利用改良的CAR-T细胞提高癌症免疫疗法的疗效
doi:10.1038/s41590-023-01658-z
在一项新的研究中,来自德国弗莱堡大学的研究人员如今能够在临床前动物模型中阻止CAR-T 细胞进入衰竭状态,从而显著提高治疗效果。相关研究结果于2023年11月6日在线发表在Nature Immunology期刊上,论文标题为“Harnessing CD3 diversity to optimize CAR T cells”。
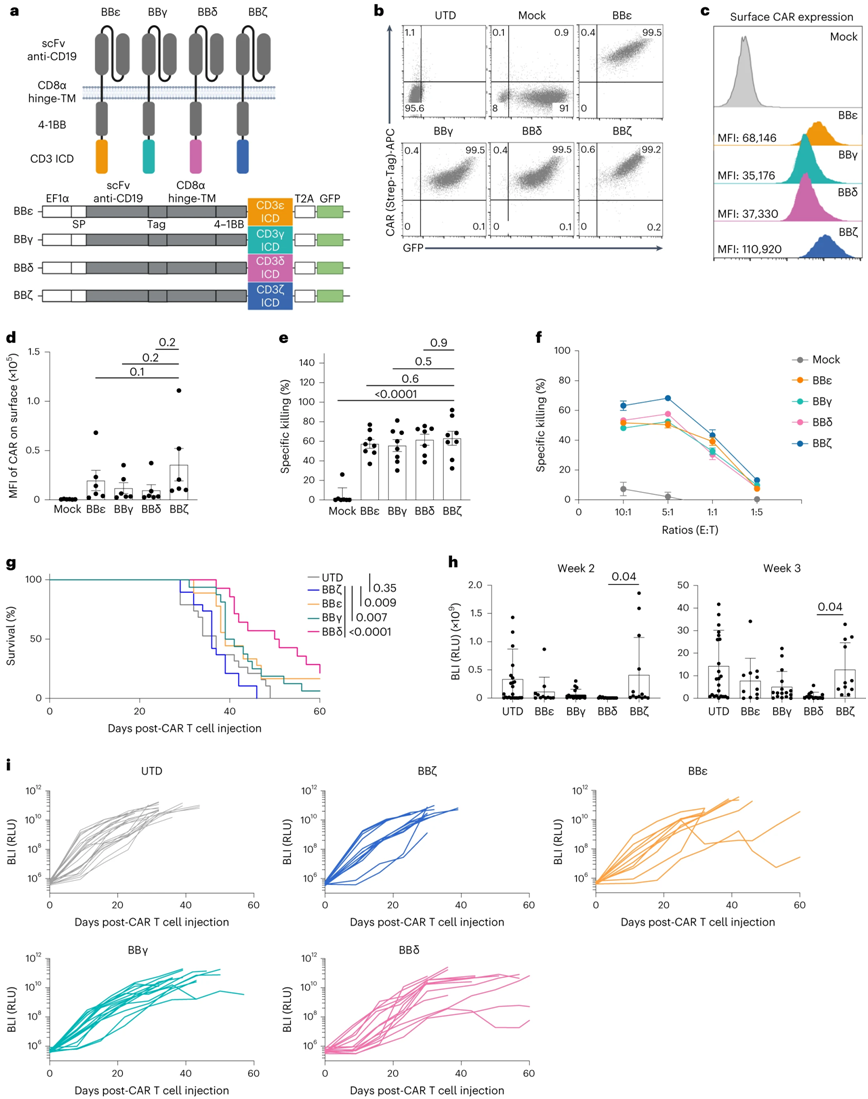
含有CD3δ/ε/γ细胞质胞内结构域的CAR优于含有ζ链的CAR。图片来自Nature Immunology, 2023, doi:10.1038/s41590-023-01658-z。
CAR 的功能就像一种传感蛋白,T 细胞通过它来识别癌细胞表面的特征。人工合成的 CAR 包含天然 T 细胞受体(TCR)的部分成分,但其结构相比之下已大大简化。CAR 只有TCR的四个不同的传递可触发未经修饰的 T 细胞激活免疫反应的信号的亚基中的一个。
论文通讯作者、弗莱堡大学的Susana Minguet博士解释说,“药物监管机构批准上市的 CAR 都使用所谓的ζ链,一旦 CAR 与癌细胞表面结合,它就会触发 T 细胞特别强烈的激活。T 细胞受体的其他三条信号传导链---γ、δ和ε---是否也能用于 CAR 还没有得到研究。”
在这项新的研究中,这些作者制造了四种类型的CAR-T细胞,每种CAR-T细胞都表达一种携带这四个信号传导亚基中一个的CAR,并在白血病小鼠模型中进行了测试。Schamel 解释说,“令人吃惊的是,临床应用的CAR-T细胞所使用的ζ链的抗肿瘤效果低于其他三个结构域:γ、δ和ε链。这些结构域对白血病模型中癌细胞的消除效果明显更好。”
4.Nat Commun:揭示线粒体功能障碍导致T细胞衰竭,有望改善CAR-T细胞疗法
doi:10.1038/s41467-023-42634-3
在免疫系统抗击癌症和感染的过程中,经常会导出现 T 细胞衰竭现象:在这一过程中,T 细胞会逐渐丧失功能,从而破坏它们对癌症和感染的反应。控制这种功能丧失的分子机制尚未完全解开。
在一项新的研究中,德国维尔茨堡大学免疫学家Martin Vaeth及其研究团队找到了这一现象的可能解释:T 细胞衰竭过程在很大程度上受到“细胞能量工厂”线粒体的影响。相关研究结果于2023年10月27日发表在Nature Communications期刊上,论文标题为“Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming”。

T细胞衰竭以代谢重编程为特征。图片来自Nature Communications, 2023, doi:10.1038/s41467-023-42634-3。
当线粒体呼吸失效时,一连串的反应就会被触发,最终导致 T 细胞的遗传和代谢重编程,这一过程驱动了 T 细胞功能衰竭。但是,T 细胞的这种“衰竭”是可以抵消的---通过药物或遗传优化细胞代谢可以延长 T 细胞的寿命,增强其功能。例如,可以通过过量表达一种线粒体磷酸盐转运蛋白来实现这一目的,这种磷酸盐转运蛋白能促进供能分子三磷酸腺苷(ATP)的产生。
Vaeth说,“人们通常认为,线粒体(能量)代谢的改变是T细胞衰竭的结果。”为了证实线粒体功能障碍是 T 细胞衰竭的真正原因,他的团队开发了一种新的遗传模型。它关闭了磷酸盐转运蛋白Slc25A3,瘫痪了T细胞中的线粒体呼吸。
因此,这些T细胞被迫转而使用其他代谢途径,主要是有氧糖酵解,以三磷酸腺苷的形式满足其生物能需求。然而,这种代谢适应会导致 T 细胞中活性氧的产生增加。氧自由基水平的升高会阻止转录因子HIF-1α的降解。HIF-1α蛋白的积累会导致T细胞的遗传和代谢重编程,从而加速T细胞衰竭。
Vaeth解释说,“对T细胞衰竭的这种HIF-1α依赖性控制以前并不为人所知。它代表了线粒体呼吸和T细胞功能之间的一个关键调节通路,是T细胞衰竭过程中的一个‘代谢检查点’。”
5.Biotechnol Progr:开发出新型生物反应器,可以快速生产治疗癌症所需的CAR-T细胞
doi:10.1002/btpr.3388
免疫疗法是一种很有前途的疗法,它利用人体免疫反应的力量来靶向癌细胞。一种快速培养杀死癌症的免疫细胞的新工具可能会促进免疫疗法的可用性。
在一项新的研究中,来自美国华盛顿州立大学的研究人员开发出了一种迷你冰箱大小的生物反应器,它能以最大生长速度的95%制造称为T细胞的免疫细胞---比现有技术快30%左右。他们利用来自牛的T细胞研制出了这一技术,并预计它将在人类细胞上发挥类似的作用。相关研究结果近期发表在Biotechnology Progress期刊上,论文标题为“Development of a centrifugal bioreactor for rapid expansion of CD8 cytotoxic T cells for use in cancer immunotherapy”。

论文第一作者、华盛顿州立大学博士后研究员Kitana Kaiphanliam说,“这种日益增长的免疫疗法的制造需求无法得到满足,因此在生物制造解决方案方面存在着需要填补的空白。归根结底,它们需要升级,这样才能被更多人使用。”
这种生物反应器利用离心力作用于生长中的T细胞,同时将这些T细胞悬浮在密集的云层中,并不断地沐浴在向内流动的含有营养物的介质中。该原型是由华盛顿州立大学化学工程教授Bernie Van Wie领导的四十年离心生物反应器设计研究的成果。
这种最新的原型也是在一个无菌的柜子里。Kaiphanliam说,“它就像一个生物安全柜。它可以在没有洁净生产设施或不容易获得洁净生产设施的情况下使用,因此可以使这些基于细胞的疗法平民化。”
6.Nature:发现牛肉和奶制品中的反式异油酸可提高CD8+ T细胞浸润肿瘤和杀死癌细胞的能力
doi:10.1038/s41586-023-06749-3
在一项新的研究中,来自美国芝加哥大学、圣犹大儿童研究医院和埃默里大学的研究人员发现,牛羊等放牧动物的肉类和乳制品中含有的一种长链脂肪酸---反式异油酸(trans-vaccenic acid, TVA)---能提高CD8+ T细胞浸润肿瘤和杀死癌细胞的能力。他们还指出血液中TVA循环水平较高的患者对免疫疗法的反应较好,这表明TVA有可能作为一种营养补充剂来辅助癌症的临床治疗。相关研究结果于2023年11月22日在线发表在Nature期刊上,论文标题为“Trans-vaccenic acid reprograms CD8+ T cells and anti-tumour immunity”。
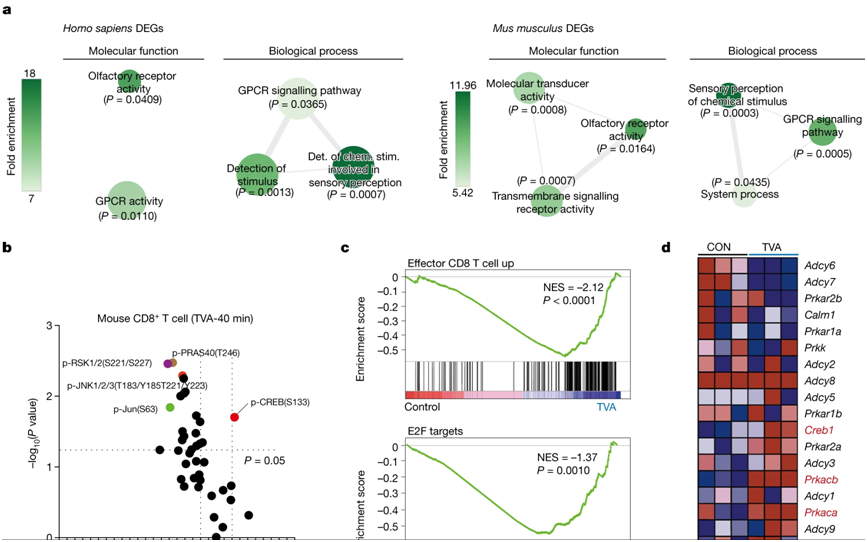
图片来自Nature, 2023, doi:10.1038/s41586-023-06749-3。
论文共同通讯作者、芝加哥大学医学教授Jing Chen博士说,“有许多研究试图破解饮食与人类健康之间的联系,但由于人们吃的食物种类繁多,要了解其中的内在机制非常困难。但如果我们只关注食物中的营养物和代谢物,我们就能开始了解它们是如何影响生理和病理的。通过着重关注能激活T细胞反应的营养物,我们发现了一种实际上能通过激活一条重要的免疫途径来增强抗肿瘤免疫反应的营养物。”
Chen实验室专注于了解血液中循环的代谢物、营养物和其他分子如何影响癌症的发展和对癌症治疗的反应。在这项新的研究中,两位博士后---Hao Fan博士和Siyuan Xia博士---从一个包含约700种来自食物的已知代谢物的数据库入手,建立了一个由235种来自营养物的生物活性分子组成的 “血液营养物”化合物文库。他们对这个新的化合物文库中的化合物进行了筛选,以确定它们是否能通过激活CD8+ T细胞影响抗肿瘤免疫反应,其中CD8+ T细胞是一类对杀死癌细胞或被病毒感染的细胞至关重要的免疫细胞。
他们在人类和小鼠细胞中对前六种候选化合物进行评估后发现,TVA 的表现最佳。TVA 是母乳中含量最高的反式脂肪酸,但人体无法自行产生。只有大约 20% 的 TVA 被分解成其他的副产物,剩下 80% 在血液中循环。Chen说,“这意味着它肯定还有其他作用,因此我们开始对它进行更多研究。”
这些作者随后用不同肿瘤类型的细胞和小鼠模型进行了一系列实验。与喂食对照饮食的小鼠相比,喂食富含TVA的饮食能显著降低黑色素瘤和结肠癌细胞的肿瘤生长潜力。富含TVA的 饮食还能增强 CD8+ T 细胞浸润肿瘤的能力。
由Chen实验室和He实验室共同完成的这些附加测定显示,TVA 会使细胞表面上的一种名为 GPR43 的受体失活,而这种受体通常会被肠道微生物群经常产生的短链脂肪酸激活。TVA 会压制这些短链脂肪酸,并激活一种称为 CREB途径的细胞信号传导过程,该途径参与细胞生长、存活和分化等多种功能。他们还发现,CD8+ T 细胞中的 GPR43 受体被完全清除的小鼠模型也无法提高抗肿瘤能力。
最后,他们还与芝加哥大学医学教授Justin Kline博士合作,分析了接受 CAR-T 细胞免疫疗法治疗的淋巴瘤患者的血液样本。他们观察到,TVA水平较高的患者往往比TVA水平较低的患者对治疗的反应更好。他们还与医学教授Wendy Stock博士合作,对白血病细胞系进行了测试,结果发现 TVA 增强了免疫治疗药物杀死白血病细胞的能力。
7.Nature:首次构建出肿瘤中T细胞表达的转录因子图谱,有望开发出更好的癌症免疫疗法
doi:10.1038/s41586-023-06733-x
T 细胞是免疫系统中参与杀死癌症的关键成分。肿瘤产生的信号会关闭这些T细胞,部分上是通过迫使它们逐渐分化(成熟)为一种功能低下的状态,即衰竭。
在一项新的研究中,来自美国圣犹达儿童研究医院的研究人员全面研究了癌症中 T 细胞分化状态所涉及的转录因子。然后,他们利用这些信息在临床前模型中通过促进或阻止 T 细胞分化来增强抗癌活性。这些研究结果对癌症免疫疗法具有重要意义。相关研究结果于2023年11月15日在线发表在Nature期刊上,论文标题为“Single-cell CRISPR screens in vivo map T cell fate regulomes in cancer”。

图片来自Nature, 2023, doi:10.1038/s41586-023-06733-x。
过继细胞疗法(adoptive cell therapy, ACT)中使用的T细胞用于靶向杀死癌细胞。作为ACT之一的嵌合抗原受体(CAR)T(CAR-T)细胞疗法对血癌有临床疗效,但对实体瘤的疗效不佳。这种疗效上的差异部分是由于肿瘤促进了T细胞衰竭,从而使得T细胞主动杀灭癌细胞的效率降低。这些作者发现,他们可以精确地打断T细胞分化过程,从而提高抗肿瘤疗效。
论文通讯作者、圣犹达儿童研究医院免疫学系博士Hongbo Chi说,“T 细胞是肿瘤免疫疗法的基石,我们找到了一种对 T 细胞进行重编程的新方法,使它们更加有效。我们可以将它们推向一种特化状态,使它们成为功能更强的肿瘤杀伤细胞。”
8.Nat Commun:开发出强效的γδT细胞,有望实现通用的癌症免疫疗法
doi:10.1038/s41467-023-42619-2
“现成的(off-the-shelf)”细胞疗法,也称为异体细胞疗法(allogenic cell therapy),使用的免疫细胞来自健康的捐献者,而不是患者。这种方法可以更及时地为更多患者提供诸如嵌合抗原受体(CAR)T细胞疗法之类的细胞疗法,而这正是为患者提供这些救命疗法的主要障碍之一。
在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员开发出一种新方法,可以设计出更强大的免疫细胞,这些细胞有可能用于“现成的”细胞疗法,以治疗具有挑战性的癌症。这种新方法是朝着开发更有效的细胞疗法迈出的关键一步,这种细胞疗法成本更低,等待时间更短,可以大规模生产并运送到世界各地的医院,从而使CAR-T细胞疗法更便宜,并为更广泛的患者所接受。相关研究结果于2023年11月8日发表在Nature Communications期刊上,论文标题为“Unlocking the potential of allogeneic Vδ2 T cells for ovarian cancer therapy through CD16 biomarker selection and CAR/IL-15 engineering”。
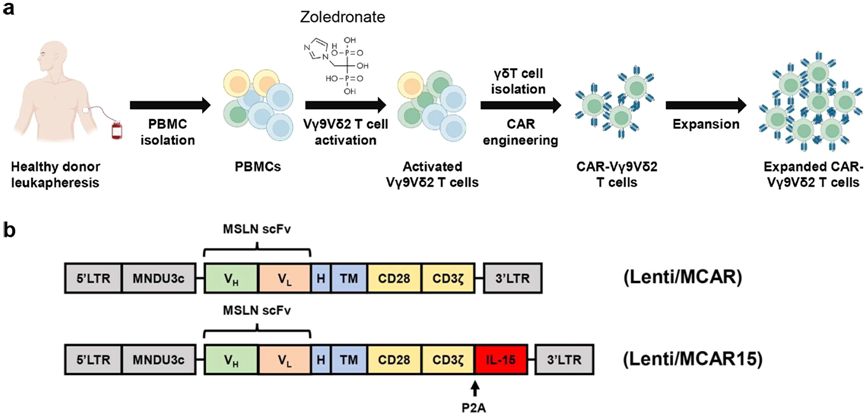
高表达CD16的Vδ2 T细胞经过基因改造表达CAR/IL-15后,同时保持扩增能力和记忆状态。图片来自Nature Communications, 2023, doi:10.1038/s41467-023-42619-2。
论文通讯作者、加州大学洛杉矶分校微生物学、免疫学与分子遗传学副教授Lili Yang说,“在治疗晚期癌症患者时,时间往往是至关重要的。目前,这类疗法需要根据患者的具体情况量身定制。我们必须从患者体内提取称为T细胞的免疫细胞,对这些细胞进行基因改造,然后再将它们重新灌注回患者体内。这个过程可能需要几周到几个月的时间,治疗每名患者可能需要花费数十万美元。”
在这项新的研究中,Yang和她的团队重点研究了γδT细胞(gamma delta T cell),这类免疫细胞因能靶向包括实体瘤在内的多种癌症而闻名,但不会引起移植物抗宿主病,而移植物抗宿主病是异体细胞疗法中常见的并发症。
尽管之前研究过基于γδT细胞的疗法,但由于供体的可变性、短暂的持续性以及癌细胞逃避或躲避人体免疫反应的能力,这些疗法的临床成功率有限。
然而,Yang和她的团队发现,高表达CD16表面标志物的供体γδT细胞杀死癌细胞的能力更强。Yang说,“这些CD16高表达的γδT细胞表现出独特的特征,提高了它们识别肿瘤的能力。它们显示出更高水平的效应分子,并具备对癌细胞产生抗体依赖性细胞毒性的能力。我们发现,通过使用CD16作为供体选择的生物标志物,可以提高它们的抗癌特性。”
9.Cell:新研究表明CAAR-T细胞疗法有望治疗自身免疫性脑炎
doi:10.1016/j.cell.2023.10.001
在一项新的研究中,来自德国神经退行性疾病研究中心和柏林夏里特医学院的研究人员开创了一种治疗称为NMDA受体脑炎(NMDA receptor encephalitis)的最常见自身免疫性脑炎的新型疗法。通过对称为T细胞的白细胞进行重编程,使之靶向消除致病细胞,这种方法的精确度和效率都达到了新的水平。它已在实验室研究中获得成功,目前正在计划进行人体临床试验。相关研究结果于2023年11月1日在线发表在Cell期刊上,论文标题为“Chimeric autoantibody receptor T cells deplete NMDA receptor-specific B cells”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.001。
NMDA受体脑炎是抗体引起的脑部疾病中最常见的一种。在这种疾病中,抗NMDA受体抗体会突然攻击大脑,从而转而攻击患者自己的身体。论文共同通讯作者Harald Prüss教授说,“在临床前实验中,我们成功地选择性关闭了形成这些错误靶向抗体(抗NMDA受体抗体)的B细胞。”
这些作者设计了专门的嵌合自身抗体受体(chimeric autoantibody receptor, CAAR)T细胞(CAAR-T),用于注射到患者体内。这些经过编程的CAAR-T细胞能高精度地识别并清除产生抗NMDA受体抗体的B细胞。在小鼠模型中,这种创新方法展示了它的准确性。
这些 CAAR-T 细胞一旦重新进入身体体内,就会专门攻击那些产生抗NMDA受体抗体的B细胞。这些B细胞的表面形状使得CAAR-T 细胞能够精确地与之对接并杀死它们。重要的是,产生其他抗体并因此具有不同表面形状的B细胞不会受到影响。(生物谷 Bioon.com)
相关生物谷新闻:
CAR-T细胞疗法研究进展(第39期)
https://news.bioon.com/article/e22ee980694d.html
CAR-T细胞疗法研究进展(第38期)
https://news.bioon.com/article/9888e93783f1.html
CAR-T细胞疗法研究进展(第37期)
https://news.bioon.com/article/caf3e83979c2.html
CAR-T细胞疗法研究进展(第36期)
https://news.bioon.com/article/b9b6e6929370.html
CAR-T细胞疗法研究进展(第35期)
https://news.bioon.com/article/4b40e613612e.html
CAR-T细胞疗法研究进展(第34期)
https://news.bioon.com/article/4198e575451e.html
CAR-T细胞疗法研究进展(第33期)
https://news.bioon.com/article/c0b4e49733ba.html
CAR-T细胞疗法研究进展(第32期)
https://news.bioon.com/article/1cc9e41516ed.html
CAR-T细胞疗法研究进展(第31期)
https://news.bioon.com/article/18a5e37253a6.html
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


