铁蛋白载药机制研究获进展
来源:生物物理所 2020-11-02 21:40
近日,中国科学院院士、中科院生物物理研究所/中科院纳米酶工程实验室研究员阎锡蕴团队在Nano Today上,在线发表关于铁蛋白药物载体(Ferritin Drug Carrier)药物装载方法的最新研究成果,该研究揭示铁蛋白药物载体表面存在药物通道,为铁蛋白药物临床转化奠定了理论基础。铁蛋白是天然存在于人体细胞中的储铁蛋白,在人体内的铁平衡和细胞抗氧化中具有
近日,中国科学院院士、中科院生物物理研究所/中科院纳米酶工程实验室研究员阎锡蕴团队在Nano Today上,在线发表关于铁蛋白药物载体(Ferritin Drug Carrier)药物装载方法的最新研究成果,该研究揭示铁蛋白药物载体表面存在药物通道,为铁蛋白药物临床转化奠定了理论基础。
铁蛋白是天然存在于人体细胞中的储铁蛋白,在人体内的铁平衡和细胞抗氧化中具有关键作用。铁蛋白具有独特的壳核结构,外壳直径12nm,由24 个蛋白亚基自组装形成;内腔直径8nm,可以装载治疗药物。在前期工作中,研究发现人重链铁蛋白识别肿瘤标志分子转铁蛋白受体(TfR1)(Nature Nanotechnology, 2012),进而赋予铁蛋白新型药物载体功能(PNAS, 2014),并提出铁蛋白药物载体(Ferritin drug carrier, FDC)新概念(Journal of Controlled Release, 2019)。FDC类似于抗体偶联药物(ADC),通过其对受体的特异识别功能将负载的小分子药物靶向运输到肿瘤组织;与ADC相比,具有药物装载能力、热稳定性和易生产性等属性上的优势。然而,有关FDC的载药机理尚不明确。
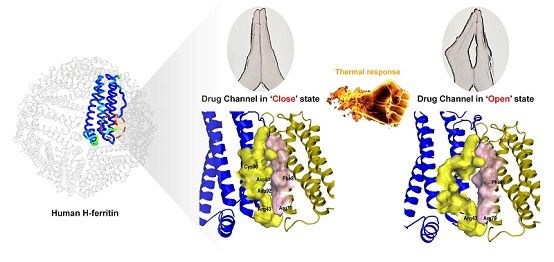
阎锡蕴团队通过铁蛋白晶体结构分析,开展突变体设计与载药的相关性研究,发现药物进入铁蛋白内腔是通过特定的通道。该通道由第89-92位及其附近的氨基酸残基组成的,位于铁蛋白表面二重对称轴处的柔性区域。该药物装载通道的“开关”受温度调控(如图)。环境温度的提升有助于89-92位氨基酸残基摆动到远离二重轴的位置,通道“打开”,药物从此处进入铁蛋白内腔。研究基于这一发现,通过温度调节将阿霉素药物装载到铁蛋白内腔。动物实验结果表明该铁蛋白药物的稳定性高、安全性好、抗肿瘤效果优异。该药物通道对于小分子药物具有普适性,利用该通道也可以装载顺铂、奥沙利铂、表阿霉素等其他小分子药物,具有发展成为新药技术平台的潜质。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


