Nat Commun:特殊的细胞表面粘附蛋白或能帮助肿瘤细胞形成具有转移特性的细胞簇
来源:本站原创 2021-09-29 11:04
来自美国西北大学Feinberg医学院等机构的科学家们通过研究发现,具有干细胞特性的循环肿瘤细胞或能利用粘附蛋白ICAM1来促进循环肿瘤簇的形成,从而从机体原发性肿瘤位点转移到其它器官中。
2021年9月29日 讯 /生物谷BIOON/ --循环肿瘤细胞(CTCs)簇能以更高的效率来介导癌症转移,相比单一细胞而言,其与乳腺癌患者的总体生存率较低直接相关,近日,一篇发表在国际杂志Nature Communications上题为“ICAM1 initiates CTC cluster formation and trans-endothelial migration in lung metastasis of breast cancer”的研究报告中,来自美国西北大学Feinberg医学院等机构的科学家们通过研究发现,具有干细胞特性的循环肿瘤细胞或能利用粘附蛋白ICAM1来促进循环肿瘤簇的形成,从而从机体原发性肿瘤位点转移到其它器官中。
图片来源:https://www.nature.com/articles/s41467-021-25189-z
这些循环肿瘤细胞簇是乳腺癌转移的主要来源,因此抑制肿瘤细胞中的ICAM1或有望阻断肿瘤细胞“播种”并能阻断癌症进展。研究者Huiping Liu博士表示,一种能中和粘附蛋白ICAM1的抗体或能在肿瘤细胞循环和迁移期间减少其社交网络,并能改善乳腺癌患者的治疗预后。与单一循环肿瘤细胞的癌症相比,携带循环肿瘤细胞簇的癌症或与乳腺癌患者的存活率下降直接相关,而且其发生转移的效率能高出20-100倍,即乳腺外部的额外肿瘤;研究者表示,90%的乳腺癌死亡病例都会发生乳腺癌的转移。
研究者表示,当疾病开始扩散到远端器官时,其几乎总是无法彻底治愈的;这些转移的癌细胞种子都是多细胞的循环肿瘤细胞簇,数量为2-3个细胞的集群往往会在转移到机体其它器官时在数量上汲取能量(不断增加数量)。当前研究中,研究者Liu等人利用患者机体衍生的癌细胞来研究循环肿瘤细胞簇的形成,结果发现,循环肿瘤细胞粗需要蛋白ICAM1不仅仅用于最初肿瘤细胞簇的形成,而且还能沿着血管移动并穿过血管壁。
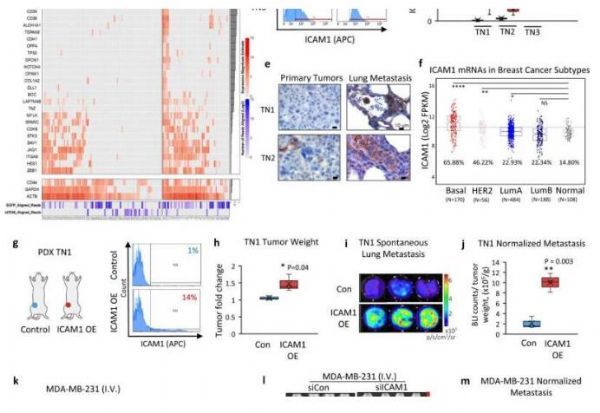
循环肿瘤细胞簇会在细胞表面展现ICAM1来彼此识别并“牵手”,同时还能帮助其穿透血管外的内皮层。此外,聚集在一起的癌细胞就好像干细胞一样,其能更加有效地产生后代最终形成肿瘤;从循环肿瘤细胞中剔除ICAM1后就能降低癌细胞的迁移,并抑制远端肿瘤的形成,同时还能干预其进出血管的能力。
单细胞RNA测序谱分析比较原发性和转移性肿瘤部位的乳腺癌细胞特性。
图片来源:Taftaf, R., et al. Nat Commun 12, 4867 (2021). doi:10.1038/s41467-021-25189-z
未来,一种能结合ICAM1并降低其功能的抗体或能用于治疗携带高水平ICAM1或循环肿瘤细胞簇的乳腺癌患者,从而就能减缓患者机体中癌症的转移并延长其生存期。研究者Liu说道,利用ICAM1作为一种生物标志物,我认为这些患者或许能作为抗体疗法的优秀靶标,而且这在免疫力低下的患者中或许特别有价值。
综上,本文研究结果表明,阻断ICAM1的相互作用或能明显抑制循环肿瘤细胞簇的形成、肿瘤细胞的跨内皮迁移和肺部的转移,因此,ICAM1或能作为一种新型的治疗性靶点来帮助开发抑制三阴性乳腺癌患者机体癌症转移启动的新型疗法。(生物谷Bioon.com)
原始出处:
Taftaf, R., Liu, X., Singh, S. et al. ICAM1 initiates CTC cluster formation and trans-endothelial migration in lung metastasis of breast cancer. Nat Commun 12, 4867 (2021). doi:10.1038/s41467-021-25189-z
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。