CANCER DISCOV:PD-L1(Atezolizumab)联合VEGF (Bevacizumab)阻滞治疗晚期恶性腹膜间皮瘤的疗效、安全性分析
来源:本站原创 2021-12-08 13:31
近段时间,Kanwal Raghav教授及其团队针对恶性腹膜间皮瘤(MPeM)展开了相关研究,以评估PD-L1 (atezolizumab)和VEGF (bevacizumab)联合阻断(AtezoBev)的疗效和安全性。
2021年12月8号 讯/生物谷BIOON 恶性腹膜间皮瘤(MPeM)是一种罕见但具有侵袭性的恶性肿瘤,治疗方法有限。MPeM起源于腹膜浆膜层的间皮细胞,通常表现为腹部不适、腹胀和腹水。Atezolizumab是一种针对PD-L1的人源化单克隆抗体(mAb),阻断其与PD-1和B7-1 (CD80)受体的相互作用,逆转T细胞抑制。贝伐单抗是一种抗VEGFA的单抗,可以抑制血管生成和肿瘤生长。Atezolizumab联合bevacizumab (AtezoBev)已在晚期肝癌中显示出强大的活性,并已被FDA批准用于该适应症。

近段时间,Kanwal Raghav教授及其团队针对恶性腹膜间皮瘤(MPeM)展开了相关研究,以评估PD-L1 (atezolizumab)和VEGF (bevacizumab)联合阻断(AtezoBev)的疗效和安全性。

该研究纳入20例进展或既往铂培美曲塞化疗无耐受的晚期和不可切除的MPeM患者, Atezolizumab固定剂量为1200 mg,联合贝伐珠单抗,每21天静脉注射15mg/kg剂量,直到患者疾病进展或出现无法接受的毒性作用,不允许修改剂量。如果患者有相关的AEs,允许贝伐单抗中断剂量,并允许患者继续单独使用Atezolizumab。初始进展的患者如果临床表现良好,并根据定义的标准评估假性进展,可以继续治疗。本研究的目的是确定AtezoBev对既往铂培美曲塞全身治疗失败的晚期MPeM患者的临床疗效和安全性,主要终点为ORR,次要终点为安全性、疾病控制率(DCR:达到确诊应答或确诊病情稳定的患者百分比)、DoR(定义为首次确诊至进展日期之间的时间间隔)、PFS和OS。
在数据截止时,中位随访时间为23.5个月(范围为10.1-36.1)。患者平均接受15个(范围,4-38)周期,6名(30%)患者在数据截止时继续治疗。停药的原因有:疾病进展[10(50%)],毒性[2(10%)],死亡[1(5%)],同意停药[1(5%)]。在20例可评估患者中,根据实体肿瘤1.1版疗效评价标准(RECISTv1.1)确定的客观缓解率(ORR)的主要终点为40% (95% CI, 19.1-64.0;8/20的病人)。在数据截止时,这8例患者中有6例(75%)持续有应答。应答者的中位反应持续时间(DoR)为12.8个月。共有10例(50%)进展事件和7例(35%)死亡。大多数患者在腹腔内进展,2例(20%)患者在腹腔外进展。中位无进展生存期(PFS)估计为17.6个月[95% CI, 9.1 -未达到(NR)],1年PFS为61% (95% CI, 35-80)。
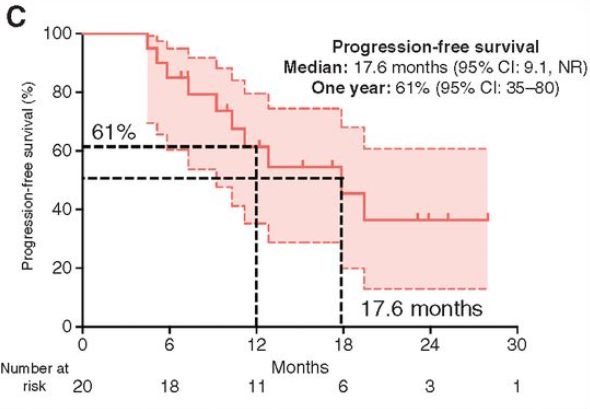
KapIan Meier曲线
总之,AtezoBev耐受性良好,对已经进展或先前对铂培美曲塞化疗不耐受的MPeM患者产生了强大而持久的反应,显著延长了生存期。这项研究为患有这种病态癌症的患者提供了一种有希望的治疗选择。

近段时间,Kanwal Raghav教授及其团队针对恶性腹膜间皮瘤(MPeM)展开了相关研究,以评估PD-L1 (atezolizumab)和VEGF (bevacizumab)联合阻断(AtezoBev)的疗效和安全性。

该研究纳入20例进展或既往铂培美曲塞化疗无耐受的晚期和不可切除的MPeM患者, Atezolizumab固定剂量为1200 mg,联合贝伐珠单抗,每21天静脉注射15mg/kg剂量,直到患者疾病进展或出现无法接受的毒性作用,不允许修改剂量。如果患者有相关的AEs,允许贝伐单抗中断剂量,并允许患者继续单独使用Atezolizumab。初始进展的患者如果临床表现良好,并根据定义的标准评估假性进展,可以继续治疗。本研究的目的是确定AtezoBev对既往铂培美曲塞全身治疗失败的晚期MPeM患者的临床疗效和安全性,主要终点为ORR,次要终点为安全性、疾病控制率(DCR:达到确诊应答或确诊病情稳定的患者百分比)、DoR(定义为首次确诊至进展日期之间的时间间隔)、PFS和OS。
在数据截止时,中位随访时间为23.5个月(范围为10.1-36.1)。患者平均接受15个(范围,4-38)周期,6名(30%)患者在数据截止时继续治疗。停药的原因有:疾病进展[10(50%)],毒性[2(10%)],死亡[1(5%)],同意停药[1(5%)]。在20例可评估患者中,根据实体肿瘤1.1版疗效评价标准(RECISTv1.1)确定的客观缓解率(ORR)的主要终点为40% (95% CI, 19.1-64.0;8/20的病人)。在数据截止时,这8例患者中有6例(75%)持续有应答。应答者的中位反应持续时间(DoR)为12.8个月。共有10例(50%)进展事件和7例(35%)死亡。大多数患者在腹腔内进展,2例(20%)患者在腹腔外进展。中位无进展生存期(PFS)估计为17.6个月[95% CI, 9.1 -未达到(NR)],1年PFS为61% (95% CI, 35-80)。

KapIan Meier曲线
总之,AtezoBev耐受性良好,对已经进展或先前对铂培美曲塞化疗不耐受的MPeM患者产生了强大而持久的反应,显著延长了生存期。这项研究为患有这种病态癌症的患者提供了一种有希望的治疗选择。
原始出处:Raghav K, Liu S, et al.Efficacy, Safety, and Biomarker Analysis of Combined PD-L1 (Atezolizumab) and VEGF (Bevacizumab) Blockade in Advanced Malignant Peritoneal Mesothelioma. Cancer Discov. 2021 Nov;11(11):2738-2747. doi: 10.1158/2159-8290.CD-21-0331. Epub 2021 Jul 14. PMID: 34261675; PMCID: PMC8563380.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


