JECCR:复旦中山医院团队破解胃癌对nab-紫杉醇耐药之谜
来源:奇点糕 2022-02-24 07:57
胃癌是全球第二大常见的恶性肿瘤,也是癌症患者死亡的第三大主要原因。目前,手术仍是最有可能治愈该疾病的方法。但是,由于早期诊断技术的缺乏,大多数胃癌患者在确诊时就已错过最佳的手术切除时间,使得化疗成为现阶段胃癌患者的首选方案。作为化疗药物之一的传统型紫杉类药物难溶于水,助溶剂会增加其毒副反应和降低化疗疗效。白蛋白结合型紫杉醇
胃癌是全球第二大常见的恶性肿瘤,也是癌症患者死亡的第三大主要原因。目前,手术仍是最有可能治愈该疾病的方法。但是,由于早期诊断技术的缺乏,大多数胃癌患者在确诊时就已错过最佳的手术切除时间,使得化疗成为现阶段胃癌患者的首选方案。
作为化疗药物之一的传统型紫杉类药物难溶于水,助溶剂会增加其毒副反应和降低化疗疗效。白蛋白结合型紫杉醇(nab-紫杉醇)是利用纳米技术将白蛋白作为载体来运输紫杉醇的新型药物。这种新剂型既能够提高药物的溶解性,又可以降低溶剂对患者的危害性。目前,nab-紫杉醇已被引入胃癌相关的临床试验,但结果往往因为耐药问题而效果不理想[1]。现阶段,胃癌患者对nab-紫杉醇耐药的分子机制急需解决。
一般情况下,耐药主要分为原发性耐药和继发性耐药两种:原发性耐药指的是在化疗之前,肿瘤已具备的抗药能力;继发性耐药是指肿瘤在药物处理后才出现的抗药特征。已有越来越多的研究表明,肿瘤干细胞(CSCs)参与肿瘤异质性和原发性耐药,靶向CSCs相关标记物、信号通路或微环境,有利于削弱肿瘤细胞的化疗抵抗性。
近日,由复旦大学中山医院崔越宏和刘天舒领衔的研究团队在Journal of Experimental & Clinical Cancer Research期刊发表重要研究成果。他们发现ZFP64/GAL-1信号通路能够抑制nab-紫杉醇对胃癌患者的治疗作用,并且抑制该通路也能够减弱肿瘤免疫抑制微环境,同时促进nab-紫杉醇对胃癌的治疗效果。
为了解决胃癌患者抵抗nab-紫杉醇治疗的问题,研究人员既比较了肿瘤组织与癌旁组织的差异表达基因,也比较了响应和不响应nab-紫杉醇治疗患者的肿瘤组织,随后将这两组所得的差异基因取了交集,从而筛选到最显着改变的基因——ZFP64。
他们发现:ZFP64表达量越高,患者的预后越差。此外Cox回归分析也显示ZFP64是胃癌患者的独立预后因素。
为了进一步确定ZFP64促进胃癌患者抵抗nab-紫杉醇,研究人员首先基于临床数据发现ZFP64与肿瘤转移有关。其次,通过体外实验证明,敲低ZFP64确实能够抑制肿瘤细胞的迁移和侵袭,以及下调上皮间充质转化(EMT)相关标志物。
除此之外,RNA-seq的通路富集结果也发现ZFP64与凋亡途径、肿瘤干性存在一定联系,并经实验验证确实如此。
随后,体内实验也证明:ZFP64表达量越高,肿瘤对nab-紫杉醇的药物敏感度就越低。
在发现ZFP64基因确实影响nab-紫杉醇对胃癌患者的治疗后,接下来就要搞清楚为什么?!以及how?!
目前已有文章报道ZFP64可以作为转录因子[6],于是研究人员猜想:ZFP64在胃癌中是否也同样会扮演转录因子的角色呢?如果是,被ZFP64调控的靶基因是否与肿瘤耐药相关呢?
于是,他们通过ChIP-seq数据以及比较了与ZFP64过表达正相关的差异基因,找到了GAL-1。目前,已知GAL-1功能也确实与肿瘤干性和免疫调控有关[7,8]!经实验验证,敲低胃癌细胞的GAL-1后,的确能够促进nab-紫杉醇的药理杀伤作用,以及抑制由ZFP64过表达诱导的肿瘤干细胞特征。
这让研究人员十分激动,为了确认GAL-1与ZFP64之间存在联系,基于已有研究报道GAL-1能够激活MAPK以及PI3K-AKT信号通路,研究人员利用胃癌细胞系首先证明ZFP64能够激活GAL-1下游的信号分子,如ERK的磷酸化、AKT的磷酸化等,但与p65无关。
并且,通过双荧光素酶报告基因检测也证明,ZFP64能够结合并激活GAL-1启动子区域,从而促进其转录。
到这里,“ZFP64/GAL-1能够促进肿瘤细胞抵抗nab-紫杉醇”的猜测已被证明。
考虑到ZFP64和GAL-1也均参与免疫反应,研究人员又进一步猜测ZFP64/GAL-1是否还可以通过调控肿瘤免疫微环境来影响胃癌患者的预后。
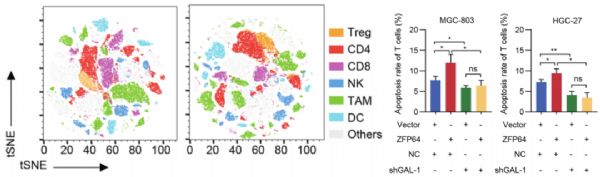
于是,研究人员收集了来自人源化NSG小鼠模型的肿瘤组织,并分析了其中CD45+肿瘤浸润白细胞的免疫细胞组成。他们发现:ZFP64表达量高的肿瘤组织中CD8+ T细胞显着少于ZFP64表达水平较低的肿瘤。并且,体外实验进一步证明:ZFP64高表达的肿瘤细胞,会诱导共培养的CD8+ T细胞发生凋亡,而GAL-1干扰则会抑制这一过程。
也就是说:ZFP64/GAL-1会促进肿瘤免疫抑制微环境的形成。
基础问题来源于临床,最后也要回归于临床。因此,在找到了胃癌患者对nab-紫杉醇耐药且预后差的问题后,是否可以通过联合治疗来促进nab-紫杉醇的治疗效果呢?
于是研究人员在体外分别尝试了多个抑制剂(MK2206—AKT抑制剂,U0126—ERK1/2 抑制剂,OTX008—GAL-1抑制剂)与nab-紫杉醇的联用,最后发现OTX008与nab-紫杉醇联用抗癌效果最显着!(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。