CAR-T细胞疗法研究进展(第45期)
来源:生物谷原创 2024-07-29 10:20
Sci Immunol:发现一种新的免疫检查点!临床前研究表明基因CD5敲除可极大提高CAR-T细胞对包括实体瘤在内的一系列癌症的疗效、Lancet:1期临床试验表明靶向CD22的CAR-T细胞有望改
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1. Sci Immunol:发现一种新的免疫检查点!临床前研究表明基因CD5敲除可极大提高CAR-T细胞对包括实体瘤在内的一系列癌症的疗效
doi:10.1126/sciimmunol.adn6509
在一项新的临床前研究中,来自宾夕法尼亚大学佩雷尔曼医学院和艾布拉姆森癌症中心的研究人员发现通过使用CRISPR-Cas9技术敲除在T细胞表面上发现的CD5蛋白的编码基因,可以大大提高CAR-T细胞疗法对包括实体瘤在内的多种癌症的疗效。相关研究结果发表在2024年7月的Science Immunology期刊上,论文标题为“CD5 deletion enhances the antitumor activity of adoptive T cell therapies”。

图片来自Science Immunology, 2024, doi:10.1126/sciimmunol.adn6509
CAR-T细胞是一种经过基因改造的T细胞,可以攻击癌细胞表面上的特定靶点。它们在一些血癌患者身上取得了显著效果。但是,它们对其他癌症的治疗效果并不理想,包括实体瘤癌症,如胰腺癌、前列腺癌和黑色素瘤。科学家们一直在寻找提高CAR-T细胞疗法有效性的技术。
这项新的研究表明敲除CD5可能是一种不错的技术。这些作者发现,CD5是一种强大的免疫检查点,能抑制T细胞的有效性。他们发现在多种临床前癌症模型中,去除CD5能显著增强CAR-T细胞的抗癌活性。
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院血液肿瘤学助理教授Marco Ruella医学博士说,“我们在临床前模型中发现,CD5 缺失大大增强了 CAR-T 细胞对抗多种癌症的功能。我们在临床前模型中观察到的惊人效果表明CD5基因敲除可能是增强CAR-T细胞功能的一种通用策略。”论文第一作者为Ruella实验室的应届研究生Ruchi Patel博士。
2. Lancet:1期临床试验表明靶向CD22的CAR-T细胞有望改善大 B 细胞淋巴瘤患者的预后
doi:10.1016/S0140-6736(24)00746-3
靶向癌细胞表面上的一种特定蛋白的CAR-T 细胞疗法可使约半数化疗疗效不佳的大 B 细胞淋巴瘤患者的肿瘤缩小或消失。但是,如果 CAR-T细胞治疗失败,或者癌症再次复发——大约有一半的患者会出现这种情况,那么预后就会很糟糕。复发后的中位生存时间约为六个月。
如今,在一项1期临床试验中,来自斯坦福大学医学院的研究人员发现,一种靶向癌细胞表面上一种不同蛋白的新型 CAR-T 细胞疗法能显著改善这些患者的预后。在参加这项临床试验的 38 人(其中的37 人在初始的 CAR-T细胞疗法治疗后复发)中,有一半以上的人的癌症出现了完全反应。在所有接受治疗的患者中,有一半以上在治疗后至少存活了两年。相关研究结果于2024年7月9日在线发表在Lancet期刊上,论文标题为“CD22-directed CAR T-cell therapy for large B-cell lymphomas progressing after CD19-directed CAR T-cell therapy: a dose-finding phase 1 study”。
斯坦福大学医学院医学助理教授Matthew Frank博士说,“平均而言,参加这项临床试验的患者已接受了四种先前的治疗。这些患者没有可能的治疗选择,他们很害怕。他们中有一半人会在五到六个月内死亡。但是在这项临床试验中,我们看到了非常高的持久完全缓解率,这意味着他们的癌症变得检测不到了。”
3. 细胞治疗新突破!Cell子刊:威斯康星大学科学家巧遇“代谢启动”法,CAR-T细胞疗效倍增!
doi:10.1016/j.omtm.2024.101249
在一项新的研究中,威斯康星大学麦迪逊分校威斯康星发现研究所的Dan Cappabianca和Krishanu Saha及其同事们在尝试改良T细胞疗法的过程中,意外地发现了一种提升疗法效率的方法。他们的研究聚焦于嵌合抗原受体T细胞(CAR-T细胞),这是一种被设计用来精准打击癌细胞的免疫细胞。
相关研究结果近期发表在Molecular Therapy—Methods & Clinical Development期刊上,论文标题为“Metabolic priming of GD2 TRAC-CAR T cells during manufacturing promotes memory phenotypes while enhancing persistence”。
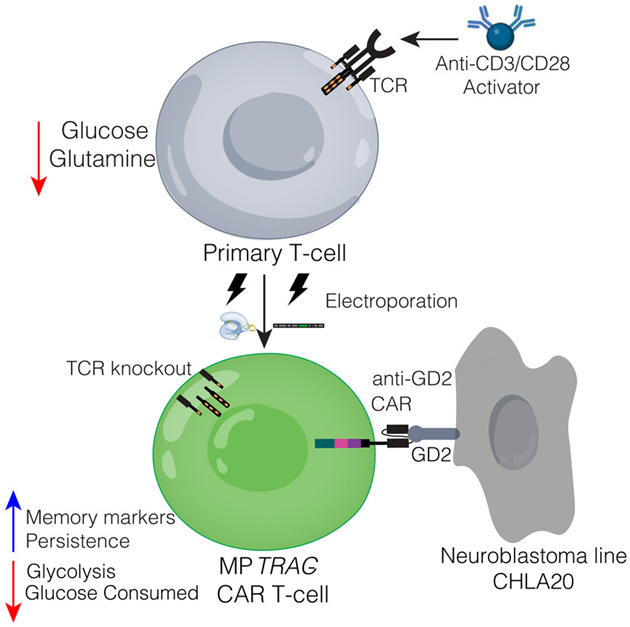
图片来自Molecular Therapy—Methods & Clinical Development, 2024, doi:10.1016/j.omtm.2024.101249
在实验室环境中,研究团队先是在低营养的培养基中激活T细胞,这种培养基中葡萄糖和谷氨酰胺的浓度较低,随后将它们转移到富含营养的培养基中。这个“代谢启动”的过程看似简单,却蕴含深意:初步的营养限制给T细胞带来压力,激发了它们的特殊机制,增强了其对肿瘤的针对性,促进了记忆T细胞的生成,同时也筛选出了在低能量环境下仍能生存的更为坚韧的细胞。
接下来的高营养阶段则加速了T细胞的生长和复制。经过这样处理的T细胞,保有了类似干细胞的特质,这意味着它们具备更强的抗癌能力,能更长久地存活于体内,并转变为持久的记忆细胞。
这种两步法还加强了T细胞的记忆能力,这对于CAR-T细胞疗法来说是一个重大利好,因为它意味着T细胞能够更高效地识别和对抗癌症,随着时间的推移效果更加显著。最近使用这种新方法培育的T细胞进行的临床研究显示,63%的患者肿瘤在一定时间内出现部分或全部缩小,相比之下,以往未采用此两步法的临床试验中,仅有15%的患者肿瘤有类似反应。
4. 扑克牌大小的奇迹!Nature子刊:扑克牌大小的微型生物反应器,能够高效批量生产临床级CAR-T细胞,为癌症免疫疗法注入强劲动力
doi:10.1038/s41551-024-01219-1
在一项新的研究中,来自新加坡-麻省理工学院研究与技术联盟、杜克-新加坡国立大学医学院、新加坡科技研究局、新加坡竹脚妇幼医院和新加坡中央医院的研究人员联合开发了一种革命性的微型生物反应器。这款超紧凑型自动化封闭系统,大小仅与一副扑克牌相当,却能在其中高效生产临床所需的活性自体嵌合抗原受体(CAR)T细胞。
相关研究结果于2024年6月4日在线发表在Nature Biomedical Engineering期刊上,论文标题为“A high-density microfluidic bioreactor for the automated manufacturing of CAR T cells”。
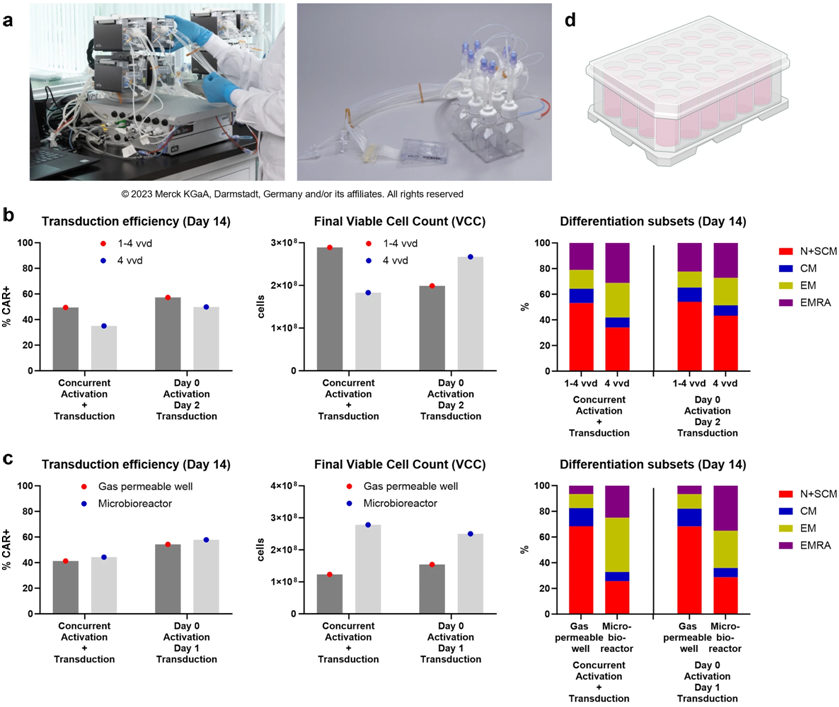
图片来自Nature Biomedical Engineering, 2024, doi:10.1038/s41551-024-01219-1
此次研究中,科研人员展示了一种突破性技术——在仅两毫升的微流控芯片中,能够激活、转导并高密度扩增人类原代T细胞,从淋巴瘤患者身上制备出超过6000万个CAR-T细胞,而健康供体的样本则能产出超过2亿个细胞。通过微型生物反应器生产的CAR-T细胞与传统方法生产的细胞在效能上无异,但所需的空间和资源显著减少,有望降低生产成本和治疗费用。
更令人兴奋的是,这种微型生物反应器能在短短7到8天内完成T细胞的扩增,相比传统的12天培养周期,生产时间缩短了30%到40%,且最终的细胞数量相当。细胞质量的检测显示,微型生物反应器与传统透气培养板生产的CAR-T细胞在品质上仅有细微差别,且在小鼠模型中展现出相同的抗白血病功能。
5. Science子刊:通过将CAR和TCR的优势相结合,Co-STAR T 细胞有望高效地治疗癌症
doi:10.1126/scitranslmed.adg7123
在一项新的研究中,来自约翰霍普金斯大学等研究机构的研究人员利用基因工程技术设计出了一种新型细胞:Co-STAR T 细胞,用于识别和抗击癌症。相关研究结果发表在2024年7月10日的Science Translational Medicine期刊上,论文标题为“Lisocabtagene maraleucel in follicular lymphoma: the phase 2 TRANSCEND FL study”。
为了制造这种名为 Co-STAR(Co-stimulatory Synthetic T-cell receptor and Antigen Receptor, 协同刺激合成 T 细胞受体和抗原受体)的细胞,这些作者将机体通常用来抵御入侵者的四种细胞的基因成分---来自T细胞的T细胞受体(TCR)、来自B细胞的抗体、来自称为单核细胞的白细胞的MyD88以及来自树突细胞和其他细胞的CD40---结合在一起,制造出了一种强大的新型细胞。
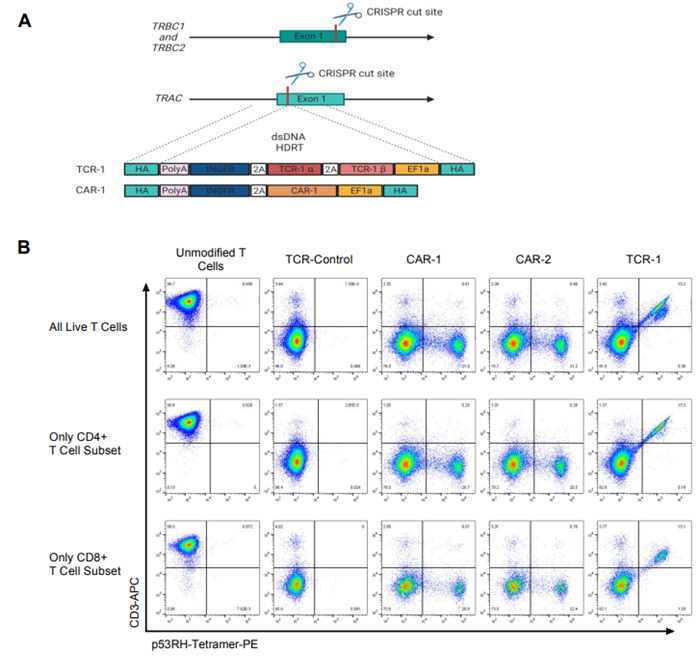
图片来自Science Translational Medicine, 2024, doi:10.1126/scitranslmed.adg7123
在这种Co-STAR 细胞中,TCR和抗体成分作为一种“入侵者检测装置”,能将癌细胞识别为外来细胞,而MyD88和C40成分能增强这种混合的检测装置触发的 “警报”。在实验室研究中,Co-STAR 细胞对在试管和小鼠体内生长的人类癌细胞产生了持续的抗肿瘤反应。
论文第一作者、布莱根妇女医院内科住院医师Brian Mog博士解释说,基于T细胞的疗法是治疗晚期癌症最有前景的方法之一,也是目前研究的热点。
6. Nat Med:临床研究表明CAR-T细胞疗法有望治疗侵袭性滤泡性淋巴瘤
doi:10.1038/s41591-024-02986-9
根据淋巴瘤研究基金会的数据,滤泡性淋巴瘤是一种通常生长缓慢的非霍奇金淋巴瘤,占所有非霍奇金淋巴瘤病例的20%至30%。虽然无法治愈,但许多滤泡性淋巴瘤患者都能活上几十年,这种疾病被广泛归类为慢性病。然而,对于一部分患者来说,滤泡性淋巴瘤可能特别具有侵袭性。侵袭性滤泡性淋巴瘤患者通常会接受多种治疗,但缓解期很短。
根据一项新的临床试验,CAR-T细胞疗法能有效治疗侵袭性的滤泡性淋巴瘤(follicular lymphoma)亚型。相关研究结果近期发表在Nature Medicine期刊上,论文标题为“Lisocabtagene maraleucel in follicular lymphoma: the phase 2 TRANSCEND FL study”。
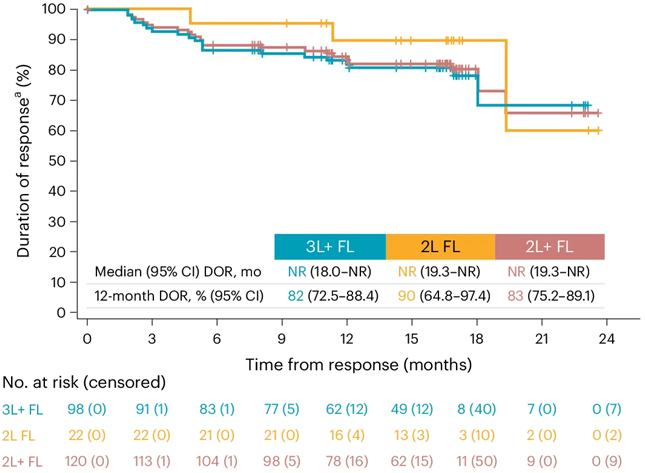
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-02986-9
在这项临床研究中,来自北美、欧洲和日本 31 个医疗中心的 130 名复发的滤泡性淋巴瘤患者在两年的时间里接受了一种 CAR-T 细胞疗法,即lisocabtagene maraleucel (liso-cel)。
这项临床研究显示,共有95名患者对这种治疗产生了反应,其中92人的癌症得到了缓解。治疗一年后,81%的研究参与者仍处于缓解期。大约一半的研究参与者出现了副作用,最常见的是治疗过程中的炎症反应。根据这项临床研究,15%的患者出现了神经系统副作用。Karmali说,这些研究结果表明,CAR-T细胞疗法对治疗侵袭性滤泡性淋巴瘤非常有效。
7. Lancet:德国科学家首次利用CAR-T细胞疗法成功治疗一名系统性红斑狼疮患儿
doi:10.1016/S0140-6736(24)00424-0
2023 年 6 月,Uresa A.(当时 15 岁)在埃尔朗根大学附属医院接受了 CAR-T细胞治疗。这种治疗是减缓系统性红斑狼疮(systemic lupus erythematosus, SLE)的最后手段。SLE是一种严重的自身免疫性疾病,正在攻击Uresa的身体,并突然严重影响了她正常生活的能力。如今,Uresa说,“这种治疗一年后,除了几次感冒,我感觉和确诊前一样好。”
这种治疗方法很不寻常,因为 CAR-T 细胞以前只用于治疗白血病或淋巴瘤,以及对患有某些晚期自身免疫性疾病的成人进行研究。CAR-T 细胞以前从未用于治疗患有自身免疫性疾病的儿童。
这名如今16岁的女孩是埃尔朗根大学附属医院德意志免疫治疗中心(DZI)在个体治疗尝试中接受免疫疗法的第一名SLE患儿。治疗这名女孩的相关研究人员近期在Lancet期刊上发表这一成功治疗的结果,相关论文标题为“CAR T-cell therapy rescues adolescent with rapidly progressive lupus nephritis from haemodialysis”。
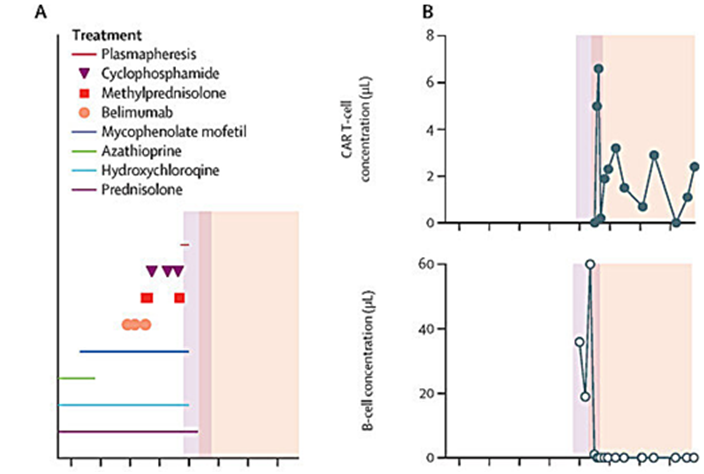
图片来自Lancet, 2024, doi:10.1016/S0140-6736(24)00424-0
埃尔朗根大学附属医院儿科和青少年医学系儿科风湿病专家 Tobias Krickau 博士解释说,“我们使用 CAR-T 细胞治疗自身免疫性疾病这一事实本身就很特别,因为这种疗法以前只被授权用于某些晚期癌症。尽管Uresa服用了各种药物,但她所患的SLE仍在以越来越快的速度恶化,因此我们面临着一个问题:是否应该把这些在实验室里经过基因改造的免疫细胞给孩子使用?据我们所知,这种针对儿童自身免疫性疾病的非标签疗法在世界上还从未尝试过。”
Krickau博士说,“从这种治疗后的第三周开始,她的肾脏和狼疮数值就得到了改善。我们以前使用任何药物都没有达到过这种效果”。她的所有症状都逐渐消失了。
2023 年 7 月底,Uresa终于可以回家了,并拿到了毕业证书。她的目标是完成汽车行业的学徒培训,早日搬出家门,并养一只狗。她非常高兴,因为她又可以和朋友们见面,外出游玩,过正常青少年的生活了。
Mackensen教授解释说,“她的血液中还有大量的 CAR-T 细胞。由于CAR-T细胞不仅清除了有害的B细胞,还清除了健康的B细胞,因此如今这些细胞已经缺失,这意味着Uresa的身体无法正常抵御某些感染。”因此,在Uresa自身的 B 细胞恢复之前,她每四周都要在埃尔朗根大学附属医院接受一次重要抗体的静脉注射。
8. Nature子刊:新研究表明生物可降解T细胞增强支架可改善CAR-T细胞的抗肿瘤活性
doi:10.1038/s41551-024-01216-4
如今,在一项新的研究中,来自哈佛大学维斯生物启发工程研究所和哈佛大学约翰-保尔森工程与应用科学学院的研究人员开发出一种生物可降解支架材料形式的简单干预措施,这种支架材料可以局部注射到皮下,用于在给送后重新刺激CAR-T细胞以提高其疗效。相关研究结果近期发表在Nature Biomedical Engineering期刊上,论文标题为“Subcutaneous biodegradable scaffolds for restimulating the antitumour activity of pre-administered CAR-T cells”。
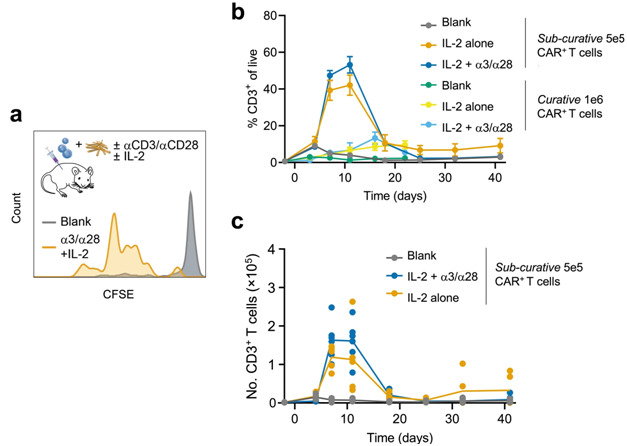
图片来自Nature Biomedical Engineering, 2024, doi:10.1038/s41551-024-01216-4
在患有侵袭性血液肿瘤的小鼠中,用非治愈剂量的CAR-T细胞治疗,这些作者开发的“T细胞增强支架(T-cell enhancing scaffold, TES)”显著抑制了肿瘤的生长,延长了这些小鼠的生存时间。CAR-T细胞治疗效果的提高是由于TES能够增加血液循环中CAR-T细胞的数量,并引导它们分化为杀伤肿瘤的T细胞亚型。
论文通讯作者、维斯生物启发工程研究所创始核心教员David Mooney博士说,“虽然我们的策略还需要根据人类的需求和环境进行转化,但它有可能为进一步改善反应不佳的患者的 CAR-T 细胞疗法提供一个安全、简单的途径。通过将CAR-T细胞制造过程的一部分转移到患者体内,它将来还有可能简化极其艰巨和昂贵的CAR-T细胞制造过程。”
9. 改良CAR-T细胞疗法!最新Science子刊研究:TOP CAR-T细胞疗法在实体瘤治疗领域获得重大突破
doi:10.1126/sciadv.adk1857
在一项新的研究中,来自阿尔伯特-爱因斯坦医学院的研究人员取得了重大进展,他们发现了一种改良的CAR-T细胞疗法,该疗法针对实体瘤展现出了前所未有的疗效,这一成果或将重塑癌症治疗格局。相关研究结果近期发表在Science Advances期刊上,论文标题为“TOP CAR with TMIGD2 as a safe and effective costimulatory domain in CAR cells treating human solid tumors”。
研究通讯作者Xingxing Zang博士表示:“CAR-T细胞疗法在血癌治疗领域已取得革命性成就,但在实体瘤面前却屡屡受挫。我们惊喜地发现,通过优化标准CAR-T细胞疗法,其对实体瘤,尤其是胰腺癌和胶质母细胞瘤这类难治性癌症的治疗效果得到了显著提升。”
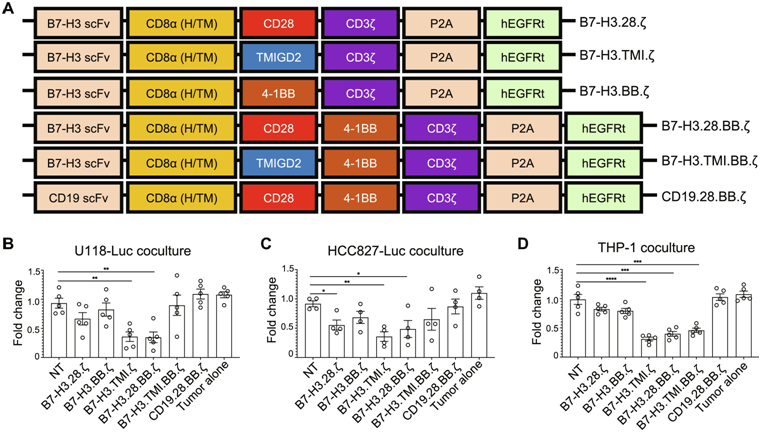
图片来自Science Advances, 2024, doi:10.1126/sciadv.adk1857
Zang博士和他的同事们开发出五种CAR-T细胞疗法,并在移植了人类实体瘤的小鼠模型上进行了实验。其中,一种疗法因融合了两项新颖元素而脱颖而出,它不仅安全有效地缩减了胶质母细胞瘤和胰腺肿瘤,同时也对肺癌肿瘤产生了显著的抑制效果。
Zang博士团队的五种CAR-T细胞疗法均采用了同一种新型的靶向蛋白——一种能与B7-H3结合的单克隆抗体,B7-H3是一种广泛存在于多数实体瘤及其血管表面的抗原。在此前的研究中,Zang博士已揭示B7-H3如何干扰T细胞功能,协助肿瘤逃脱免疫系统的追捕。为了克服这一障碍,Zang博士指出:“我们希望设计的CAR不仅能引导T细胞定位实体瘤,还能通过特异性结合B7-H3,阻止其削弱T细胞攻击和清除癌细胞及其血管的能力。”
然而,仅靠结合肿瘤细胞尚不足以确保癌细胞的死亡。为了激活T细胞,CAR还需包含一种共刺激蛋白。在Zang博士实验室研发的五种CAR-T细胞疗法中,四种采用了传统共刺激蛋白,而第五种则引入了一种前所未有的蛋白——TMIGD2。
实验结果显示,携带胰腺癌、肺癌和胶质母细胞瘤的小鼠在接受了新型CAR-T细胞疗法后,展现出令人鼓舞的疗效。其中,最引人注目的疗法结合了新型抗体与TMIGD2蛋白,被命名为TMIGD2优化效力/持久性(Optimized Potent/Persistent, TOP)CAR。
使用TOP CAR的CAR-T细胞疗法在胰腺、肺和胶质母细胞瘤小鼠模型中表现卓越,显著提高了小鼠的存活率。例如,在胶质母细胞瘤小鼠中,TOP CAR T细胞疗法使7只中的6只存活下来,而其他CAR-T疗法仅能挽救3只中的1只。此外,TOP CAR T细胞疗法在有效性和安全性指标上均展现出优势。
10. Blood Adv:新研究表明中性粒细胞网状结构可能是CAR-T细胞引发的细胞因子释放综合征的一种早期迹象
doi:10.1182/bloodadvances.2023010728
在一项新的研究中,来自密歇根大学罗杰尔癌症中心的研究人员揭示了作为人体免疫系统第一道防线的最常见白细胞类型与 CAR-T 细胞免疫疗法的一种严重并发症之间的联系。他们的研究结果表明一种叫做NETosis(中性粒细胞排出它们的DNA以形成网状结构)的过程可能会导致细胞因子释放综合征(cytokine release syndrome, CRS)的发生,其中CRS是一种可能危及生命的免疫系统过度激活现象。相关研究结果近期发表在Blood Advances期刊上,论文标题为“Longitudinal plasma proteomics in CAR T–cell therapy patients implicates neutrophils and NETosis in the genesis of CRS”。
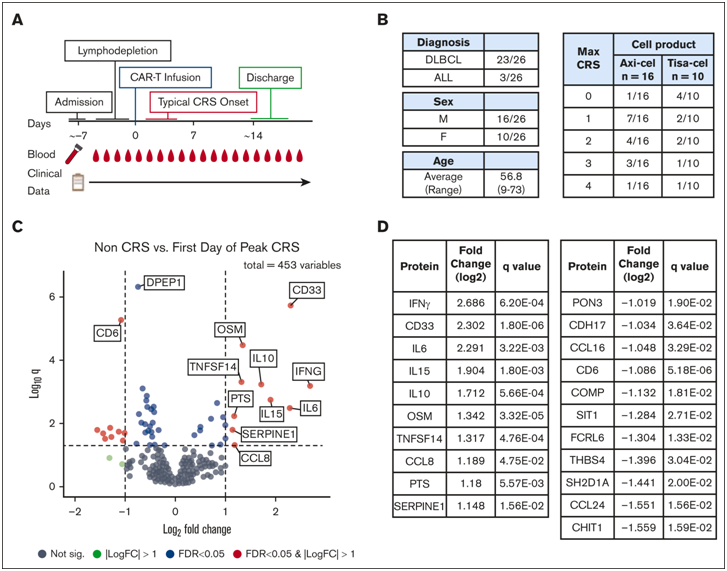
图片来自Blood Advances, 2024, doi:10.1182/bloodadvances.2023010728
在Muneesh Tewari教授和Sung Won Choi教授的领导下,这些作者确定了某些蛋白是 NETosis 的生物标志物,可以在患者出现症状之前预测他们可能出现CRS。
Tewari解释说,美国食品药品管理局(FDA)批准了一些可用于影响中性粒细胞的药物,如用于治疗酗酒的双硫仑(disulfiram)。虽然这些药物通常用于治疗其他疾病,但也可能用于抑制NETosis和预防CRS。
11. Nat Biotechnol:利用造血干细胞制造的异体CAR-iNKT细胞有望作为现成的细胞疗法治疗一系列癌症
doi:10.1038/s41587-024-02226-y
免疫疗法利用人体自身的免疫系统攻击癌细胞,阻止肿瘤生长,从而彻底改变了癌症治疗方法。然而,这些疗法往往需要根据每位患者的具体情况量身定制,从而减慢了治疗进程,导致每位患者的治疗费用高达数十万美元。
为了解决这些局限性,来自加州大学洛杉矶分校的研究人员在一项新的研究中开发出了一种新的临床指导方法,用于设计更强大的称为恒定自然杀伤细胞(invariant natural killer T cell, iNKT)的免疫细胞,可用于“现成的”癌症免疫疗法,即来自单一脐带血供体的免疫细胞可用于治疗多名患者。这一发现标志着向CAR-T细胞疗法等细胞疗法的大规模生产迈出了重要一步,使这些挽救生命的疗法更加经济实惠,更多患者可以接受。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Generation of allogeneic CAR-NKT cells from hematopoietic stem and progenitor cells using a clinically guided culture method”。论文通讯作者为加州大学洛杉矶分校微生物学、免疫学与分子遗传学教授Lili Yang博士。
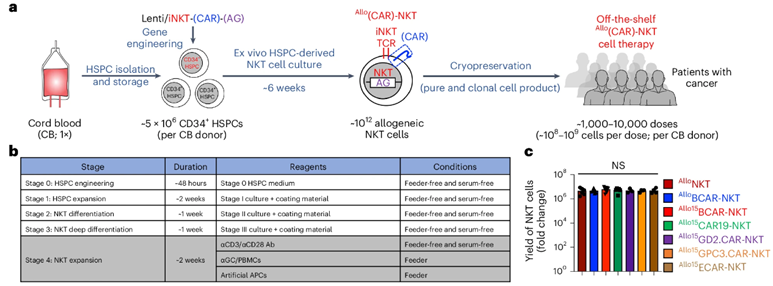
图片来自Nature Biotechnology, 2024, doi:10.1038/s41587-024-02226-y
2021年,Yang团队报告了一种利用造血干细胞生产大量iNKT细胞的方法。该系统需要使用三维胸腺类器官和支持细胞,这给生产和监管带来了挑战,阻碍了该方法的临床应用。如今,他们开发出一种技术,能以无饲养细胞和无血清的方式利用造血干细胞产生大量iNKT细胞。这种方法上的升级消除了以前的障碍,使得他们比以往任何时候都更接近为患者提供 “现成的”癌症免疫疗法。
这些作者从15份代表不同遗传背景的捐献者脐带血样本中分离出造血干细胞,它们可以自我复制并产生各种血细胞和免疫细胞。据估计,一次脐带血捐献可产生1000到10000剂量的治疗药物,因此该系统非常适合制造“现成的”免疫疗法。接下来,他们为iNKT细胞配备了嵌合抗原受体(CAR),这种分子能让免疫细胞识别并杀死特定类型的癌症,靶向治疗包括血癌和实体瘤在内的七种癌症。
12. Nat Med:临床试验表明TCR-T细胞免疫疗法有望治疗转移性结直肠癌
doi:10.1038/s41591-024-03109-0
来自一项小型临床试验的早期发现提供证据,表明一种新的细胞免疫疗法可能对治疗转移性实体瘤有效。在这项临床试验中,来自美国国家卫生研究院(NIH)的研究人员对每位患者的正常白细胞(即T细胞)进行了基因改造,使其产生能识别和攻击特定癌细胞的T细胞受体(TCR)。这些初步研究结果来自已经接受过多种早期治疗的转移性结直肠癌患者。这种个性化细胞免疫疗法缩小了一些患者的肿瘤,并能在长达七个月的时间里防止肿瘤再次生长。相关研究结果于2024年7月11日在线发表在Nature Medicine期刊上,论文标题为“Adoptive transfer of personalized neoantigen-reactive TCR-transduced T cells in metastatic colorectal cancer: phase 2 trial interim results”。
这种称为TCR-T细胞疗法的细胞免疫疗法克服了细胞免疫疗法中的两个难题:如何产生大量能特异性识别癌细胞的T细胞,以及如何提高经过基因改造后的T细胞灌注回相同患者体内后的增殖能力。
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-03109-0
在这项研究中,Rosenberg博士和他的同事为每位患者收集了存在于患者肿瘤中的T细胞。然后,他们使用复杂的分子表征技术,识别并分离出这些T细胞表面上的受体,即T 细胞受体(TCR),这些受体能识别每位患者肿瘤中的特定变化。对这些受体进行基因测序后,他们使用逆转录病毒将TCR基因导入从每位患者循环血液中收集的正常T细胞。这些经过基因改造的T细胞(即TCR-T细胞)在实验室中增殖到数亿个,然后输注回患者体内,在那里表达肿瘤特异性T细胞受体并继续增殖。
作为更大规模 2 期临床试验的一部分,7 名转移性结肠癌患者接受了实验性个性化TCR-T细胞免疫疗法的治疗。所有七名患者在接受这种细胞疗法之前都接受了几剂免疫疗法药物派姆单抗(pembrolizumab)治疗,之后又接受了另一种名为 IL-2 的免疫疗法药物。三名患者的肝脏、肺部和淋巴结中的转移性肿瘤大幅缩小,并持续了四到七个月。疾病进展的中位时间为 4.6 个月。
Rosenberg博士指出,在对治疗有反应的三名患者中,有两名患者接受了来自主要负责杀死病变细胞的细胞毒性 T 细胞的 TCR。Rosenberg博士说,他的研究团队正在探索如何将TCR导入正常的T细胞亚型中,以提高它们的反应性。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


