Science:揭示哺乳动物线粒体复合物I的作用机制
来源:本站原创 2020-09-27 12:52
2020年9月27日讯/生物谷BIOON/---线粒体是我们细胞的能量工厂,它产生的能量支撑着生命。一种称为复合物I(complex I)的巨型分子质子泵至关重要:它启动了一连串的反应,构建出质子梯度来驱动ATP产生。尽管复合物I发挥着核心作用,但是它跨膜运输质子的机制至今仍不为人所知。如今,在一项新的研究中,奥地利科学技术研究所的Leonid Sazano
2020年9月27日讯/生物谷BIOON/---线粒体是我们细胞的能量工厂,它产生的能量支撑着生命。一种称为复合物I(complex I)的巨型分子质子泵至关重要:它启动了一连串的反应,构建出质子梯度来驱动ATP产生。尽管复合物I发挥着核心作用,但是它跨膜运输质子的机制至今仍不为人所知。
如今,在一项新的研究中,奥地利科学技术研究所的Leonid Sazanov及其研究团队破解了复合物I的工作原理之谜:它的构型变化与静电波相结合,将质子移入线粒体基质中。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“The coupling mechanism of mammalian respiratory complex I”。
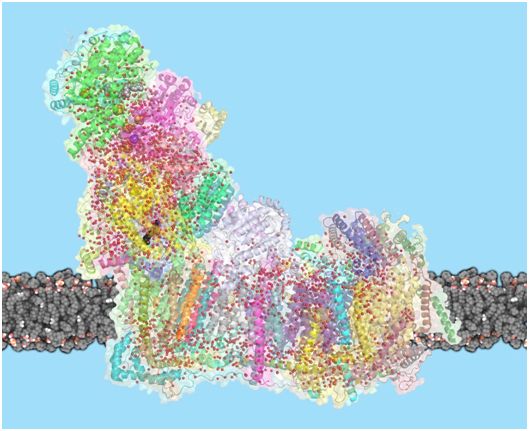
复合物I是呼吸链中的第一个酶。呼吸链由线粒体内膜中的一系列蛋白复合物组成,负责细胞的大部分能量生产。在呼吸链中,三种膜蛋白建立了质子梯度,将质子从细胞质中移入线粒体基质。驱动这个过程的能量主要来自于NADH分子(来源于我们吃的食物)和我们呼吸的氧气之间的电子转移。ATP合酶是呼吸链中的最后一个蛋白,利用这种质子梯度产生ATP。
复合物I如此引人关注不仅在于它在生命中的核心作用,还在于它的体积:真核生物复合物I的分子量为1兆道尔顿,是最大的膜蛋白之一。这种尺寸也使得复合物I难以研究。2016年,Sazanov团队继2013年解析出一种较为简单的细菌酶的结构后,又率先确定了哺乳动物复合物I的结构。但是,复合物I跨膜移动质子的机制一直存在争议。Sazanov解释说,“一种观点是复合物I的一部分像活塞一样工作,以打开和关闭质子通过的通道。另一种观点是复合物I中心的氨基酸残基充当了驱动器的作用。事实证明,一种更不寻常的机制在发挥作用。”
水线帮助质子在膜上跳跃
此前,Sazanov团队已发现L型的复合物I由亲水臂和膜臂组成。在亲水臂中,电子从NADH转移到疏水性电子载体:醌。膜臂是发生质子转运的地方,有三个类似的结构与反向转运体(antiporter)相关的亚基,还有一个含有醌结合腔的亚基。在这个醌结合腔中,复合物I在每个催化周期将两个电子转移给醌,醌将电子进一步转移给复合物III和复合物IV。但是,由于这些反向转运体样亚基远离醌结合腔,电子与醌之间的相互作用如何能够让每个催化周期的4个质子跨膜移动,就成了谜团。
为了解决这个难题,Sazanov团队对绵羊复合物I进行了低温电镜研究。在一连串的努力下,论文第一作者、Sazanov团队的博士生Domen Kampjut解析出在不同条件下获得的复合物I的23种不同结构。通过添加NADH和醌,他们可以捕捉到复合物I在工作时的图像,其中在工作时,它在两个主要状态之间改变构象。由于实现了高分辨率,他们可以识别这种蛋白内部的水分子,这些水分子是允许质子转移的关键。他们发现,膜臂中心轴上的许多水分子为质子在极性氨基酸残基和水之间的跳跃提供了途径,从而形成了沿着和跨过膜的通道。
但只有在离醌最远的一个亚基中,质子才会跨膜跳跃。其他两个亚基则在这个最远的亚基和醌之间提供耦合。当醌结合腔“等待”醌的到来时,一个螺旋阻挡了膜臂中心轴中的水线(water wire)。当醌在醌结合腔中结合时,这个区域周围的蛋白构象发生了巨大的变化,这个螺旋发生旋转。这时,水线连接了复合物I的所有膜亚基,两个质子被转移到醌,从而完成对醌的还原。这种机制的这个关键部分在于第一个反向转运体附近产生了电荷,并启动了带电氨基酸残基之间相互作用的静电波,该静电波沿着这些反向转运体传播,导致总共四个质子的转移。
Sazanov解释说,“我们发现一种新的、意想不到的机制在复合物I中起作用。构象变化和静电波相结合驱动质子跨膜转移。这似乎有点过度,但可能有助于这种机制保持健壮。”
这项新的研究补充了Sazanov团队在过去两个月中发表的两项研究:其中的一项研究涉及细菌复合物I中质子泵送机制(Nature Communications, 18 August 2020, doi:10.1038/s41467-020-17957-0),另外一项涉及MRP反向转运体的结构(eLife, 31 Jul 2020, doi:10.7554/eLife.59407)。复合物I就是由MRP反向转运体演变而来的。(生物谷 Bioon.com)
参考资料:
1.Domen Kampjut et al. The coupling mechanism of mammalian respiratory complex I. Science, 2020, doi:10.1126/science.abc4209.
2.Javier Gutiérrez-Fernández et al. Key role of quinone in the mechanism of respiratory complex I. Nature Communications, 2020, doi:10.1038/s41467-020-17957-0.
3.Julia Steiner et al. Structure and mechanism of the Mrp complex, an ancient cation/proton antiporter. eLife, 2020, doi:10.7554/eLife.59407.
4.Mystery of giant proton pump solved
https://ist.ac.at/en/news/mystery-of-giant-proton-pump-solved/
如今,在一项新的研究中,奥地利科学技术研究所的Leonid Sazanov及其研究团队破解了复合物I的工作原理之谜:它的构型变化与静电波相结合,将质子移入线粒体基质中。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“The coupling mechanism of mammalian respiratory complex I”。

膜上的复合物I,水分子显示为红色球体,醌用黑色表示,NADH用灰色表示。图片来自IST Austria。
复合物I是呼吸链中的第一个酶。呼吸链由线粒体内膜中的一系列蛋白复合物组成,负责细胞的大部分能量生产。在呼吸链中,三种膜蛋白建立了质子梯度,将质子从细胞质中移入线粒体基质。驱动这个过程的能量主要来自于NADH分子(来源于我们吃的食物)和我们呼吸的氧气之间的电子转移。ATP合酶是呼吸链中的最后一个蛋白,利用这种质子梯度产生ATP。
复合物I如此引人关注不仅在于它在生命中的核心作用,还在于它的体积:真核生物复合物I的分子量为1兆道尔顿,是最大的膜蛋白之一。这种尺寸也使得复合物I难以研究。2016年,Sazanov团队继2013年解析出一种较为简单的细菌酶的结构后,又率先确定了哺乳动物复合物I的结构。但是,复合物I跨膜移动质子的机制一直存在争议。Sazanov解释说,“一种观点是复合物I的一部分像活塞一样工作,以打开和关闭质子通过的通道。另一种观点是复合物I中心的氨基酸残基充当了驱动器的作用。事实证明,一种更不寻常的机制在发挥作用。”
水线帮助质子在膜上跳跃
此前,Sazanov团队已发现L型的复合物I由亲水臂和膜臂组成。在亲水臂中,电子从NADH转移到疏水性电子载体:醌。膜臂是发生质子转运的地方,有三个类似的结构与反向转运体(antiporter)相关的亚基,还有一个含有醌结合腔的亚基。在这个醌结合腔中,复合物I在每个催化周期将两个电子转移给醌,醌将电子进一步转移给复合物III和复合物IV。但是,由于这些反向转运体样亚基远离醌结合腔,电子与醌之间的相互作用如何能够让每个催化周期的4个质子跨膜移动,就成了谜团。
为了解决这个难题,Sazanov团队对绵羊复合物I进行了低温电镜研究。在一连串的努力下,论文第一作者、Sazanov团队的博士生Domen Kampjut解析出在不同条件下获得的复合物I的23种不同结构。通过添加NADH和醌,他们可以捕捉到复合物I在工作时的图像,其中在工作时,它在两个主要状态之间改变构象。由于实现了高分辨率,他们可以识别这种蛋白内部的水分子,这些水分子是允许质子转移的关键。他们发现,膜臂中心轴上的许多水分子为质子在极性氨基酸残基和水之间的跳跃提供了途径,从而形成了沿着和跨过膜的通道。
但只有在离醌最远的一个亚基中,质子才会跨膜跳跃。其他两个亚基则在这个最远的亚基和醌之间提供耦合。当醌结合腔“等待”醌的到来时,一个螺旋阻挡了膜臂中心轴中的水线(water wire)。当醌在醌结合腔中结合时,这个区域周围的蛋白构象发生了巨大的变化,这个螺旋发生旋转。这时,水线连接了复合物I的所有膜亚基,两个质子被转移到醌,从而完成对醌的还原。这种机制的这个关键部分在于第一个反向转运体附近产生了电荷,并启动了带电氨基酸残基之间相互作用的静电波,该静电波沿着这些反向转运体传播,导致总共四个质子的转移。
Sazanov解释说,“我们发现一种新的、意想不到的机制在复合物I中起作用。构象变化和静电波相结合驱动质子跨膜转移。这似乎有点过度,但可能有助于这种机制保持健壮。”
这项新的研究补充了Sazanov团队在过去两个月中发表的两项研究:其中的一项研究涉及细菌复合物I中质子泵送机制(Nature Communications, 18 August 2020, doi:10.1038/s41467-020-17957-0),另外一项涉及MRP反向转运体的结构(eLife, 31 Jul 2020, doi:10.7554/eLife.59407)。复合物I就是由MRP反向转运体演变而来的。(生物谷 Bioon.com)
参考资料:
1.Domen Kampjut et al. The coupling mechanism of mammalian respiratory complex I. Science, 2020, doi:10.1126/science.abc4209.
2.Javier Gutiérrez-Fernández et al. Key role of quinone in the mechanism of respiratory complex I. Nature Communications, 2020, doi:10.1038/s41467-020-17957-0.
3.Julia Steiner et al. Structure and mechanism of the Mrp complex, an ancient cation/proton antiporter. eLife, 2020, doi:10.7554/eLife.59407.
4.Mystery of giant proton pump solved
https://ist.ac.at/en/news/mystery-of-giant-proton-pump-solved/
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


