多篇文章解读科学家们在细胞外囊泡研究领域取得的新进展!
来源:生物谷原创 2024-04-29 11:20
细胞外囊泡衍生物或有望作为早期肝细胞癌的无创诊断生物标志物、中国科学家建立细胞外囊泡数据挖掘新技术、利用胞外囊泡递送mRNA可增强免疫疗法治疗胶质母细胞瘤的疗效
本文中,小编整理了近期科学家们发表的多项重要研究成果,共同解读他们在细胞外囊泡研究领域取得的新成果,分享给大家!
【1】J Exp Clin Cancer Res:细胞外囊泡衍生物或有望作为早期肝细胞癌的无创诊断生物标志物
doi:10.1186/s13046-023-02867-y
据报道,肝癌是2020年全球第六大最常诊断的癌症。虽然各种研究加深了我们对HCC癌变的认识,但在乙型肝炎、丙型肝炎和肝硬化(LC)高危人群中,HCC的监测主要依靠腹部超声检查和血甲胎蛋白(AFP)的测定。考虑到腹部超声对早期HCC检测的敏感性较低,以及由于出血风险高,这可能被认为是最迫切需要液体活检的一种癌症。一些新的基于血液的生物标志物,包括去γ -羧基凝血酶原、炉灶透镜凝集素反应性AFP、血浆microRNA表达、甲基化DNA标志物、循环肿瘤DNA和循环肿瘤细胞,已经被研究。然而,这些标志物均未列入实践指南的标准监测方法。
近日,来自韩国亚洲大学的研究者们在J Exp Clin Cancer Res杂志上发表了题为“Circulating small extracellular vesicle-derived splicing factor 3b subunit 4 as a non-invasive diagnostic biomarker of early hepatocellular carcinoma” 的文章,该研究表明SF3B4可能与HCC的肿瘤免疫浸润有关,EV-SF3B4有望成为HCC的一种新型无创诊断生物标志物。研究者采用酶联免疫吸附试验(ELISA)检测健康对照(hc)和慢性肝炎、肝硬化和HCC患者血浆样品中的SF3B4水平。检测各组患者血浆中检测SF3B4的自身抗体的表达水平。从患者血清中分离小细胞外囊泡(ev),采用定量反转录PCR检测EV-SF3B4的表达水平。
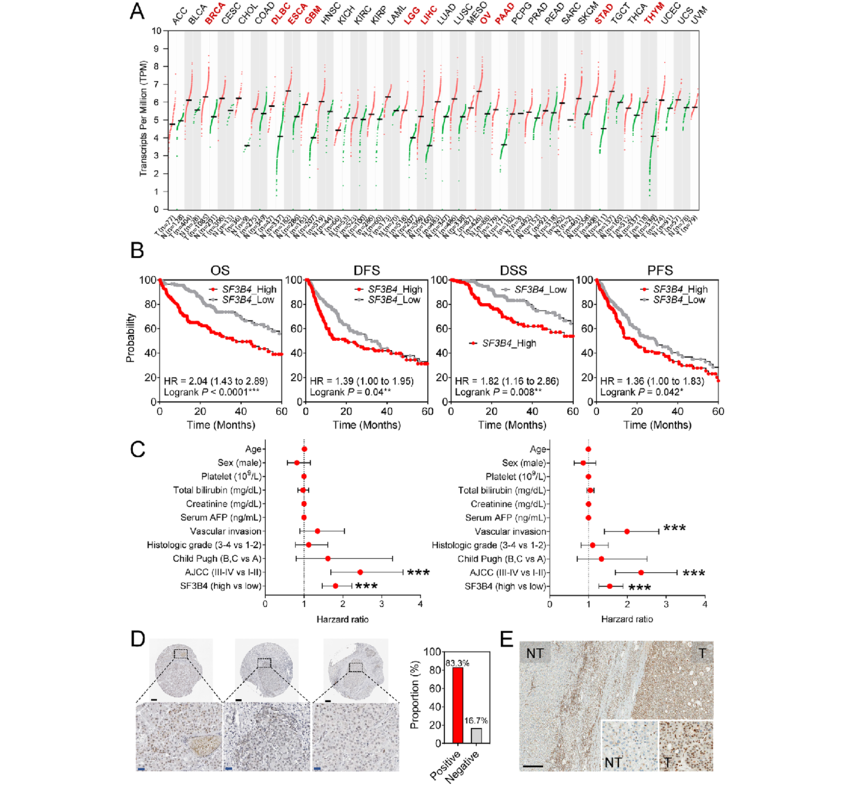
细胞外囊泡衍生物或有望作为早期肝细胞癌的无创诊断生物标志物
图片来源:J Exp Clin Cancer Res,doi:10.1186/s13046-023-02867-y
ELISA结果证实,HCC患者血浆中SF3B4蛋白和自身抗体的表达水平高于HCC患者。但其诊断效果并不优于甲胎蛋白(AFP)。SF3B4 mRNA在肝细胞癌患者血清EV中表达升高,而在肝细胞癌患者血清中表达升高。血清EV-SF3B4对所有阶段HCC的诊断能力均优于AFP (AUC = 0.968 vs. 0.816),包括早期HCC (AUC = 0.960 vs. 0.842),这在外部队列中也是一致的。单细胞RNA测序显示SF3B4表达与髓源性抑制细胞相关。肿瘤免疫估计资源数据库再次证实了肝癌中SF3B4表达与免疫细胞浸润的相关性。
【2】Nat Methods:中国科学家建立细胞外囊泡数据挖掘新技术
doi:10.1038/s41592-023-02117-1
近日,一篇发表在国际杂志Nature Methods上题为“SEVtras delineates small extracellular vesicles at droplet resolution from single-cell transcriptomes”的研究报告中,来自中国科学院等机构的科学家们通过研究首次建立了胞外小囊泡异质性追踪算法SEVtras,并提出了胞外小囊泡分泌活性指标,以细胞外尺度描绘了不同类型细胞的生理活动状态。
通过多次实验验证和对单细胞组学数据的评估,SEVtras被证明能够有效地在单细胞数据中识别胞外小囊泡并准确测量其分泌活性。进一步,研究将该算法应用于现有的大量单细胞数据集中,系统地描绘了不同类型细胞分泌胞外小囊泡异质性谱系,并发现了淋巴细胞的胞外小囊泡分泌活性与胰腺癌侵袭显著相关,可在肿瘤早期作为有力的预测指标,为临床发现潜在标志物打开了新思路。上述成果推进了胞外囊泡组学异质性高通量追踪的研究进展,为解析海量单细胞转录组学数据提供了独特的“胞外视角”。
该工作探究了SEVtras在单细胞转录组测序数据中是否能够识别出胞外小囊泡。科研人员在未经处理的样本中引入NanoLuc标记的胞外小囊泡,并在经过单细胞预处理步骤后,发现样本中仍存在大量胞外小囊泡。进而,研究人员分离了胞外小囊泡、大囊泡和细胞碎片,进行了单独的转录组测序。结果显示,胞外小囊泡的转录谱与其他几类存在显著差异,且能够通过胞外小囊泡基因集的富集来识别。基于这些发现,研究设计了一种利用期望最大化算法的胞外小囊泡识别算法,并提出了衡量胞外小囊泡分泌活性的度量指标。
为验证算法可靠性,该团队进行了三种类型的单细胞实验:测量两种细胞系(MSC和293F)的单细胞转录组,并将识别出的胞外小囊泡与实验分离的进行对比;在MSC的单细胞样本中添加细胞碎片或大囊泡;在MSC的单细胞样本中添加不同比例的实验分离的胞外小囊泡和刺激胞外小囊泡分泌的诱导剂。上述实验证明了SEVtras对胞外小囊泡的特异性识别,使其成为解析胞外小囊泡异质性的有力工具。
【3】Nat Commun:利用胞外囊泡递送mRNA可增强免疫疗法治疗胶质母细胞瘤的疗效
doi:10.1038/s41467-023-42365-5
近日,一篇发表在国际杂志Nature Communications上题为“Adaptive design of mRNA-loaded extracellular vesicles for targeted immunotherapy of cancer”的研究报告中,来自美国德克萨斯大学MD安德森癌症中心的研究人员开发出一种利用胞外囊泡(extracellular vesicles)增强胶质母细胞瘤对免疫疗法作出反应的新方法,这可能为更广泛地利用工程化mRNA治疗癌症打开了大门。
今年早些时候,由德克萨斯大学MD安德森癌症中心的Betty Kim博士和Wen Jiang博士温江领导的一个研究团队开发出了一种将mRNA装载到胞外囊泡中的新方法,其中胞外囊泡是细胞为在体内运输等核酸生物分子而产生的小结构。这项新的研究以此为基础,展示了装载mRNA的胞外囊泡的抗肿瘤潜力。mRNA 疗法长期以来在抵抗病原体感染和癌症等疾病方面具有突破性潜力。然而,在体内准确递送mRNA 仍面临挑战。多年来,科学家们一直在研究潜在的递送机制,包括脂质或聚合物纳米颗粒,但这些机制都有各自的局限性。
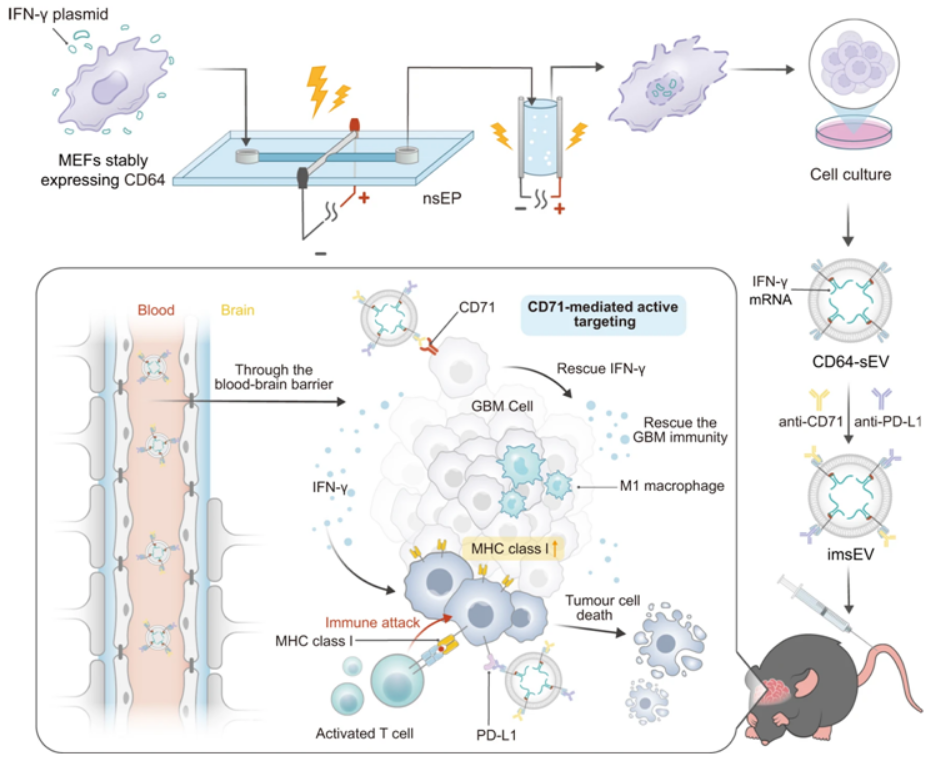
图片来源:Nature Communications, 2023, doi:10.1038/s41467-023-42365-5
Jiang说,“使用 mRNA 疗法治疗癌症有两个主要挑战。首先,如何准确靶向体内的肿瘤细胞?其次,如何产生足够的治疗药物供人类使用?我们的方法解决了这两个问题。”这种制药药物数量问题通过使用一种高通量系统让工程化细胞产生装载mRNA的胞外囊泡得以解决。对宿主细胞和编码mRNA的定制质粒施加两个极短的电脉冲,使细胞内的膜和细胞膜本身暂时变得通透。这样,细胞就会分泌出许多装载mRNA的胞外囊泡,然后就可以收集这些胞外囊泡了。
【4】Adv Sci:科学家揭示由小细胞外囊泡所介导的特殊信号通路 有望帮助开发治疗人类肝细胞癌的新型疗法
doi:10.1002/advs.202302677
肝细胞癌是一种高血管性的恶性肿瘤,其生长和播散主要是由肿瘤衍生的小细胞外囊泡(sEVs,small extracellular vesicles)的调节来驱动的。近日,一篇发表在国际杂志Advanced Science上题为“Small Extracellular Vesicle‐Derived vWF Induces a Positive Feedback Loop between Tumor and Endothelial Cells to Promote Angiogenesis and Metastasis in Hepatocellular Carcinoma”的研究报告中,来自中国香港大学等机构的科学家们通过研究揭示了肝癌患者机体所衍生的循环小细胞外囊泡所介导的促进肝癌发生转移的未被识别的特殊信号通路,这一研究发现或有望帮助科学家们开发治疗人类肝癌的潜在治疗性策略。
在香港,肝癌是人群中第五大最常见的癌症类型和第三大癌症相关死亡的主要原因;作为一种高血管性的肿瘤,其常常是由肿瘤微环境中的小细胞外囊泡来调节驱动的。增强的血管化会促使肿瘤细胞进入到血液中,并能促使其播散到附近的位点进而实现癌症转移,如今越来越多的研究证据表明,肿瘤所衍生的小细胞外囊泡在调节血管生成信号的过程中发挥着重要作用,而理解肝癌中小细胞外囊泡调节血管生成背后的分子机制或有望帮助科学家们开发新型治疗性策略。
文章中,对受试者和肝细胞癌患者机体中循环的小细胞外囊泡进行蛋白质组学分析后,研究者发现,von Willibrand因子(vWF)或许会在肝癌的发生阶段逐渐上调;而且肝细胞癌患者机体中小细胞外囊泡-vWF水平的急剧上升或许表明其能作为一种肝癌的非侵入性诊断标志物;研究者还指出抗vWF抗体或能抑制晚期肝癌患者机体中循环的小细胞外囊泡在肝癌发生和转移过程中的诱导能力,这就阐明了小细胞外囊泡-vWF在肝癌中所扮演的关键角色。
【5】Nature:揭示肿瘤释放的细胞外囊泡和颗粒引发肝脏代谢功能异常机制
doi:10.1038/s41586-023-06114-4
近日,一篇发表在国际杂志Nature上题为“Tumour extracellular vesicles and particles induce liver metabolic dysfunction”的研究报告中,来自美国威尔康奈尔医学院的研究人员通过研究发现,癌症经常向血液中释放分子,对肝脏产生病理改变,使得它进入炎症状态,导致脂肪堆积,损害肝脏正常的排毒功能。这一发现揭示了癌症更隐蔽的生存机制之一,并提出了检测和逆转这一过程的新测试和药物的可能性。
具体而言,这些作者发现,在肝脏外生长的多种类型的肿瘤通过分泌含有脂肪酸的细胞外囊泡和颗粒(extracellular vesicles and particle, EVP),可以远程将肝脏重编程为类似于脂肪肝的状态。他们在癌症的动物模型和人类癌症患者的肝脏中发现了这个过程的证据。研究者David Lyden博士表示,我们的发现表明,肿瘤可以导致包括肝脏疾病在内的重大系统性并发症,而且还表明这些并发症可以通过未来的治疗来解决。
在过去的二十年里,Lyden和他的研究团队一直在研究癌症的全身影响。这些影响反映了癌症用来确保其生存和加速其进展的特定策略。例如,在他们于2015年发表的一项研究中,Lyden团队发现胰腺癌分泌的分子被包裹在细胞外囊泡中,这些囊泡通过血液流动,被肝脏摄取,并使该器官准备好支持新的、转移性肿瘤的生长。在这项新的研究中,这些作者发现了一系列由远处的癌细胞引起的不同的肝脏变化,他们在骨癌、皮肤癌和乳腺癌的动物模型中观察到这些癌细胞转移到其他器官,但没有转移到肝脏。他们的关键发现是,这些肿瘤诱导脂肪分子在肝细胞中积累,从而以一种类似于肥胖和酒精相关疾病(即脂肪肝)的方式重编程肝脏。
【6】PNAS:细胞外囊泡或在刺激机体T细胞反应上扮演着关键角色
doi:10.1073/pnas.2210047120
作为机体免疫系统的一个主要组成部分,T细胞在帮助机体抵御病毒感染方面发挥着关键角色,CD8+ T细胞对于清除病毒感染非常重要,在急性感染期,促炎性状况会增加机体中循环磷脂酰丝氨酸+(PS,phosphatidylserine)细胞外囊泡(EVs)的数量,而这些细胞外囊泡尤其会与CD8+ T细胞相互作用,然而,其是否真的能主动调节CD8+ T细胞的反应,目前研究人员并不清楚。
近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Phosphatidylserine-positive extracellular vesicles boost effector CD8 + T cell responses during viral infection”的研究报告中,来自德国慕尼黑大学等机构的科学家们通过对小鼠模型进行研究后发现,所谓的细胞外囊泡在刺激T细胞方面发挥着重要作用。
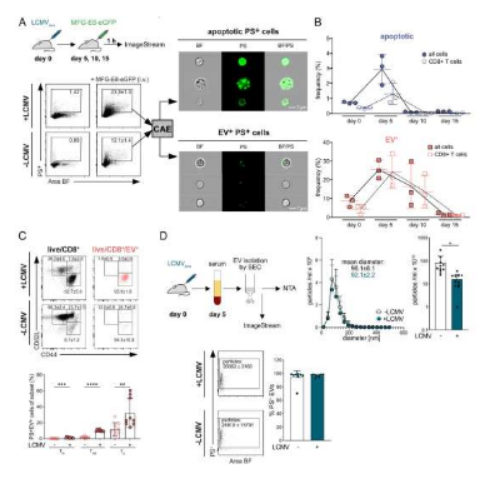
细胞外囊泡或在刺激机体T细胞反应上扮演着关键角色
图片来源:Proceedings of the National Academy of Sciences (2023). DOI:10.1073/pnas.2210047120
细胞外囊泡是由细胞所分泌的微小膜颗粒,其在细胞-细胞间的交流沟通方面发挥着重要角色,这项研究中,研究人员利用利用一种新开发的方法进行研究后发现,已经激活的杀伤性T细胞(一种能直接攻击疾病细胞的T细胞亚群)能与这些细胞外囊泡密切接触相互作用。这或许就给了T细胞一种额外的“助力”,或许具有促进其增殖的作用,并能增加需要抵御感染的多种基因的激活。
【7】Nature子刊:中国科学家发现基于自愈外泌体装载微胶囊的新型伪细胞制剂有望治疗多种玻璃体视网膜疾病
doi:10.1038/s41551-023-01112-3
近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Exosome-loaded degradable polymeric microcapsules for the treatment of vitreoretinal diseases”的研究报告中,来自中国科学院过程工程研究所等机构的科学家们通过研究开发出一种基于自愈外泌体装载微胶囊(self-healing exosome-loaded microcapsule)的新型“伪细胞(pseudo cell)”制剂,可用于治疗多种玻璃体视网膜疾病(vitreoretinal disease)。
玻璃体视网膜疾病包括多种威胁视力的疾病,可能导致严重的不可逆视力丧失。目前临床上治疗玻璃体视网膜疾病的效果普遍不尽如人意,而且治疗往往会产生多种副作用。此外,还经常需要重复治疗,导致患者依从性差。近年来,科学家们探索了针对眼科的细胞疗法的可能性。尽管取得了一些积极成果,但是针对眼科的细胞疗法也遇到了一系列问题,如细胞存活率低、细胞表型不稳定、需要严格的储存条件等,限制了这些细胞技术在临床上的可行性。
众所周知,许多细胞类型的治疗效果涉及旁分泌机制。因此,这些作者探索了利用更稳定的细胞分泌成分(如外泌体)作为治疗成分治疗眼部疾病的可能性。受此启发,他们提出了一种“伪细胞”制剂平台。在这种平台中,从细胞中分离出的外泌体被装入自愈合微胶囊---ExoCaps---中。中国科学院过程工程研究所的Ma Guanghui教授说,“ExoCaps从大小、内部结构和分泌行为等方面模拟了功能性细胞。”
【8】Theranostics:中国科学家揭示工程化外泌体或是治疗动脉粥样硬化和年龄相关疾病的关键
doi:10.7150/thno.87484
动脉粥样硬化(AS)是一种以血脂异常和慢性炎症为特征的普遍血管疾病。尽管使用了预防性降脂和抗炎治疗策略,但仍然迫切需要更有效的治疗方案。最近的研究表明,斑块中衰老细胞的显著积累与斑块不稳定性呈正相关。斑块中的衰老细胞加重慢性炎症,加速AS进展,产生衰老相关分泌表型(SASP),由基质重塑蛋白酶、趋化因子、细胞因子、生长因子和脂质组成。因此,靶向清除斑块中的衰老细胞是治疗AS的一种有希望的治疗策略。
近日,一篇发表在国际杂志Theranostics上题为“Targeted elimination of senescent cells by engineered extracellular vesicles attenuates atherosclerosis in ApoE-/- mice with minimal side effects”的研究报告中,来自中国空军军医大学等机构的科学家们通过研究表明,磁性EV递送iBax mRNA和BAX激活剂BTSA1或能有效诱导动脉粥样硬化斑块中受体衰老细胞凋亡。这一策略代表了一种治疗AS和其他年龄相关疾病的有希望的方法。
斑块中的衰老细胞是动脉粥样硬化(as)的一个有害因素,针对动脉粥样硬化,靶向溶衰老可能是一种很有前途的治疗策略。开发安全、高效的抗衰老药物用于靶向递送清除衰老细胞是迫切需要的。通过分子克隆构建促凋亡智能Bax (iBax)过表达质粒,将Bax CDS融合到miR-122识别位点。基于细胞外囊泡的senolytics (EViTx)表面与磁性纳米颗粒偶联,内部封装iBax mRNA,并将BAX激活剂BTSA1掺入膜中。对EViTx进行表征,并通过荧光成像追踪其在体内的分布。分析了EViTx对ApoE-/-小鼠AS的治疗作用及其全身副作用。
【9】Nat Nanotechnol:科学家开发基于外泌体的吸入式mRNA疗法,用于肺癌治疗并促进全身免疫,防止癌症复发
doi:10.1038/s41565-023-01580-3
近日,一篇发表在国际杂志Nature Nanotechnology上题为“Inhalable extracellular vesicle delivery of IL-12 mRNA to treat lung cancer and promote systemic immunity”的研究报告中,来自哥伦比亚大学等机构的科学家们通过研究开发了可吸入的装载IL-12 mRNA的外泌体——IL-12-Exo,在肺癌小鼠模型中促进了IFNγ介导的免疫激活、全身免疫和免疫记忆,成功抑制了肺癌,并能防止肿瘤复发。
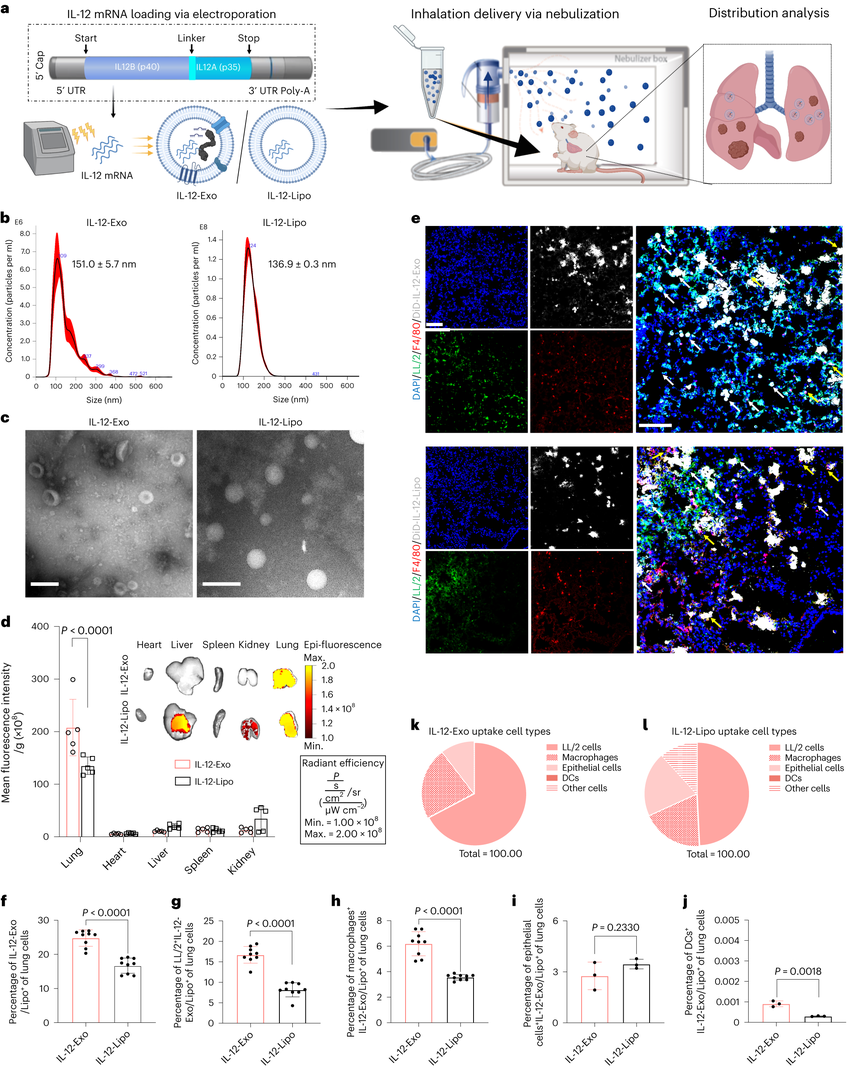
科学家开发基于外泌体的吸入式mRNA疗法 有望防止肺癌复发
图片来源:Nature Nanotechnology,doi:10.1038/s41565-023-01580-3
在这项研究中,研究团队通过电穿孔将IL-12 mRNA载入人胚肾细胞来源的外泌体(HEK-Exo),生成装载IL-12 mRNA的外泌体—IL-12-Exo,可通过吸入进行肺部局部给药。在肺癌小鼠模型中的研究显示,吸入式给药IL-12-Exo后,其在肺癌肿瘤微环境中的生物分布优于装载IL-12 mRNA的脂质体(IL-12-Lipo),并且具有最小的全身毒性。
IL-12 mRNA在先天性和适应性免疫细胞群中促进了干扰素-γ(IFN-γ)的产生,这导致了肿瘤微环境中强烈的激活状态,并增强其免疫原性。增加的免疫反应导致肿瘤细胞毒性免疫效应细胞的扩增,免疫记忆的形成,抗原呈递的改善和肿瘤特异性T细胞启动。吸入式给药IL-12-Exo不仅能够抑制肺部原发性肿瘤,还能增强对后续肿瘤再挑战的抵抗力,防止肿瘤复发。
这些结果证明了通过吸入式外泌体进行局部递送基于细胞因子的免疫疗法在治疗原位和转移性肺肿瘤的潜力。
【10】Theranostics :NLRP3炎性小体失活介导外泌体预防心房颤动
doi:10.7150/thno.89520
尽管经历了半个多世纪的经验,30%-50%的患者在心脏手术后2-3天仍然经历着心房颤动(AF)。房颤影响术后愈合,因为快速失控的心率对术后心脏施加代谢需求,而不动的心房增加了血栓形成和中风的风险。因此,术后房颤增加了住院费用、住院时间和患者发病率。除了持续使用β-受体阻滞剂来抑制触发房颤的异位搏动外,目前还没有任何药物或程序可以最终减少心脏手术后房颤的发生。
近日,来自渥太华大学的研究者们在Theranostics杂志上发表了题为“Inactivation of the NLRP3 inflammasome mediates exosome-based prevention of atrial fibrillation”文章,该研究揭示了NLRP3炎性小体失活介导外泌体预防心房颤动。
在无菌心包炎大鼠模型中,在开胸手术时,将来自人类外植体来源的细胞外小泡(EV)直接注射到心房壁肌肉中,可以减少心房纤维化、心房炎症和心房颤动(AF)。虽然这是一个预防术后房颤的有希望的解决方案,但这种效果背后的机制(S)尚不清楚,也不清楚这种益处是否依赖于EV剂量。确定人外植体来源的EVS在无菌心包炎大鼠模型中的量效关系。在应用滑石粉时,将递增剂量的EVS(106、107、108或109)或赋形剂对照组注入中年雄性SD大鼠的心房。假对照组被包括在内,以证明背景诱导性。术后3天,所有大鼠在处死前接受侵入性电生理测试。
心包炎增加了诱发房颤的可能性(p<0.05与假手术相比)。所有剂量都降低了诱发房颤的可能性,最大剂量治疗后的效果最好(109,p<0.05与赋形剂相比)。心包炎增加了心房纤维化,而EV治疗限制了心包炎对心房纤维化的影响,在108或109个EV治疗后效果最好。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


