《自然·癌症》:六个蛋白组亚型,道出肺癌免疫逃逸之谜
来源:应雨妍 2022-01-16 09:08
尽管肺癌治疗手段已有显着进步,患者长期存活率仍然很低。靶向治疗和免疫治疗的快速发展带来了新的曙光,但目前仍受制于非常有限的生物标志物和治疗组合方式。鉴定肺癌特征性基因和克服免疫逃逸成为重要的临床需求。近日,来自瑞典Karolinska Institutet的Janne Lehti?团队在《自然·癌症》期刊发表了重要研究成果。他们对141份包含所有主流组织学类
尽管肺癌治疗手段已有显着进步,患者长期存活率仍然很低。
靶向治疗和免疫治疗的快速发展带来了新的曙光,但目前仍受制于非常有限的生物标志物和治疗组合方式。鉴定肺癌特征性基因和克服免疫逃逸成为重要的临床需求。
近日,来自瑞典Karolinska Institutet的Janne Lehti?团队在《自然·癌症》期刊发表了重要研究成果。
他们对141份包含所有主流组织学类型的非小细胞肺癌(NSCLC)样本进行了深度质谱分析,鉴别出六种不同蛋白组类型的肺癌,它们各自具有特异性免疫细胞组成和免疫检查点表达。同时,他们还发现肿瘤新生抗原负荷与基因组超甲基化密切相关,并揭示了与免疫逃逸相关联的基因突变和信号通路。
肺癌是全世界最常见的癌症类型之一,预计每年新增病例210万人。遗憾的是,绝大部分病例得到诊断时已发生转移,无法进行手术切除,导致NSCLC五年存活率仅有24%,而IV期病人五年存活率仅有6%。(https://seer. cancer.gov)
近年来,对临床患者的DNA和RNA组学分析,展示出了从系统层面理解肺癌的重要性。随着现代质谱的发展,科学家们终于可以直接测定药物真正靶向的分子,即蛋白组。蛋白组分析的一个重要特点是不但能分析样本组织中的癌细胞,还包括其中的间质和浸润免疫细胞。从而可以提供更加完整的分子表型全景图,帮助人们从整体的角度理解肿瘤的特征。
Lehti团队选用的141份肿瘤组织样本包含:腺癌(AC),鳞状细胞癌(SqCC),大细胞神经内分泌癌(LCNEC)和大细胞癌(LCC)。另有2份小细胞肺癌(SCLC)样本作为参照。由于晚期(III–IV期)NSCLC很少再涉及手术切除肿瘤,这些样本主要属于早期癌组织(I–II期,占87%)。
为了进行全面的分子表征分析,Lehti团队采用了等压标记和高分辨率等电聚焦液相色谱质谱(LC–MS)。除了质谱数据以外,研究者们还进行了370个癌症相关基因的测序分析,并在大部分样本中都进行了基因组甲基化和mRNA含量的测定。
通过一致性聚类分析,Lehti团队将NSCLC蛋白质组分成了六个亚型。亚型1-4中主要包含腺癌(AC,占比77–100%)。亚型5主要为大细胞神经内分泌癌(LCNEC,占比64%)。亚型6中则集中为鳞状细胞癌(SqCC,占比96%)。
两份小细胞肺癌样本均聚类于LCNEC组,符合两者均起源于神经内分泌细胞支系的预期。另外,非吸烟者样本集中在亚型1,性别、肿瘤分期、患者年龄没有特殊分布趋势。
那么均以AC为主的亚型1-4之间有什么区别呢?TCGA网站根据mRNA表达特征将AC进一步分为三类:终端呼吸区(TRU)、近端炎症(PI)和近端增殖(PP)。基于这种分类,亚型1样本主要为TRU,亚型2样本主要为PI,亚型4样本则主要是PP。亚型3没有集中任何以上三种mRNA表达特征。
Lehti团队同时进行的基因测序表明:亚型1集中存在EGFR突变,亚型4集中存在STK11、KEAP1和SMARCA4突变,亚型5含有RB1突变,亚型6则含有TP53突变。
以上突变分布模式与蛋白网络分析结果是一致的:亚型4富集STK11突变蛋白;亚型5富集E2F1/MYC信号通路及RB1突变蛋白;亚型6含有p53信号通路和TP53突变蛋白。亚型5中全部SqCC样本都具有RB1突变,唯一没有聚类到亚型5中的LCNEC样本,具有STK11和KEAP1突变。这说明该蛋白组分析有效地反映了NSCLC的不同组织学分类各自具有的主要癌症分子特征和驱动性信号通路变化。
为了探究蛋白组信息与已知致癌基因之间更具体的关系,Lehti?团队选定了951种“癌症驱动相关蛋白”(CDRPs)。
在测定的832种CDRPs中,有291种在至少一个样本中显示出异常值(此处异常值设定为蛋白水平高或低于所有样本中值的三倍)。85%的样本具有至少一种致癌基因表达异常值,26%样本则至少含有5个致癌基因表达异常值。
所有6个亚型中,亚型5有最高的平均过表达致癌基因数,且通常包括转录激活因子MYB。在AC为主的亚型1–4中,亚型4是平均过表达致癌基因数量最多的,并大都包括受体酪氨酸激酶RET。更进一步的分析显示,NSCLC中过表达的除了广为人知的驱动基因(例如EGFR,ERBB2和KRAS),还包括一些不常被提到的其他致癌基因,例如致癌性激酶SGK1。
蛋白质谱数据加上基因组范围内的转录组及甲基化组数据,大大方便了Lehti?团队分析基因调控水平。虽然从整体来看,mRNA和蛋白质水平的正相关性很高,但仍有一部分CDRP的mRNA水平无法从蛋白组数据解释,这些基因的表达很可能受到了表观调控、转录调控或者转录后调控。
接下来,Lehti?团队开始分析不同样本中渗透免疫细胞的类型。根据Charoentong等人[3]划分的免疫特征,他们发现亚型2中有大量T细胞和干扰素(IFN)信号,亚型3中存在很高的B细胞特征信号,两者具有已明显分化的免疫响应。同时,亚型4中所有类型的免疫细胞信号都非常低,属于免疫冷型。
早期研究发现,富集B细胞的三级淋巴结构(TLSs)预示着良好的预后[4]和免疫治疗应答[5]。对此,Lehti?团队选取并分析了AC样本中PD-L1高表达(亚型2)或B细胞生物标志物高表达(亚型3)的肿瘤切片,验证了亚型3中不仅存在TLSs,还具有差异显着的组织生长模式。
那么这种区别会影响新抗原依赖性免疫细胞激活吗?
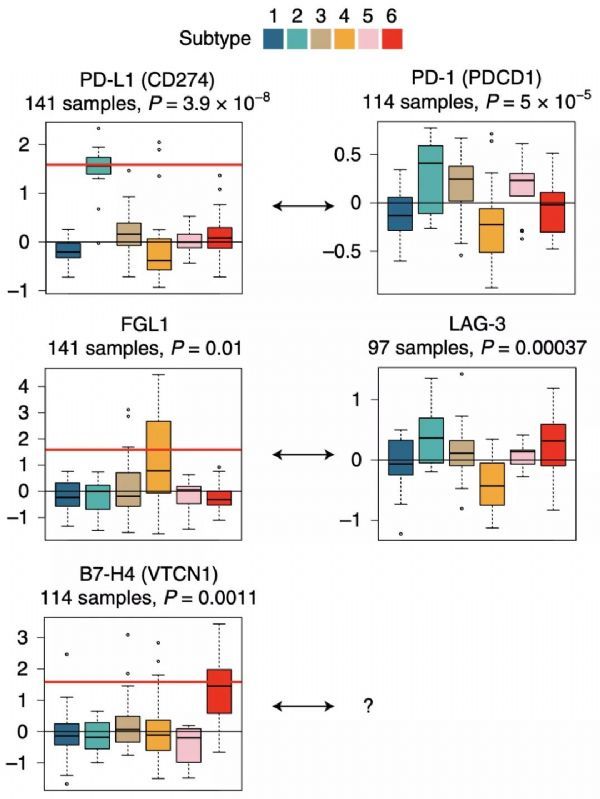
Lehti?团队对抗原呈递元件(APM)和肿瘤突变负荷(TMB)的分析显示:亚型2具有高APM和高TMB,亚型3具有高APM和低TMB,亚型4则具有高TMB和低APM。高APM和高TMB意味着新抗原的产生和呈递,从而诱导强烈的免疫激活。与此同时,PD-L1是亚型2特征性表达的标记蛋白之一。这都表明,靶向PD-L1/PD-1免疫检查点的治疗策略,对属于亚型2的病例将更为有效。
接下来,Lehti团队进行了免疫检查点的系统研究。他们发现,抑制性受体(IRs)的蛋白水平总体上与T细胞浸润相关,然而IR配体(通常由癌细胞和APCs产生)表达特征非常多样化,说明不同亚型中存在的免疫逃逸机制并不相同。最引人注目的是亚型2中高表达的IR配体PD-L1,同时大家还注意到另外两种特异性IR配体,即亚型4中的FGL1和亚型6中的B7-H4。
近期研究发现,FGL1由肿瘤细胞分泌,它是LAG-3的高亲和性配体,可带来FGL1-LAG-3介导的T细胞抑制[6]。B7-H4是一种防止自体免疫的检查点蛋白,在小鼠模型中,靶向B7-H4可以减少肿瘤生长速度和肺部转移灶形成。这些发现有力地支持了本研究对蛋白组亚型的免疫检查点分析,说明此类分析对于免疫检查点抑制剂的选择有重要预测价值。
Lehti团队对亚型4中的FGL1产生了兴趣。它背后是什么机理呢?
Lehti团队通过对蛋白及转录组的相关性分析发现,肿瘤抑制因子STK11/LKB1和FGL1这两者的蛋白表达水平具有很强的负相关,但相应的mRNA水平却没有这种相关性,说明STK11还受到转录后调控。
蛋白和mRNA表达均与FGL1相关性最高的是CPS1。CPS1是一种线粒体尿素循环酶,已有研究证明它在癌症中表达上调,是通过STK11失活后的AMPK-mTOR信号通路[9]。
通常情况下FGL1和CPS1仅在肝脏中表达,但本研究数据表明,在NSCLC中STK11失活导致了这两个基因的转录增加,导致细胞增殖加快、mTOR信号通路失控以及免疫逃逸。这个发现提示了一种新治疗策略:针对属于亚型4的病例,或许可以使用LAG-3/FGL1免疫检查点抑制剂和mTOR抑制剂联合治疗。
在NSCLC的攻坚战中,除早期筛查之外,预测治疗效果和优化治疗组合是最关键的临床需求,而这离不开对该疾病更加系统的理解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->