膀胱癌(NMIBC)新药!膀胱内BCG联合IL-15超级激动剂Anktiva治疗BCG无应答乳头状疾病2/3期研究成功!
来源:本站原创 2021-10-25 02:26
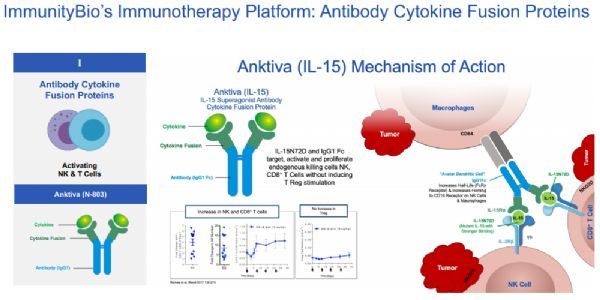
Anktiva(N-803)是一种新型的IL-15超级激动剂复合物
膀胱癌分期
2021年10月24日讯 /生物谷BIOON/ --ImmunityBio是一家临床阶段免疫治疗公司,近日该公司宣布,评估膀胱内卡介苗(BCG)联合新型IL-15超级激动剂复合物Anktiva(N-803)治疗BCG无应答高级别非肌肉浸润性膀胱癌(NMIBC)QUILT 3.032 2/3期研究(NCT03022825)的第二个适应症——乳头状疾病(队列B)达到了无病生存(DFS)主要终点,在治疗第12个月时,有57%的患者无病生存。该公司此前曾报告队列A(原位癌[CIS]患者)也达到了主要终点,完全缓解率为72%(58/81)。
非肌肉浸润性膀胱癌(NMIBC)占美国所有膀胱癌的75%-85%。大约90%的NMIBC病例为乳头状(Ta和T1期)。目前对高级别乳头状疾病的标准治疗是膀胱内BCG,无应答率在40%。
迄今为止,有73名患者入组队列B,中位随访17.3个月。通过Kaplan-Meier分析,队列B达到了主要终点:在12个月时的无病生存率为57%(95%CI:43.7%,68.5%),在18个月时的无病生存率为53%(95%CI:38.8%,64.6%)。2个队列的患者均出现了持久反应,治疗后显著避免了膀胱切除术。
队列B中Anktiva(N-803)的安全性与队列A中的安全性一致。队列A的安全性数据最近在美国泌尿学协会2021年年会上发表,其中严重不良事件(SAE)发生率为0%、免疫相关严重不良事件为0%。此外,85%的患者能够避免膀胱切除术。关于队列A(CIS)和队列B(乳头状)的疗效和安全性数据的全面分析将于2022年2月提交给美国临床肿瘤学会泌尿生殖道癌症研讨会(ASCO GU)。
ImmunityBio创始人、执行主席兼全球首席科学和医学官Patrick Soon Shiong医学博士表示:“30多年来,膀胱内卡介苗治疗一直是非侵袭性乳头状肿瘤患者的标准治疗方法,但不幸的是,其中约40%没有反应。Anktiva在CIS中显示出强大的疾病控制能力,根据我们研究的最新数据,它在乳头状肿瘤中显示出同样的效果。这使我们相信所有BCG无应答的NMIBC患者都有可能从这种联合治疗中获益。”
Anktiva作用机制(点击图片,查看大图)
膀胱癌在世界范围内的发病率较高。大约75-85%的膀胱癌存在局限于粘膜(Ta期,原位癌[CIS])或粘膜下层(T1期)疾病,这些类别被归类为非肌肉浸润性膀胱癌(NMIBC),其中约70%为Ta期,20%为T1期,10%为CIS。
在过去的30年里,卡介苗(BCG)免疫治疗一直是治疗NMIBC的标准。然而,疾病复发率和进展率仍然高得令人无法接受。对这些患者的标准护理建议包括终身侵入性监测和复发的快速治疗,造成巨大的经济负担和对生活质量的严重影响。在复发的患者中,大约30%的患者将在15年内病情进展并死于疾病,另外50%的患者将接受膀胱根治性切除术,这是一种切除整个膀胱的手术,可能需要切除其他周围器官以控制疾病。
尽管出现了微创手术和机器人技术,接受膀胱切除术患者的90天死亡率和发病率仍然高得令人无法接受,分别为3-6%和28-64%。基于这一迫切需要,美国FDA于2018年2月发布了针对BCG无应答非肌肉浸润性膀胱癌(NMIBC)的指南,指出BCG无应答NMIBC患者的治疗目标是避免膀胱切除术。
细胞因子白细胞介素15(IL-15)通过影响自然杀伤细胞(NK)和T细胞的发育、维持和功能,在免疫系统中起着至关重要的作用。Anktiva(N-803)是一种新型的IL-15超级激动剂复合物,由IL-15突变体(IL-15N72D)与IL-15受体α/igg1fc融合蛋白结合而成。其作用机制是通过β-γT细胞受体结合(而非α)直接特异性刺激CD8+T细胞和NK细胞,同时避免T-reg刺激。与天然的、非复合的IL-15相比,Anktiva在体内具有更好的药代动力学特性、在淋巴组织中的持久性和增强的抗肿瘤活性。
QUILT 3.032是一项开放标签、三队列、多中心的2/3期研究,正在评估膀胱内BCG+Anktiva治疗BCG无应答的高级别NMIBC患者(NCT03022825),该研究于2017年启动。2期研究队列A(Anktiva+BCG治疗CIS)和队列C(Anktiva治疗CIS)的主要终点是任何时候的CIS完全缓解率(CR),队列B(乳头状)的主要终点是12个月时的无病生存(DFS)。美国FDA根据1期数据授予了这项试验快速通道资格(FTD)。2019年12月,FDA根据2期研究的中期数据授予了突破性疗法认定(BTD),表明试验的主要终点已经达到。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->