5月Nature杂志重磅级亮点研究解读!
来源:生物谷原创 2024-05-30 11:09
为何熟能生巧?科学家揭示练习帮助大脑中新型记忆通路形成背后的分子机制、科学家发现潜在白血病疗法的新型靶点、揭示致幻剂药物与血清素受体相互作用从而产生潜在治疗性效益的分子机制
时光总是匆匆易逝,转眼间5月份即将结束,在即将过去的5月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:为何熟能生巧?科学家揭示练习帮助大脑中新型记忆通路形成背后的分子机制
doi:10.1038/s41586-024-07425-w
工作记忆,即信息在短时间内短暂保存和操控的过程,其对于大多数认知功能而言至关重要,然而,在较长的时间尺度上,工作记忆神经元背后的神经机制和进化机制,研究人员仍不清楚。
近日,一篇发表在国际杂志Nature上题为“Volatile working memory representations crystallize with practice”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,重复练习或许并不能帮助改善技能,而且还会导致大脑中记忆通路发生深刻改变。
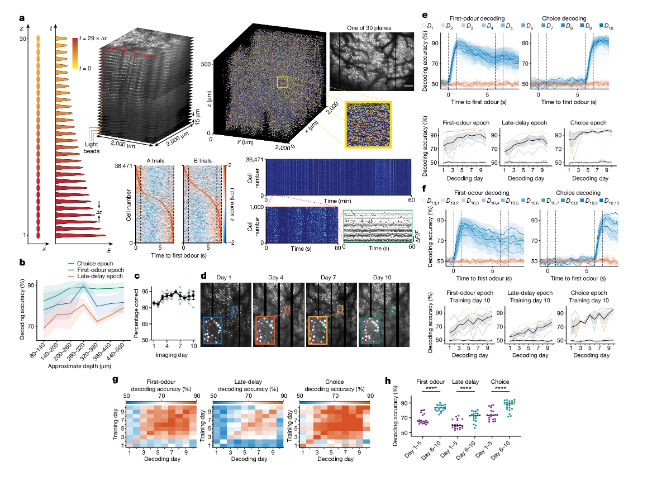
科学家揭示练习帮助大脑中新型记忆通路形成背后的分子机制
图片来源:Nature (2024). DOI:10.1038/s41586-024-07425-w
这项研究中,研究人员旨在揭示大脑中保留和处理信息的能力(即工作记忆,working memory)如何通过训练来改善。为了测试这一点,研究人员让小鼠在两周时间内识别和回忆一系列气味,随后他们通过使用一种新型定制化的显微镜来追踪小鼠在完成任务时的神经活性,这种显微镜能对整个大脑皮层中高达7.3万个神经元的细胞活性进行同时成像。
【2】Nature:科学家发现潜在白血病疗法的新型靶点
doi:10.1038/s41586-024-07410-3
磷酸肌醇-3-激酶-γ(PI3Kγ,Phosphoinositide-3-kinase-γ)被认为能作为一种特殊靶点促进肿瘤相关的巨噬细胞再极化并促进实体瘤患者机体的抗肿瘤免疫反应,然而,PI3Kγ在癌细胞中所扮演的内在角色,目前研究人员并不清楚。近日,一篇发表在国际杂志Nature上题为“Targetable leukaemia dependency on noncanonical PI3Kγ signaling”的研究报告中,来自哈佛医学院等机构的科学家们通过研究发现,髓系和淋巴细胞白血病的一个亚群或许依赖于名为PI3Kγ的分子复合体来生存。
本文研究提供了机制性和临床前研究证据支持快速启动急性髓性白血病(AML)患者的临床试验,从而测试一种称之为eganelisib的药物单独或与最常用于AML的化疗药物阿糖孢苷(cytarabine)联合使用所产生的治疗效应。医学博士Andrew Lane说道,鉴于目前的观察性研究结果,我们能非常迅速利用这些药物,其似乎对于AML患者是安全且耐受性良好的,我们计划明年开始临床试验。
针对AML患者的治疗在过去十年里取得了巨大进展,但大多数患者最终还会在治疗后发生复发,靶向作用AML相关突变的疗法为部分患者提供了治疗选择,尽管癌症最终会进化到躲避治疗。这项研究中,研究人员采用了一种不同的方法来寻找治疗性靶点,他们并没有将重点放在突变上,而是利用全基因组CRISPR干扰来寻找AML细胞赖以生长所需要的特殊基因。最后研究人员发现,白血病细胞亚群或许依赖于名为PI3KR5的基因来生存,该基因能产生PI3Kγ复合体的重要部分。
【3】Nature:揭示致幻剂药物与血清素受体相互作用从而产生潜在治疗性效益的分子机制
doi:10.1038/s41586-024-07403-2
诸如麦角酸酰二乙氨(LSD,lysergic acid diethylamide)和裸盖菇素(psilocybin)等迷幻物质能展现出治疗多种神经精神疾病的潜力。近日,一篇发表在国际杂志Nature上题为“Structural pharmacology and therapeutic potential of 5-methoxytryptamines”的研究报告中,来自西奈山Icahn医学院等机构的科学家们通过研究揭示了一类致幻剂(psychedelic drugs)结合并激活血清素受体从而给神经精神疾病(抑郁症和焦虑症)患者产生潜在治疗效益背后的分子机制。
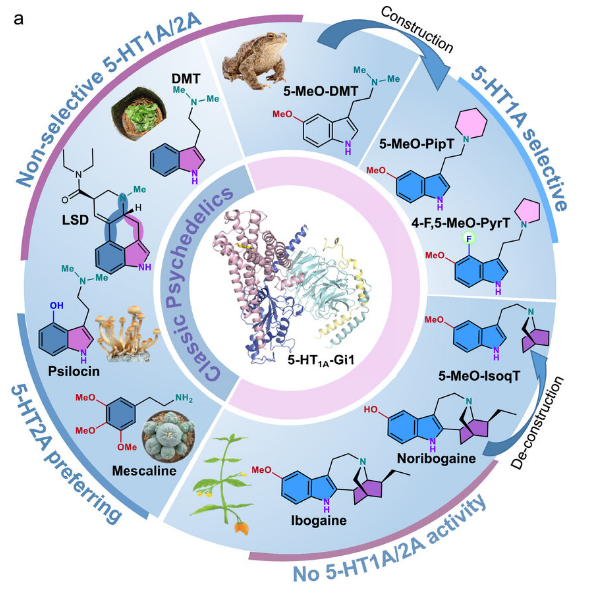
揭示致幻剂药物与血清素受体相互作用从而产生潜在治疗性效益的分子机制
图片来源:Nature (2024). DOI:10.1038/s41586-024-07403-2
文章中,研究者Audrey Warren说道,特定的致幻剂或能与大脑中名为5-HT1A的血清素受体家族成员相互作用,从而在动物模型中就能产生一定的治疗效益。诸如LSD和裸盖菇素等致幻剂目前已经进入了相应的临床试验,且已经取得了有希望的初步研究结果,尽管研究人员尚无法理解其如何与大脑中不同的分子靶点结合从而来诱发一定的治疗效益。研究人员首先揭示了诸如5-HT1A的血清素受体如何调节机体致幻经历的主观效应,并在临床所观察到的治疗解决中扮演着潜在的重要角色。
LSD和5-MeO-DMT(一种在科罗拉多河蟾蜍分泌物中发现的致幻物质)能通过血清素受体5-HT2A来介导致幻效应,尽管这些药物也能激活5-HT1A,而5-HT1A是一种有望治疗抑郁症和焦虑症的有效治疗性靶点。研究人员通过联合研究在细胞信号实验和冷冻电镜下合并并测试了5-MeO-DMT衍生物,旨在识别出最有可能促使药物激活5-HT1A 而不是5-HT2A的化学组分。
【4】Nature:鉴定出一种负责修复受损肝脏组织的新型肝细胞
doi:10.1038/s41586-024-07376-2
近日,一篇发表在国际杂志Nature上题为“Multimodal decoding of human liver regeneration”的研究报告中,来自苏格兰爱丁堡大学的研究人员首次发现了一种负责修复受损肝脏组织的细胞,即ANXA2+迁移性肝细胞亚群(ANXA2+ migratory hepatocyte subpopulation)。他们揭示了这些新发现的细胞如何迁移到肝脏中的受损部位,从而为人们了解肝脏自我修复的方式提供了新的视角。这些发现可能促进利用肝脏在受损后再生的独特能力的开发新的疗法。
在急性肝功能衰竭期间,这种修复和再生的能力往往不堪重负,患者需要进行紧急肝移植才能恢复肝功能。在这项新的研究中,这些作者研究了来自急性肝衰竭患者的人体肝组织,以寻找肝功能迅速丧失后细胞增殖和再生的迹象。他们发现,在这些肝组织种,相当一部分细胞保留了增殖能力。然而,患者的肝脏仍有大量区域受损,这表明在再生过程中,细胞增殖以外的过程也至关重要。
他们对健康和再生性的人体肝脏组织中每个肝细胞内的基因进行了分析,以更好地了解这种再生过程。他们采用了一种名为单细胞RNA测序的前沿技术。他们的研究结果发现了一种以前未被发现的伤口愈合肝细胞群体,它们在人体肝脏再生过程中出现,促进了肝脏恢复。他们利用特殊成像技术在小鼠体内观察这些伤口愈合肝细胞。
【5】Nature:新研究揭秘肺部“守护者”!气道小丘与再生奇迹
doi:10.1038/s41586-024-07377-1
在呼吸的奥秘深处,隐藏着自然界的一项新奇设计——气道小丘,这些神秘的肺部结构,宛如微型山丘般守护着我们的呼吸道,而它们在气道生物学和病理学中的作用以前一直不为人知。
近日,一篇发表在国际杂志Nature上题为“Airway hillocks are injury-resistant reservoirs of unique plastic stem cells”的研究报告中,来自美国塔夫茨大学医学院等机构的科学家们通过研究表明,气道小丘及其干细胞在生理上有别于肺部内的其他细胞,它们由鳞片状鳞状细胞(scale-like squamous cell)的分层外层组成,这层鳞状细胞保护着下层快速扩张的基底干细胞(basal stem cell),这些干细胞能够在损伤后恢复气道组织。
研究者Brian Lin说道,这项新的研究将以前描述为不同现象的研究与未被重视的抗损伤细胞库联系起来。通过对整个器官进行染色,我们发现了在切片观察组织时不容易看到的结构。”2019年,Lin首次描述这种称为“气道小丘”的细胞。“气道小丘”之所以得名,是因为它们很像肺组织表面上的小丘。
研究者表示,气道小丘的确定解释了有关气道再生的一系列发现。这些结构被忽视了几十年,这真是了不起。它们对再生医学和癌症都有影响”。在这项新的研究中,研究团队通过创新的遗传小鼠模型,首次在活体中点亮了气道小丘及其干细胞的动态世界,证明了这些干细胞不仅能快速再生气道内壁,还能生成构成气道上皮的所有六种细胞类型。更为惊奇的是,小丘表面的坚固鳞状细胞层,犹如天然的防弹衣,有效抵御了多种外界伤害,包括物理性、化学性损伤乃至烟草毒素的侵袭。
【6】Nature:新研究首次发现胚胎细胞收缩驱动人类胚胎形成最初的形状
doi:10.1038/s41586-024-07351-x
近日,一篇发表在国际杂志Nature上题为“Mechanics of human embryo compaction”的研究报告中,来自法国国家科学研究中心(CNRS)等机构的研究人员发现人类胚胎压实(embryo compaction)是胚胎发育最初几天的一个重要步骤,是由胚胎细胞的收缩驱动的。这些发现与人们推测的细胞粘附在这一现象中的驱动作用相矛盾,为改进辅助生殖技术(assisted reproductive technology, ART)铺平了道路。
在人类,胚胎细胞压实是胚胎正常发育的关键步骤。受精四天后,细胞相互靠近,使胚胎形成最初的形状。有缺陷的压实会阻碍确保胚胎能够植入子宫的胚胎结构的形成。在辅助生殖技术中,胚胎植入前要对这一阶段进行仔细监测。
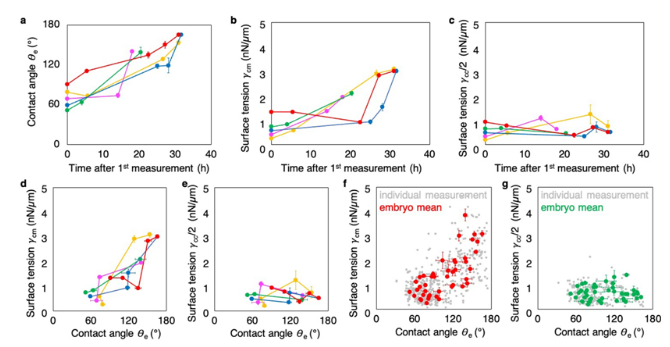
图片来源:Nature, 2024, doi:10.1038/s41586-024-07351-x
这些作者在研究这一鲜为人知的现象的作用机制时发现了一个惊人的发现:人类胚胎的压实是由胚胎细胞的收缩所驱动的。因此,压实问题是由于这些细胞的收缩能力有问题造成的,而不是像以前假设的那样是由于它们之间缺乏粘合力造成的。这一机制已在果蝇、斑马鱼和小鼠身上发现,但在人类身上尚属首次。
doi:10.1038/s41586-024-07234-1
近日,一篇发表在国际杂志Nature上题为“Chromatin accessibility during human first-trimester neurodevelopment”的研究报告中,来自瑞典卡罗林斯卡医学院等研究机构的研究人员绘制出人类大脑早期遗传发育图谱,详尽记录了胚胎第六至第十三周的精密神经发育图谱。这一开创性图谱不仅为探究儿童脑肿瘤的发生机制开辟了新径,还为寻求创新治疗策略点亮了希望之光。
研究者Sten Linnarsson教授表示,这是首次以基因调控为重点对大脑发育进行的全面研究。以往研究大都聚焦于大脑皮层,而我们则实现了对全脑结构的系统性绘制,使各个区域间的比较分析成为可能,这无疑是一次深度与广度并重的科学跨越。”人类大脑的胚胎期演变始于一根简朴的管道结构,其壁面逐步演化为错综复杂的大脑组织,而中空的管道则演化为脑室——颅内的神秘空域。
在妊娠第6到13周期间,管壁上的细胞会快速特化。这是通过一个非常复杂的级联反应发生的,其中分泌的物质会诱导第一批细胞依据特定指令分化,随后释放更多信号引导后续细胞的特化步骤,形成一个动态且精准的调控网络。
【8】Nature:揭示胆碱通过FLVCR2蛋白进入大脑机制
doi:10.1038/s41586-024-07326-y
近日,一篇发表在国际杂志Nature上题为“Structural and molecular basis of choline uptake into the brain by FLVCR2”的研究报告中,来自美国哥伦比亚大学等机构的科学家们通过研究发现了可能能够用于帮助将药物递送到大脑中以治疗神经系统疾病的分子通道。他们指出一种名为胆碱(choline)的必需营养物通过一种名为FLVCR2的蛋白递送到大脑。
研究者Rosemary Cater博士说,“胆碱是一种类似维生素的营养物,对人体的许多重要功能,尤其是大脑发育至关重要。我们每天需要摄入400~500毫克的胆碱,以支持细胞再生、基因表达调控以及神经元之间的信号传递。”
在此之前,人们对饮食中的胆碱如何通过将血液与大脑分开的特殊细胞层所知甚少。她说,“血脑屏障可以防止血液中对大脑有毒的分子进入大脑。大脑仍然需要从血液中吸收营养物,因此血脑屏障含有专门的细胞机器,即所谓的转运体,从而允许葡萄糖、ω-3 脂肪酸和胆碱等特定营养物进入大脑。虽然血脑屏障是一道重要的防线,但它对设计治疗神经系统疾病的药物提出了挑战。”
【9】Nature:大脑仅在夜间睡眠的前半段会削弱清醒时形成的新突触
doi:10.1038/s41586-024-07367-3
近日,一篇发表在国际杂志Nature上题为“Sleep pressure modulates single-neuron synapse number in zebrafish”的研究报告中,来自英国伦敦大学学院的研究人员以斑马鱼为研究对象,发现在睡眠期间,大脑会削弱清醒时形成的神经元之间的新连接,但这只发生在夜间睡眠的前半段。这一发现让人们对睡眠的作用有了更深入的了解,但夜间后半段的睡眠到底有什么功能,这仍然是一个悬而未决的问题。他们指出这项新的研究支持了“突触平衡假说(Synaptic Homeostasis Hypothesis)”。
研究者Jason Rihel教授表示,当我们清醒时,脑细胞之间的连接会变得更强、更复杂。如果这种活动有增无减,在能量上将难以为继。脑细胞之间太多活跃的连接可能会阻碍第二天新连接的建立。虽然睡眠的功能仍然很神秘,但它可能是一段‘离线’时期,在这段时间里,大脑中的这些连接会被削弱,为我们第二天学习新事物做准备。”
在这项新的研究中,这些作者使用了光学上半透明的斑马鱼,通过基因可以轻松地对突触(脑细胞之间的通信结构)进行成像。他们对斑马鱼进行了几个睡眠-清醒周期的监测。他们发现,脑细胞在清醒时获得更多连接,而在睡眠时则失去连接。他们发现,这取决于它们在被允许休息之前积累了多大的睡眠压力(睡眠需求);如果他们让斑马鱼少睡几个小时,这些连接就会继续增加,直到它们能够入睡。
【10】Nature:新进展!在哺乳动物中,父亲体内的肠道微生物组竟会影响后代的健康
doi:10.1038/s41586-024-07336-w
近日,一篇发表在国际杂志Nature上题为“Paternal microbiome perturbations impact offspring fitness”的研究报告中,来自欧洲分子生物学实验室(EMBL)等机构的科学家们通过研究发现,破坏雄性小鼠的肠道微生物组(gut microbiome)或会增加其后代患病的风险。肠道微生物组是占据胃肠道的微生物群落。它负责产生酶、代谢物和对宿主代谢至关重要的其他分子,并对环境做出反应。
因此,平衡的肠道微生物组在许多方面对哺乳动物的健康非常重要,如帮助调节免疫系统和内分泌系统。这反过来又会影响全身组织的生理机能。然而,人们对肠道微生物组对宿主繁殖的影响,以及父本体内肠道微生物组的改变是否会影响其后代的健康状况知之甚少。Hackett团队与EMBL 实验室的Peer Bork团队和Michael Zimmermann团队合作,着手回答这个问题。他们的研究表明,破坏雄性小鼠的肠道微生物组会增加其后代出生时体重过轻的概率,而且更有可能早夭。
为了研究肠道微生物组对雄性繁殖及其后代的影响,这些作者用不进入血液的普通抗生素治疗雄性小鼠,改变了它们的肠道微生物组成。这会诱发一种叫做菌群失调(dysbiosis)的情况,即肠道中的微生物生态系统变得不平衡。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


